可变剪接的表观遗传学调控机制及其在脂肪代谢中的作用研究进展
骞 鑫,马海明,何 俊,徐 康,张跃博*
(1.湖南农业大学动物科学技术学院,湖南长沙 410128;2.中国科学院亚热带农业生态研究所,湖南长沙 410125)
mRNA 的转录后加工是基因表达必需一个基本的生物学过程,在高等真核生物中蛋白质多样性很大程度上是由Pre-mRNA 可变剪接引起的,约90% 的人类基因经历此过程,基因通过可变剪接等表达调控机制控制着细胞的增殖、分化、凋亡等生物学进程,剪接的异常会引起蛋白质的功能异常甚至导致疾病的发生[1-2],所涉及的详细机制则需要进一步的研究。表观遗传修饰是在不改变DNA 序列的基础上参与基因组的调控,即可以直接作用在DNA 或RNA 上,也可以作用在与DNA结合的蛋白上,对表观遗传学修饰的研究将大大提高对基因表达调控的理解[3-4],越来越多的研究证明DNA 甲基化、RNA 编辑以及非编码RNA 等表观遗传学修饰在可变剪接的启动以及剪接位点的识别中起到重要作用,这提示着表观遗传学在pre-mRNA剪接中的重要意义[5]。脂质是细胞内重要的组成成分和信号分子,参与细胞各生命活动,机体在生理或病理条件下能改变细胞内脂质组成,针对脂质代谢的研究对治疗疾病或者改良动物经济性状都具有重要意义。近年来已经有大量证据证明可变剪接在脂质代谢过程发挥着重要作用。本文主要介绍了表观遗传学对于可变剪接的调控机制以及可变剪接在脂肪代谢中相关功能的研究进展。
1 可变剪接的表观遗传学调控
在Pre-mRNA 剪接过程中,剪接体在剪接因子的辅助下识别并结合到mRNA 前体位于外显子/内含子边界的特定序列,将内含子切除和外显子连接产生成熟的mRNA[6]。在此过程中,表观遗传学修饰起着重要作用,这涉及到DNA 甲基化(DNA Methylation)、RNA 编辑、组蛋白修饰等多种表观遗传学进程,以下主要介绍表观遗传学修饰对于可变剪接的调控机制。
1.1 DNA 甲基化与可变剪接 DNA 甲基化是在DNA甲基化酶(DNA methyltransferases,Dnmt)的作用下,以S-腺苷甲硫氨酸作为甲基供体,使DNA 序列上特定的碱基通过共价键结合的方式获得1 个甲基团的化学修饰过程[7]。DNA 甲基化不仅可通过调控RNA 聚合酶II(pol II)在Pre-mRNA 上的移动速率来影响剪接信号的识别,还能通过影响组蛋白修饰调节剪接调节因子的招募,从而实现对Pre-mRNA 剪接的调节。
CTCF 是一种可以与DNA 序列产生特异性结合的DNA 结合蛋白,其与DNA 序列的特异性结合可调节pol II 在pre-mRNA 序列上的移动速率。DNA 甲基化可以抑制CTCF 与DNA 序列上外显子的特异性结合,影响剪接过程中外显子的剪接[8]。MeCP2 可以通过与甲基化DNA 的特异性结合抑制其下游靶基因的转录。当DNA 发生甲基化时会促使MeCP2 结合在DNA 序列上招募组蛋白去乙酰酶,使剪接位点上游组蛋白发生去乙酰化,导致pol II 在Pre-mRNA 序列上延伸速率减缓,缓慢延伸的pol II 较正常生理情况下的pol II 更能够识别序列上弱的剪接信号,使得剪接时外显子得以保留[9]。
在Pre-mRNA 的剪接过程中,HP1 可以协助招募U2 snRNP 到H3K9 甲基化组蛋白上,进而影响靶序列转录调节因子的招募[10]。为证明DNA 甲基化对于剪接的调控与HP1 相关,Yearim 等[10]对受甲基化影响的外显子剪接区域和受HP1 介导的组蛋白修饰影响的外显子剪接区域进行定位比对,结果显示受甲基化影响的靶基因剪接区域与受HP1 介导的组蛋白修饰影响的外显子剪接区域基本相同,证明了DNA 甲基化对靶基因的剪接调控与HP1 之间存在着一定关系。
1.2 N6-甲基腺嘌呤与可变剪接 N6-甲基腺嘌呤(N6-methyladenosine,m6A)修饰是高等生物mRNA 上最为普遍的修饰,约占所有RNA 修饰的60%以上[11]。m6A过程是由METTL13、METTL14、WTAP、RBM15、KIAA-1429 等甲基化酶催化完成的,这些酶在哺乳动物中被称为“Writers”,m6A 甲基化过程是可逆的,整个过程由FTO、ALKBH5 等去甲基化酶催化,这些酶被统称为“Erasers”,而m6A 对可变剪接产生调控作用是通过YTHDF1、eIF3 等名为“Readers”的甲基化阅读蛋白来实现。
METTL13、METTL14 和WTAP 是具有代表性的m6A 甲基化酶,其功能是催化Pre-mRNA 上腺苷酸发生m6A 修饰,三者通过形成WMM 复合物行使对基因剪接的调控功能。Ping 等[12]对缺乏WMM 复合物的细胞中的基因进行功能富集分析,发现富集在RNA 加工功能上的差异表达基因显著减少,说明m6A 甲基化酶通过可变剪接在RNA 的多样性上起到至关重要的作用。
FTO 作为标志性的去甲基化酶,其表达量和m6A甲基化水平呈负相关。Zhao 等[13]研究发现,在3T3-L1 细胞中m6A 修饰富集于5' 或者3' 剪接位点附近的外显子区域内,与参与mRNA 剪接调控的一种RNA 结合蛋白结合区域重叠,当FTO 表达量过低时,m6A 水平升高可以促进剪接因子SRSF2 的RNA 结合能力,最终导致剪接过程中外显子保留。在脂肪的生成过程中,具有催化活性的FTO 对于脂肪细胞的分化以及脂肪的生成具有促进作用,这揭示了依赖FTO 的m6A 去甲基化作为RNA 加工的一种新的调控机制,在脂肪形成的调控中发挥着关键作用。
YTHDF1 作为一种阅读蛋白,其主要功能是识别发生m6A 修饰的碱基,从而激活下游的调控通路。YHTDF1 可以识别编码序列和3'-UTR 区上的m6A 修饰并招募剪接调节因子SRSF 与之结合,进而对下游的剪接进行调控,其中SRSF3 和SRSF10 与YHTDF1 的结合区域基本相同,说明这2 种剪接调节因子与YHTDF1 的结合具有竞争性,但SRSF3 比SRSF10 具有更高的优先级。在正常生理条件下YHTDF1 识别m6A 并且优先招募SRSF3 并与之结合,促进外显子保留[14]。
1.3 RNA 编辑与可变剪接 RNA 编辑即在初级转录本中发生碱基的加入、丢失或转换现象。在某些情况下,通过RNA 编辑在非剪接位点附近形成典型的剪接受体末端会导致剪接提前发生。腺苷脱氨酶2(Adenosine Deaminase RNA Specific 2,ADAR2)的Pre-mRNA 中腺苷到肌苷的核苷酸修饰已被证明影响下游的可变剪接事件[16],Shenasa 等[17]通过将大鼠ADAR2基因AA 编辑为AI,由此产生的AI 二核苷酸被识别为3'剪接位点,导致剪接激活,新的3'剪接位点的出现增加了47 个核苷酸到ADAR2mRNA,最终导致阅读框架改变,而该基因发生RNA 编辑所产生的异常转录本亦能反向调控该基因RNA 前体的RNA 编辑,揭示了RNA 编辑是调节ADAR2不同转录本表达水平的一种调节机制[18]。此外,如富含丝氨酸/精氨酸(Serine/Arginine-Richprotien,SR)蛋白和核不均一核糖蛋白(Heterogeneous Nuclear Ribonucleoprotein,hnRNPs)等反式作用因子可以通过与顺式作用元件序列上的剪接调控元件(Splicing Regulatory Elements,SREs)结合来调节内含子保留水平。Solomon 等[19]研究发现,在ADAR编辑位点上A到I 的编辑可以制造或破坏顺式作用元件上的SREs,从而影响外显子上剪接因子的结合,这是RNA 编辑对于可变剪接的另一种调控机制。
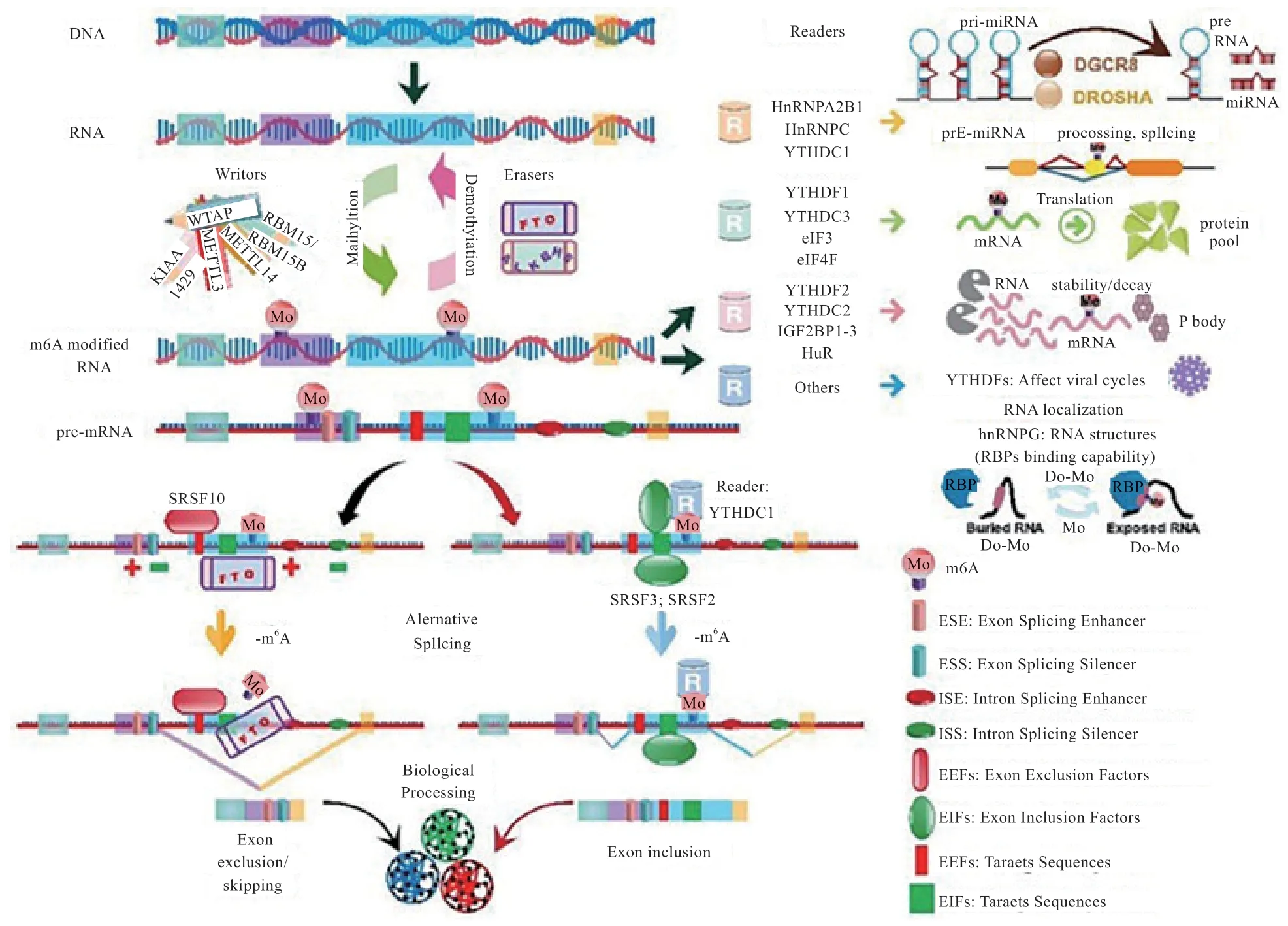
图1 m6A 对可变剪接的调控机制[15]
1.4 组蛋白修饰与可变剪接 组蛋白是存在于真核生物染色质中与DNA 结合的蛋白质,组蛋白的N 末端尾部和球状结构域含有许多可被修饰的氨基酸,可通过发生一系列共价修饰改变染色质构型或者招募转录调节因子调控Pre-mRNA 剪接[20]。组蛋白去乙酰化酶抑制剂TSA 对细胞的处理可诱导神经细胞黏附分子(Neural Cell Adhesion Molecule,NCAM)外显子18 的外显子跳跃[21],生理条件下人神经细胞的去极化增加了NCAM外显子18 周围的H3K9 乙酰化和H3K36 甲基化,致使转录速率加快,诱导发生外显子跳跃事件[22],与利用组蛋白去乙酰化酶抑制剂TSA 对细胞处理后的NCAM具有相同效果,提示着细胞去极化可能通过局部组蛋白的乙酰化和甲基化调控外显子的剪接。成纤维细胞生长因子受体2(Fibroblast Growth Factor Receptor 2,FGFR2)通过可变剪接产生2 种具有高度的组织特异性的剪接变体FGFR2-IIIb 和FGFR2-IIIc。在间充质细胞中,FGFR剪接位点附近富集的H3K36me3 与H3K4me1 修饰通过对招募剪接因子的影响Pre-mRNA的剪接最终产生FGFR2-IIIc,上皮细胞中FGFR剪接位点附近主要发生H3K27me3 和H3K4me3 修饰,其剪接形式则主要是外显子IIIb 保留[23-24]。Luco 等[23]通过过表达或下调组蛋白甲基转移酶调控H3K36me3 或H3K4me3 水平可以操控FGFR2的剪接方式,揭示了通过对组蛋白修饰调控可影响外显子的剪接。腺病毒E1A相关蛋白BS69 是一种具有多个功能结构域的细胞蛋白,包括PHD、Bromo、PWWP 以及MYND 结构域[25],该蛋白上的PWWP 结构域可以特异性识别H3K36me3以及H3.3K36me3 并与之结合,作为剪接因子调控pol II的延伸速率最终影响可变剪接[26]。此外,BS69 还可以通过识别H3.3K36me3 并招募调控U5 snRNP 生成的剪接因子EFTUD2 调控Pre-mRNA 的剪接[27]。
1.5 非编码RNA 与可变剪接 非编码RNA(Non-coding RNA,ncRNA)是从基因组上转录而来不具备翻译功能的RNA[28]。按照其生物学功能,可以将ncRNA 分为持家ncRNA 以及调控ncRNA,其中调控ncRNA 又包括短调控ncRNA(如siRNA、miRNA)、长调控ncRNA(如lncRN)等[29],ncRNA 不仅可以从RNA水平上影响基因表达,还可以通过影响组蛋白修饰等间接影响剪接行使对基因的表达调控功能。
1.5.1 sncRNA 与可变剪接 miRNA 是一类小于22nt 的sncRNA,参与调节所有细胞信号通路,其表达水平的改变与组织的生长发育和疾病有关[30-31],miRNA 主要位于编码基因的内含子中,通过碱基配对与细胞质中靶mRNA转录本的3'-UTR 区域结合,参与基因剪接的负调控[32]。miRNA-99b 存在于精子顶体相关6(Sperm Acrosome Associated 6,SPACA6)的内含子中,LINC01129 是由该基因从反义方向转录所形成的一种转录本,miRNA-99b 在SPACA6 的反义方向转录中起到一定作用,miRNA-99b 与SPACA6第1 个内含子的5'剪接位点完全互补。这种互补性表明miRNA-99b 可通过与U1 snRNPs、U6 snRNPs 竞争性结合抑制LINC01129 初级转录本的表达,从而在SPACA6和LINC01129 之间的表达平衡中发挥作用[33]。另外,miRNA-211[34]与DNA 序列的识别并结合被证明可以促进内含子的保留,其中机制与限制性内切酶活性有关。
RNA 干扰(RNA interference,RNAi)是一种基因沉默机制,siRNA 是一种与互补序列结合来抑制基因表达的长22~24 个碱基的sncRNA[35]。siRNA 介导的基因沉默分为胞质(Posttranscriptional Gene Silencing,PTGS)和胞核(Chromatin-Dependent Gene silencing,CDGS)2 种,其中CDGS 中siRNA 在转录和共转录基因调控中的作用与可变剪接关系密切[36]。Alló 等[37]研究发现,siRNA 可以与Pre-mRNA 内含子与外显子边界的剪接位点结合,调控外显子的剪接,在siRNA 结合位点附近发现富集有异染色质标记H3K9me2 和H3K27me3,Pre-mRNA 序列可以通过识别这些异染色质标记招募异染色质相关蛋白,从而降低pol II 的合成,这亦是一种剪接相关的动力学机制。
1.5.2 长链非编码RNA 与可变剪接 长链非编码RNA(Long non-coding RNA,lncRNA)的长度大于200 nt,但无明显蛋白质编码功能[38]。根据lncRNA 的宿主基因在基因组中的位置,lncRNA 可分为基因间lncRNA、天然反义lncRNA 及内含子lncRNA[39]。lncRNA 对可变剪接的调控主要有3 种方式:与特定剪接因子相互作用调节剪接、与Pre-mRNA 形成RNA-RNA 双链调控剪接、通过染色质修饰调控剪接[40]。
lncRNA 与SR 蛋白以及hnRNPs 等剪接因子相结合是lncRNA 调控可变剪接的一条重要途径[15]。lncRNA通过调节SR 蛋白上SR 结构域的磷酸化水平影响SR 蛋白与Pre-mRNA 的结合,最终导致剪接过程中剪接位点的改变。过氧化物酶体增殖物激活受体γ(Peroxisome Proliferator-Activated Receptorγ,PPARγ)的可变剪接能够产生2 种转录本PPARγ1 和PPARγ2,其所编码的蛋白在脂肪形成过程中起到驱动作用[41]。研究发现PPARγ的剪接过程受到SR 蛋白SRp40 磷酸化水平的正向调节。在脂肪细胞分化过程中,lncRNA NEAT1 可以与Clk 激酶相互作用调节SRp40 的磷酸化水平,影响PPARγ的剪接从而对脂肪细胞的分化产生调控[42]。
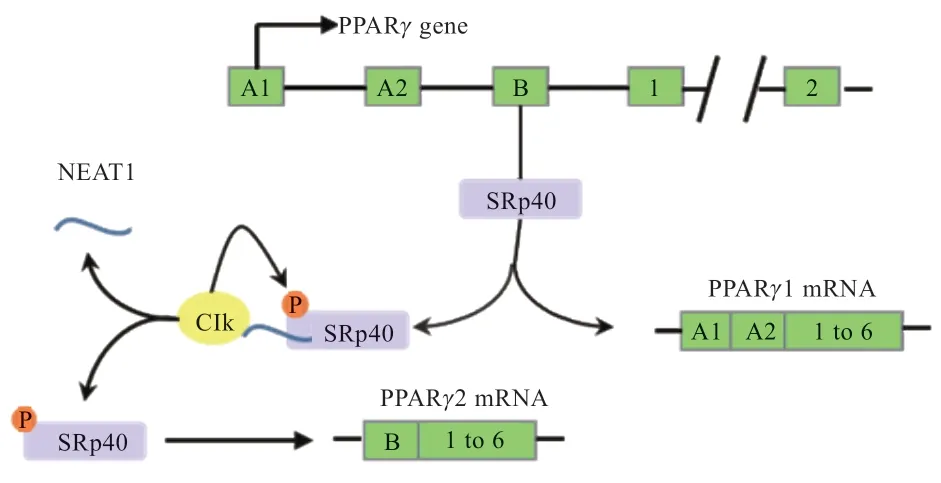
图2 NEAT1 对PPARγ 剪接影响机制
lncRNA 通过与Pre-mRNA 形成RNA-RNA 双链调控内含子保留的研究发现,在E 盒结合锌指蛋白2(Zinc Finger E-box Binding Homeobox 2,Zeb2)上,该基因是编码上皮—间质转化(Epithelial-Mesenchymal Transition,EMT)的E—钙黏蛋白的转录抑制因子[43],Zeb2对于上皮—间质转化受到上皮细胞中snail1 转录因子的调控。Zeb2基因5'—UTR 上的长片段内含子存在的核糖体进入位点(Internal Ribosome Entry Sites,IRES)对于蛋白表达是必需的,通常情况下该基因通过剪接将含有IRES 的内含子剪掉从而阻止Zeb2蛋白翻译,snail1通过反义方向转录产生的lncRNA 可以与5'-UTR 上的5'剪接位点结合导致该区域内含子保留,促进Zeb2翻译并最终激活EMT[43]。
人类FGFR2基因反义方向转录形成的lncRNA 可以通过诱导染色质修饰剂对FGFR2剪接位点附近的染色质环境进行修饰来调控FGFR2的剪接。在FGFR2剪接过程中,该lncRNA 通过与Pre-mRNA 形成RNARNA 异源双链核酸分子招募染色质修饰剂KDM2a 对染色质进行修饰,所产生的染色质环境可以阻止抑制性剪接因子与Pre-mRNA 序列的结合,有利于FGFR2外显子IIIb 的保留[44]。
2 可变剪接在脂肪代谢中的功能
脂肪组织是体内重要的内分泌组织,脂肪细胞不仅储存脂质,也可以释放一系列脂肪因子调节能量消耗[45],哺乳动物脂肪组织根据形态、功能以及发育起源的不同可分为白色脂肪组织(White Adipose Tissue,WAT)和棕色脂肪组织(Brown Adipose Tissue,BAT)[46]。WATs主要功能是把多余脂肪存储在体内,过多摄入WATs 便会产生肥胖;而BATs 负责分解引发肥胖的白色脂肪组织。基因的剪接对脂肪细胞的分化以及脂肪代谢具有明显的调控作用。该部分主要综述可变剪接在脂肪代谢调控中的功能相关研究进展。
2.1 可变剪接与脂肪合成代谢 矮小相关转录因子1(Runt-Related Transcription Factor 1,Translocated to 1,RUNX1T1)是参与胚胎干细胞造血分化的髓系易位基因家族成员[47],可以作为脂肪发生相关的转录因子。RUNX1T1在外显子6 附近位点不同的剪接形式产生2 种剪接变体[48-49],FTO通过调节剪接位点周围的m6A 水平来控制脂肪生成调节因子RUNX1T1的外显子剪接,从而调节分化[48-50]。在小鼠前脂肪细胞中,外显子6 缺失转录本过表达抑制脂肪细胞分化,外显子6 包含转录本的表达对脂肪细胞分化和脂肪生成具有促进作用[13,51]。
丝裂原活化蛋白4 激酶4(Mitogen Activated Protein Kinase Kinase 4,MAP4K4)是一种丝氨酸/苏氨酸激酶,属于MAPK 信号通路上游激活因子,参与细胞的多种生物学活动[52]。该基因在人体大部分组织中均有表达,其中大脑和睾丸中表达量更高[53],但其全部功能还尚未完全清楚。最近的一项研究表明,MAP4K4表达量的增加减弱了胰岛素介导的信号转导参与BATs 的发育,并与其剪接异常有关[54]。Peng 等[54]研究发现,在脂肪细胞分化的不同阶段,MAP4K4 的剪接形式均存在差异,其中机制还需要进一步探索。
PPARγ属于激素配体依赖性核受体家族,该基因控制脂肪酸结合蛋白4(Fatty Acid Binding Protein4,FABP4)、脂蛋白脂肪酶以及脂肪细胞因子等在脂肪细胞中发挥关键作用的效应蛋白的表达。PPARγ在调节脂肪生成早期阶段的转录事件中起关键作用,对于实现成熟脂肪细胞的功能也是必不可少的[41],PPARγ基因利用不同剪接机制产生PPARγ1 和PPARγ2,这2 种转录本由不同的5'-UTR 和6 个编码外显子组成,其中PPARγ1在肝脏、心脏、骨骼肌和白色脂肪组织中广泛表达,而PPARγ2 在N 末端包含28 个额外的氨基酸,主要存在于脂肪组织中[55]。体外的功能试验表明,不管是PPARγ1还是PPARγ2 对于脂肪生成都是必须的,PPARγ2 在棕色脂肪生成中是一种更有效的转录激活因子。
2.2 可变剪接与脂肪分解代谢 脂肪分解是在一系列脂肪分解酶的作用下对细胞内脂质进行水解的过程,该过程对于体内的能量供给以及维持体内脂肪储存具有重要意义。目前对于可变剪接在脂肪分解代谢中的功能研究还相对较少,但是已经有证据证明基因可以通过可变剪接对脂肪分解产生一定的调控作用。激素敏感脂肪酶(Hormone-Sensitive Triglayceride Lipase,HSL)是细胞内脂质水解的关键限速酶,其表达变化能在一定程度上反映脂肪的分解能力[64]。hHSL-S 是人脂肪细胞HSL剪接时外显子6 跳跃形成的新转录本。Laurell 等[65]在COS 细胞中过表达hHSL-S 发现该细胞缺乏脂肪水解酶活性,说明HSL 的剪接异常会影响细胞脂肪水解酶活性从而抑制脂肪分解。肉碱脂酰转移酶1(Carnitine Palmitoyl Transferase I,CPT1)是肝脏组织细胞中长链脂肪酸β-氧化的关键调节酶和限速酶,该基因具有CPT1A、CPT1B、CPT1C 等多种转录本[66]。在乳腺癌细胞中,CPT1A 的表达加速了脂肪酸β氧化为细胞提供能量,促进乳腺癌细胞增殖[67]。PD-1 可以通过抑制糖酵解并促进脂肪分解和脂肪酸氧化来诱导T 细胞代谢,其对脂肪酸氧化的调节是通过增加CPT1A 的表达来实现的[68]。在果蝇体细胞中存在的CPT1某种转录本导致该细胞脂酶活性降低,这对于脂质分解具有减缓作用[69],这些研究表明了可变剪接在脂肪分解中的重要调控作用。
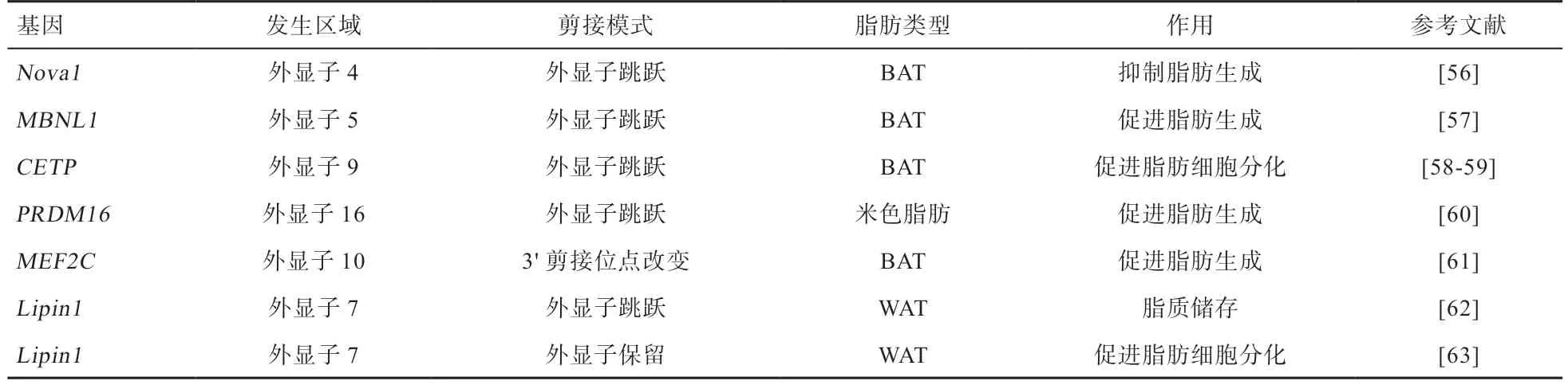
表1 脂肪合成相关可变剪接事件
3 总结与展望
近年来,已经有大量证据证明表观遗传学修饰与Pre-mRNA 的剪接之间存在互作,并且对于表观遗传学与Pre-mRNA 之间的动态关系正在取得重大进展,这为全面了解复杂的基因表达调控网络提供了新的见解。脂肪的代谢不仅与人类健康息息相关,而且对于畜禽的经济性状具有重要意义,深入了解脂肪的代谢调控机制对于生命科学研究的推进也具有一定意义。本文主要总结了可变剪接在脂肪代谢调控中的功能相关研究进展,然而目前的研究大都停留在研究脂肪代谢调控相关的基因,对于更深入地了解相关调控因子与剪接缺乏进一步研究。
随着组学时代的不断发展,转录组测序技术已经发展成熟并且成为了生命科学领域研究的重要工具。RNA-seq 能够以效益高、时间短的方式产生更多的基因组序列,结合相关的生信分析手段可以实现在全基因组水平分析各种细胞不同生理条件下的可变剪接事件,为进一步探索脂肪代谢相关剪接及其调控因子提供了便利,将有助于人类肥胖相关疾病的治疗以及经济动物的肉质性状改良。

