坎格列净纳米晶体冻干粉的制备及其药动学和药效学评价
刘 佳,吉 莉,陈 洁,黄雅菲(南京市溧水区人民医院药剂科,南京 211200)
坎格列净(CFZ)属于钠-葡萄糖共转运蛋白-Ⅱ(SGLT Ⅱ)抑制剂[1-2],用于治疗2型糖尿病,其作用机制是通过抑制肾脏的近曲小管SGLT-Ⅱ的活性从而抑制葡萄糖重吸收,达到降血糖的目的[3-4]。CFZ属于生物药剂学分类系统(BCS)Ⅳ类药物,水溶性和渗透性均较差,具有肝脏首过效应,且是P糖蛋白(P-gp)的底物,这些因素导致了CFZ口服生物利用度较低[5-6]。纳米晶体(NCs)是由药物和稳定剂构成的纳米或亚微米级胶体水分散体,在增加难溶药物的溶解度和口服生物利用度方面受到广泛关注[7-8]。本研究以维生素E聚乙二醇1000琥珀酸酯(TPGS)和十二烷基硫酸钠(SDS)作为稳定剂,采用高压均质法将CFZ制备成纳米晶体(CFZ-NCs)[9-10],冷冻干燥成固体粉末,并通过大鼠体内药动学评估药物生物利用度和控制血糖的效果,为CFZ的口服新剂型研究提供依据。
1 仪器与材料
1.1仪器 DRS2000型高速高剪切乳化分散机(德国IKA公司);APV-2000型超高压均质机(德国APV公司);Malvern Zetasizer Nano ZSE 纳米粒度电位仪(英国马尔文公司);Regulus8100冷场发射扫描电镜(日本日立公司);RC-8MD智能溶出试验仪(天津市精拓仪器科技有限公司);LGJ-20F冷冻干燥机(北京松源华兴科技发展有限公司)。
1.2试药 坎格列净原料药(CFZ,连云港润众制药有限公司,批号110601,质量分数≥99.8 %);聚乙二醇1000维生素E琥珀酸酯(TPGS,北京中生瑞泰科技有限公司);十二烷基硫酸钠(SDS,西格玛奥德里奇上海贸易有限公司);甘露醇(法国罗盖特公司);水为纯化水。
1.3实验动物 Wistar大鼠,SPF级,雌雄各半,体质量为(220±20) g,由江苏卫生健康职业学院提供,动物许可证号:SYXK(苏)2020-0001。
2 方法与结果
2.1CFZ-NCs及其冻干粉的制备 以TPGS和SDS联合使用作为稳定剂[11-12],采用高压均质法制备CFZ-NCs,并通过冷冻干燥工艺将其固化成固体粉末[13]。制备工艺:使用高速粉碎机将CFZ原料药初步粉碎,原料药粒径分布D90(累积分布为90%的粒径)约为20 μm;取上述CFZ原料药5 g加入到介质溶液100 mL中(含有TPGS的质量浓度为5 mg·mL-1,SDS质量浓度为1 mg·mL-1),搅拌分散均匀,通过高速剪切分散乳化机(剪切速度为10 000 r·min-1)剪切分散10 min,得到CFZ初级混悬液;再将该混悬液通过高压均质机均质处理(均质压力为800 bar,均质5次),即得到CFZ-NCs,备用;向CFZ-NCs中加入甘露醇(质量浓度为5 mg·mL-1),分装到西林瓶中进行冷冻干燥,冻干后加塞密封保存,即得到CFZ-NCs冻干粉。
2.2CFZ-NCs及其冻干粉的质量评价
2.2.1粒径、Zeta电位测定 取新制备的CFZ-NCs以及本批样品的冻干粉末,分别加入纯化水复溶、稀释,使其分散均匀,分别取上述样品置于聚苯乙烯样品池中,通过Malvern Zetasizer Nano ZSE 纳米粒度电位仪测定粒径分布和Zeta电位(光源:HE-NE激光器,波长:632.8 nm,90°散射角,温度:25 ℃),结果见表1。
由表1可知,CFZ-NCs在冻干前的粒径为(281.7±15.5) nm,多聚分散指数(PDI)为(0.258±0.009),粒度分布较窄,可减轻药物纳米晶体的奥斯瓦尔德熟化现象[14],有利于CFZ-NCs的稳定性;CFZ-NCs在冻干前的Zeta电位为(-36.1±1.0)mV,其绝对值大于30 mV,静电排斥力足够大,可有效防止纳米晶体之间相互聚集[15];CFZ-NCs在冻干后,其粒径分布和Zeta电位均未发生明显变化,说明CFZ-NCs经冷冻干燥后未发生聚集。
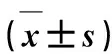
表1 CFZ-NCs冻干前后的理化性质Tab.1 The physical and chemical properties of CFZ-NCs before and after lyophilization
2.2.2微观结构 由图1可知,CFZ-NCs加入纯化水稀释,取1滴样品均匀铺展到锡箔纸表面,在红外灯下进行干燥,采用导电胶带将样品黏附在样品台上,离子溅射喷镀金,样品置于扫描电镜下观察微观结构(电压为10 kV,放大倍数为20 000倍),并拍摄照片。见图1。

图1 CFZ-NCs扫描电镜图Fig.1 Scanning electron micrograph of CFZ-NCs
由图1可知,CFZ-NCs呈不规则颗粒状,表面致密,粒径大部分在100~400 nm之间分布。
2.2.3体外溶出行为研究 评价CFZ混悬剂(以2 g·L-1羧甲基纤维素钠溶液作为分散介质)和CFZ-NCs冻干粉的体外药物溶出行为,选择桨法,转速为50 r·min-1,介质为pH值为1.2的盐酸溶液(含SDS 质量浓度为5 mg·mL-1),体积为900 mL,温度为(37±0.5) ℃。分别取CFZ混悬剂和CFZ-NCs冻干粉(药物含量均为50 mg)加入到溶出杯中,分别在10、20、30、45、60、90、120 min取出溶出介质5 mL(补加同温同体积空白介质),用0.22 μm滤膜过滤,稀释后检测药物含量,计算药物溶出度,绘制溶出度-时间曲线。结果见图2。
图2 CFZ混悬剂和CFZ-NCs冻干粉体外溶出度-时间曲线Fig.2 The in vitro dissolution-time curves of CFZ suspensions and CFZ-NCs lyophilized powder (n=6,
由图2可知,CFZ混悬剂中药物溶出速率缓慢,在120 min药物溶出度仅达到20%左右,而将CFZ制备成纳米晶体后,药物溶出速度显著提高,在45 min内药物溶出度基本可达到95%,说明CFZ制备成纳米晶体可显著提高药物的溶出度。
2.3稳定性考察 将CFZ-NCs冻干粉密封在西林瓶中,置于加速稳定性实验箱(40 ℃,相对湿度为75%)中考察稳定性,分别在1、2、3、6个月取样测定CFZ-NCs的理化性质以及在45 min的药物溶出度,结果见表2。结果显示,CFZ-NCs冻干粉在40 ℃条件下放置6个月,其粒径分布、PDI和Zeta电位值基本未发生变化,45 min的药物溶出度也均达到90%以上,说明CFZ-NCs制备成冻干粉后理化性质稳定,可长期保存。
表2 稳定性实验结果Tab.2 The results of stability
2.4体内药动学研究
2.4.1色谱条件 色谱柱:Eclipse XDB-C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-0.02 mmol·L-1正磷酸溶液(55∶45);检测波长:210 nm;柱温:30 ℃;流速:1.0 mL·min-1;进样量:20 μL。
2.4.2血浆处理 采用毛细管通过大鼠眼眶后神经丛取血0.5 mL,置于圆底离心管(内壁涂有肝素)中,以4 000 r·min-1离心10 min,取上层血浆100 μL,置于尖底离心管中,再加入乙腈300 μL,涡旋混合5 min,沉淀蛋白,以4 000 r·min-1离心10 min,取上清液300 μL,置于尖底离心管中,氮气流下挥干有机溶剂,加入流动相100 μL溶解残留物,以10 000 r·min-1离心10 min,取上清液,按照2.4.1项下色谱条件检测药物含量,计算药物质量浓度。
2.4.3动物实验 取Wistar大鼠12只,体质量为(220±20) g,雌雄各半,实验前禁食12 h,自由饮水。将大鼠按照随机数字表法分为A、B 2组,A组大鼠口服给予CFZ混悬剂(以2 mg·mL-1羧甲基纤维素钠溶液作为分散介质),B组大鼠灌胃给予CFZ-NCs冻干粉,给药剂量均为20 mg·kg-1,在预定的时间点(0、0.5、1、2、4、6、8、12、24 h)采用毛细管通过大鼠眼眶后神经丛取血0.5 mL,置于圆底离心管(内壁涂有肝素)中,离心,分离血浆,按照2.4.2项下方法处理血浆样品并进样分析,数据输入DAS软件中计算药物代谢动力学参数,结果见表3,并绘制血药质量浓度-时间曲线,见图3。
表3 大鼠药物代谢动力学参数Tab.3 The pharmacokinetic parameters of rats
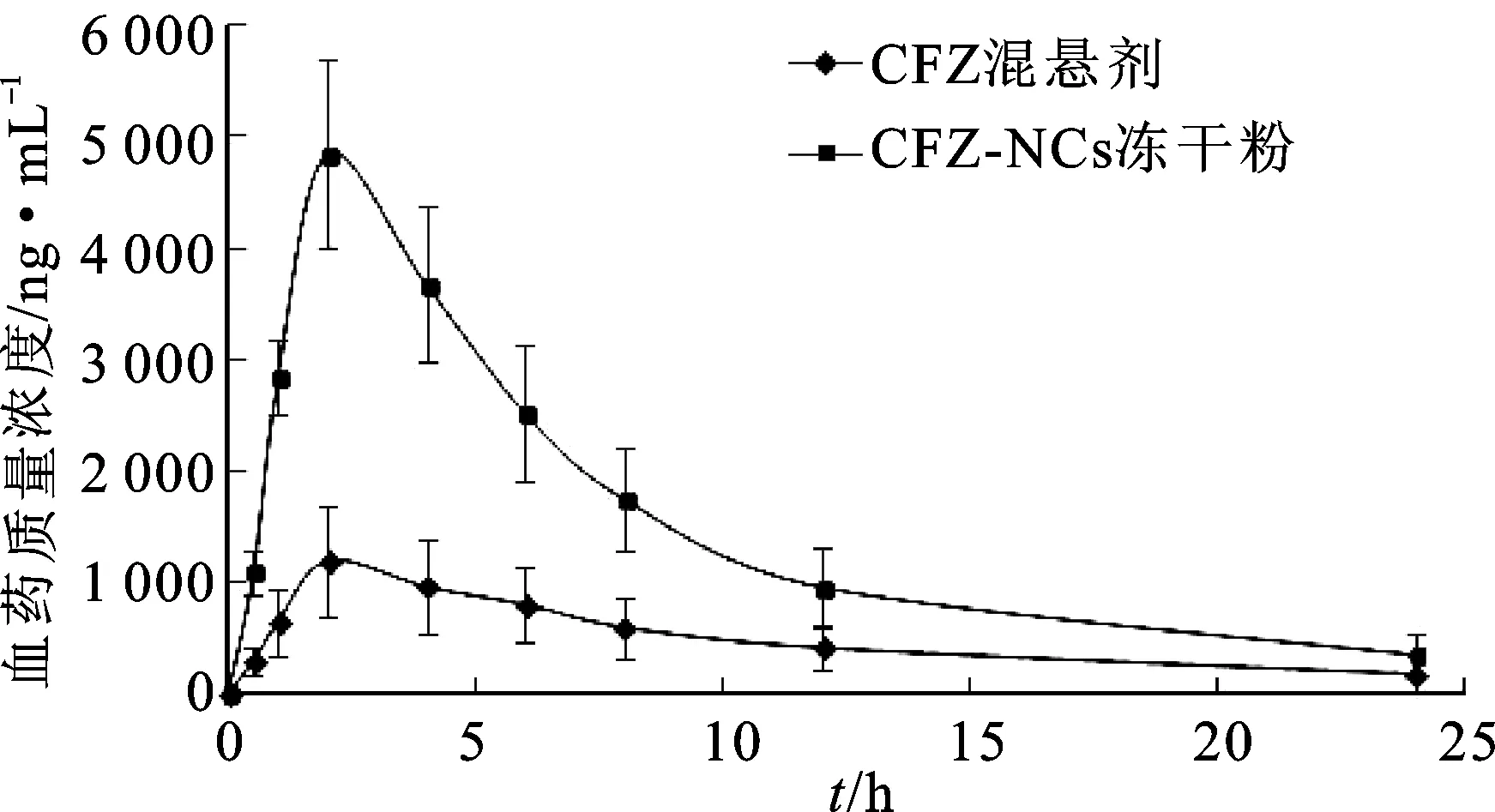
图3 平均血药质量浓度-时间曲线Fig.3 The mean plasma concentration-time curves of CFZ suspensions and CFZ-NCs lyophilized powder
药物代谢动力学结果显示,大鼠口服CFZ-NCs冻干粉后与口服CFZ混悬剂相比,其Cmax和AUC(0-∞)均显著增加,相对生物利用度提高了312.4%。说明CFZ-NCs冻干粉能有效提高CFZ的口服生物利用度。
2.5药效学评价 取Wistar大鼠,体质量为(220±20) g,雌雄各半,禁食不禁水24 h,大鼠腹膜内注射四氧嘧啶溶液(给药剂量为150 mg·kg-1),诱发糖尿病,定时定量给予稻米,1周后,选择空腹血糖大于16.7 mmol·L-1的大鼠纳入糖尿病模型[16]。将糖尿病模型大鼠随机分成3组,每组6只,第1组大鼠作为空白对照组,给予饮用水,第2组大鼠给予CFZ混悬剂(以2 mg·mL-1羧甲基纤维素钠溶液作为分散介质),第3组大鼠给予CFZ-NCs冻干粉,给药剂量均为20 mg·kg-1,并通过眼眶后神经丛定时取血0.1 mL,葡萄糖检测试剂盒测定血糖,比较CFZ混悬剂和CFZ-NCs冻干粉的降血糖效果。结果见图4。
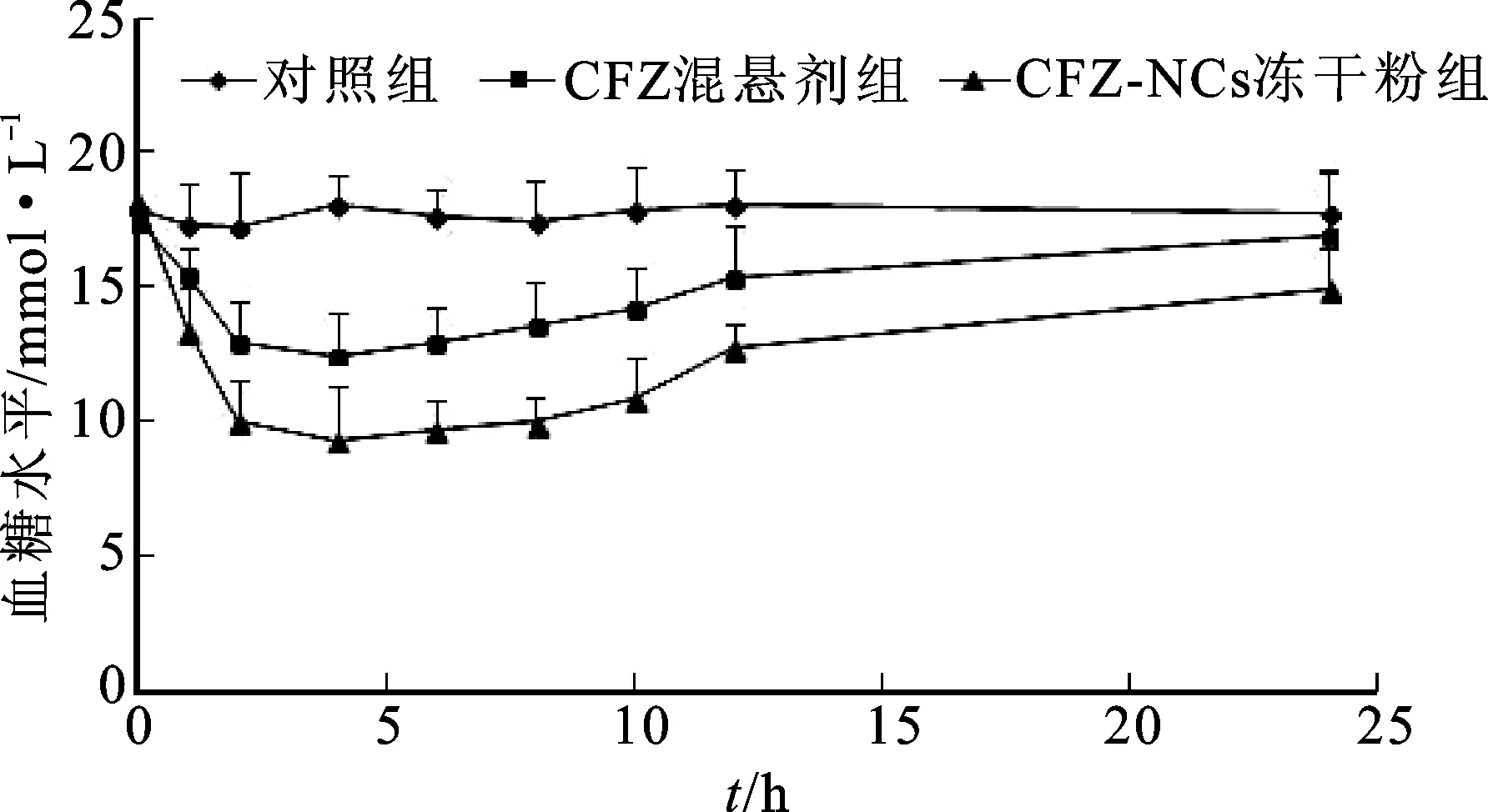
图4 CFZ混悬剂和CFZ-NCs冻干粉的大鼠体内血糖水平比较Fig.4 Comparison of blood glucose levels between CFZ suspensions and CFZ-NCs lyophilized powder in rats
由图4可知,糖尿病模型大鼠分别口服CFZ混悬液和CFZ-NCs冻干粉后,其血糖水平均出现降低趋势,口服CFZ-NCs冻干粉的大鼠在各时间点的血糖水平明显低于口服CFZ混悬剂的大鼠,进一步说明CFZ-NCs冻干粉促进了药物溶解和吸收,可持续并显著降低血糖水平。
3 讨论
由于纳米晶体的粒径非常小,比表面积巨大,将药物制备成纳米晶体后相应的表面自由能显著增大,纳米晶体在放置期间易聚集或粒径增大,在处方中加入合适的稳定剂可降低表面张力,避免药物晶体在制备过程和放置过程中聚集[17]。可以采用羟丙甲纤维素(HPMC)、羟丙基纤维素(HPC)、聚乙烯吡咯烷酮(PVP K30)等高分子聚合物和/或聚山梨酯(Tween 80)、TPGS、SDS等非离子型和离子型表面活性剂作为稳定剂[18-19]。聚合物和非离子表面活性剂吸附在纳米晶体表面,其亲水链向外延伸,阻碍药物晶体之间聚集,通过空间位阻作用达到稳定目的,而离子型表面活性剂吸附在药物晶体表面形成双电层,药物晶体相互靠近,距离减小到某个阈值时,具有相同电荷药物晶体由于静电作用相互排斥,阻碍药物晶体之间聚集。
TPGS作为一种安全无毒、生物相容性好的药物辅料,能抑制细胞膜内的P-gp活性,降低其对底物的外排作用,提高药物渗透率,进而提高药物的口服生物利用度[20-21],作为一种安全的药用辅料已被美国食品药品监督管理局(FDA)批准用于药品中。本研究将CFZ制备成纳米晶体后显著提高了药物口服生物利用度,一方面是由于药物的溶出速度增加,另一方面是由于处方中加入了TPGS,抑制了P-gp活性,降低了P-gp对CFZ的外排作用。

