性别决定区Y框蛋白9诱导人口腔鳞状细胞癌CAL27微管形成和上皮间质转化的机制初探
黄盛 张七援 何爱娥 李洪波 张智星
1.武汉理工大学马房山校区东院医院口腔科,武汉430000;2.武汉大学口腔医院牙体牙髓二科,武汉430000;3.武汉市第五医院口腔科,武汉430000;4.武汉大学口腔医院修复科,武汉430000;5.同济医科大学附属医院口腔科,武汉430000
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是全球范围内最广泛发生的癌症之一,约占头颈部肿瘤的38%和所有口腔恶性肿瘤的90%以上[1]。早期患者的5 年生存率为55%~60%,而晚期患者的5 年生存率降至30%~40%[2]。随着诊疗技术的不断提高,OSCC的存活率有所提高,但在癌症治疗中仍存在非特异性、非选择性和毒性的巨大挑战。在接受手术、放疗和/或化疗后,大多数患者会遭受局部缺陷、畸形、功能障碍、耐药性以及其他无法忍受的毒性和不良反应。OSCC复发率高,并且易于转移,导致患者生活质量下降[3]。因此,OSCC 需要更好的治疗,靶向治疗可能会作为治疗的辅助手段提供最佳选择[4]。性别决定区Y 框蛋白9 (sex determining region Ybox 9,SOX9)是一个SOX 家族转录因子的成员,在各种组织的发育和分化中起关键作用[5]。最近,SOX9 被证明参与了各种类型癌症的发生或发展,包括前列腺癌[6]、乳腺癌[7]和肾细胞癌[8]、皮肤基底细胞癌[9]和食管癌[10]。然而,SOX9的表达对OSCC的作用机制仍不清楚。因此,本研究探索SOX9对人OSCC 细胞CAL27 微管形成和上皮间质转化的影响及其作用机制,以期为OSCC的靶向治疗提供实验依据。
1 材料和方法
1.1 试剂和仪器
DMEM 培养液、胎牛血清、胰酶(Invitrogen公司,美国);二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(PIERCE 公司,美国);MatrigelTM底膜基质(BD 公司,美国);波形蛋白(Vimentin)、钙黏蛋白(E-cadherin)、神经钙黏素(N-cadherin)、纤连蛋白(Fibronectin)、Wnt、β-连环蛋白(β-catenin)和T 细胞4(T-cell factor-4,TCF-4)抗体、HRP标记的山羊抗兔二抗(NEB公司,美国);高速低温离心机(Beckman 公司,美国);CO2培养箱(Thermo 公司,美国);电泳槽、电转仪(Bio-Rad 公司,美国);倒置相差显微镜(TS100)(Nicon 公司,日本);凝胶成像系统GDS-800 UVP (UVP 公司,美国);ChemiDoc XRS凝胶/发光图像分析仪(Bio-Rad公司,美国);Olympus DP71 免疫荧光显微镜(Olympus 公司,日本)。SOX9-shRNA1 和SOX9-shRNA2 由上海吉玛制药技术有限公司合成;实验所用引物由上海生工生物工程有限公司合成。
1.2 细胞培养
CAL27 细胞株由中国科学院上海细胞生物学研究所上海细胞库提供,在有10%胎牛血清的DMEM 培养基中生长。当所有细胞融合至80%~90%后,用0.25%胰蛋白酶分离传代,然后在37 ℃、5%CO2培养箱中培养。选取对数生长期的细胞进行进一步实验。
1.3 方法
1.3.1 细胞转染 将CAL27 细胞传代培养于6 孔板中并分为4 组:对照组、Scramble(shRNA-NC)组、SOX9-shRNA1 组、SOX9-shRNA2 组。培养24 h 后根据转染试剂盒说明书用Lipofectamine 3000(Invitrogen 公司,Carlsbad,CA)根据组名分别转染SOX9-shRNA1和SOX9-shRNA2,48 h后进行相应检测。
1.3.2 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR) 使 用TRIzol 试剂提取总RNA,并通过超微量紫外分光光度计在260和280 nm处测定光密度(optical density,OD)值。按照试剂盒说明书,使用Super RT cDNA 试剂盒合成cDNA。此外,使用Quantifast®SYBR®GreenPCR Kit 进 行 聚 合 酶 链 反 应(polymerase chain reaction,PCR),分别在95 ℃15 s 和60 ℃60 s 条件下使用ABI 7500 将反应激活,结果采用2-ΔΔCt法进行计算。用于该反应的SOX9 和磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)的引物序列如下。SOX9 上游引物序列:5’-CAAGAAGGACCACCCGGATT-3’,下游引物序列:5’-AAGATGGCGTTGGGGGAGAT-3’;GAPDH 上游引物序列:5’-GACTCATGACCACAGTCCATGC-3’,下游引物序列:5’-AGAGGCAGGGATGATGTTCTG-3’。
1.3.3 微管形成实验 测定体外微管形成以确定中性粒细胞的促血管生成能力。在37 ℃下,每孔在48 孔培 养板 上预 涂5 mg·mL-1基 质 胶(Matrigel)30 min,以使其硬化。将融合的细胞以密度为每毫升1.5×105个在37 ℃的条件下悬浮于培养基中培养24 h。然后使用Olympus DP71 免疫荧光显微镜对毛细管状结构进行拍照并进行测量。
1.3.4 细胞形态学观察 在倒置相差显微镜下观察处于对数生长期的CAL27 细胞,并且记录细胞形态。
1.3.5 免疫印迹法 使用裂解缓冲液裂解细胞样品。然后,使用BCA 蛋白质测定试剂盒定量蛋白质浓度。含有20 mg蛋白质的样品在10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE)中分离,然后转移到聚偏二氟乙烯膜上。在室温下将膜在封闭缓冲液(5%脱脂奶粉和PBS 中的1%Tween-20)中封闭2 h,然后与适当的一抗(Ecadherin,1∶1 000;N-cadherin,1∶1 000;Fibronectin,1∶1 000)在封闭缓冲液中于4 ℃孵育过夜。随后,将膜用含Tween-20 的TBS 洗涤以除去上述残留的一抗,并与辣根过氧化物酶缀合的山羊抗兔IgG二级抗体一起孵育,最后进行化学发光反应,显影,定影,根据二抗结合情况调节曝光参数,Image J 扫描目的条带的灰度值,以内参为基数,其他条带灰度值与内参灰度值之比为相对蛋白表达水平。
1.3.6 免疫荧光检测Vimentin的含量 将CAL27细胞接种到涂有纤连蛋白的玻璃盖玻片上。在培养24 h 后,PBS 冲洗细胞,固定于预冷甲醇中,0.2% Triton X-100 渗透。固定细胞在1.5%的正常山羊血清中预孵育,4 ℃下用一抗Vimentin(1∶100 稀释)孵育过夜。异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记山羊抗兔IgG 抗体37 ℃孵育2 h 后,DAPI 染核5 min,将盖玻片用PermaFluor Aqueous 固定在载玻片上。使用Olympus DP71 显微镜观察荧光,计数可观察到荧光信号的阳性细胞。
1.3.7 荧光素酶报告实验检测Wnt 通路激活细胞按照前面的分组方法分组培养24 h 后,根据转染试剂盒说明书用Lipofectamine 3000 根据组名分别转染SOX9-shRNA1和SOX9-shRNA2,同时共转染TCF Reporter Plasmid(TOPFLASH),转染48 h后按照双荧光素酶报告基因检测试剂盒提供的方法检测报告质粒荧光素酶活性。
1.4 统计学方法
采用SPSS 20.0 软件对所有实验数据进行统计分析,组间差异采用单因素方差分析进行检验。实验结果以均数±标准差表示。以P<0.05认为差异有统计学意义。
2 结果
2.1 干扰SOX9抑制SOX9的表达
与对照组比较,SOX9-shRNA1组和SOX9-sh-RNA2组SOX9 mRNA和蛋白的表达显著降低(F=578.000,P=0.000;F=96.850,P=0.000)(图1)。
2.2 干扰SOX9抑制微管形成
微管形成实验结果表明,对照组清晰可见大量紧密排列的微管结构,而SOX9-shRNA1 组和SOX9-shRNA2 组细胞微管样结构的形成数量明显减少,且微管的环状结构不完整或不典型(图2)。与对照组(55.91±6.23)相比较,SOX9-shRNA1组(21.78±4.19)和SOX9-shRNA2组(15.46±3.41)微管结节数目显著减少(F=91.200,P=0.000)。
2.3 干扰SOX9对上皮间质形态的影响
各组细胞形态变化见图3。由图3 可见,对照组多为梭形的间质样细胞,少量椭圆形或圆形的上皮样细胞。与对照组相比,SOX9-shRNA1 组和SOX9-shRNA2 组CAL27 间质样细胞减少,上皮样细胞增多(图3)。

图1 OSCC细胞中SOX9的表达水平Fig 1 The expression levels of SOX9 in OSCC
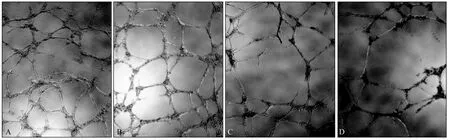
图2 微管结节数目的变化 免疫荧光显微镜 ×100Fig 2 Changes in the number of microtubule nodules immunofluorescence microscope ×100
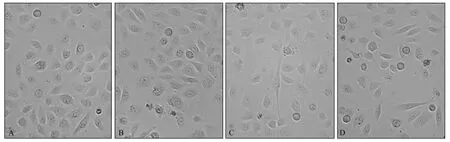
图3 细胞形态的观察结果 倒置相差显微镜 ×400Fig 3 Observation of cell morphology changes inverted phase contrast microscope ×400
2.4 干扰SOX9抑制上皮间质转化
由Western blot 条带可见,SOX9-shRNA1 组和SOX9-shRNA2 组E-cadherin 蛋白表达量较对照组升高,N-cadherin 和Fibronectin 蛋白表达量较对照组降低(图4)。Western blot 灰度分析结果见表1。与对照组比较,SOX9-shRNA1 组和SOX9-shRNA2 组E-cadherin 蛋白表达水平显著升高(F=181.400,P=0.000);N-cadherin 和Fibronectin 蛋白表达水平显著降低(N-cadherin:F=101.400,P=0.000;Fibronectin:F=122.300,P=0.000)。
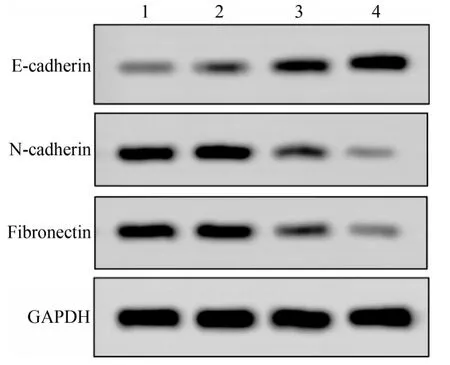
图4 E-cadherin、N-cadherin、Fibronectin蛋白表达量Fig 4 The protein expression levels of E-cadherin,N-cadherin,Fibronectin
2.5 干扰SOX9降低OSCC中Vimentin的含量
免疫荧光染色结果发现对照组细胞的Vimentin荧光标记主要浓集于核区,胞质区减少;SOX9-shRNA1 组 和SOX9-shRNA2 组 细 胞 的Vimentin 荧光标记主要浓集于胞质区,核区减少,没有明显显现(图5)。与对照组(29.63±3.75)比较,SOX9-shRNA1组(3.09±1.18)和SOX9-shRNA2组(1.82±1.03)Vimentin 阳性细胞数显著减少(F=169.700,P=0.000)。
2.6 干扰SOX9 抑制Wnt、β-catenin、TCF-4 的蛋白表达
Wnt、β-catenin、TCF-4 的蛋白表达结果见表2 和图6。由Western blot 条带可见,SOX9-shRNA1 组和SOX9-shRNA2 组Wnt、β-catenin、TCF-4蛋白表达量较对照组降低。此外,从荧光素酶报告实验结果可见,SOX9-shRNA1 组和SOX9-shRNA2 组TCF 报告质粒荧光素酶活性较对照组降低(F=94.830,P=0.000)。免疫印迹灰度分析结果可见,与对照组比较,SOX9-shRNA1 组和SOX9-shRNA2 组Wnt、β-catenin、TCF-4 蛋白表达水平显著降低(Wnt:F=70.290,P=0.000;β-catenin:F=81.740,P=0.000;TCF-4:F=37.020,P=0.000)。

表1 半定量分析E-cadherin、N-cadherin、Fibronectin蛋白表达水平变化Tab 1 Semi-quantitative analysis of E-cadherin,N-cadherin,Fibronectin protein expression levels changes %

图5 免疫荧光检测Vimentin的阳性表达量 免疫荧光染色 ×400Fig 5 Immunofluorescence detect the positive expression of Vimentin immunofluorescence staining ×400

表2 半定量分析Wnt、β-catenin和TCF-4蛋白表达水平变化Tab 2 Semi-quantitative analysis of Wnt,β-catenin and TCF-4 protein expression levels changes
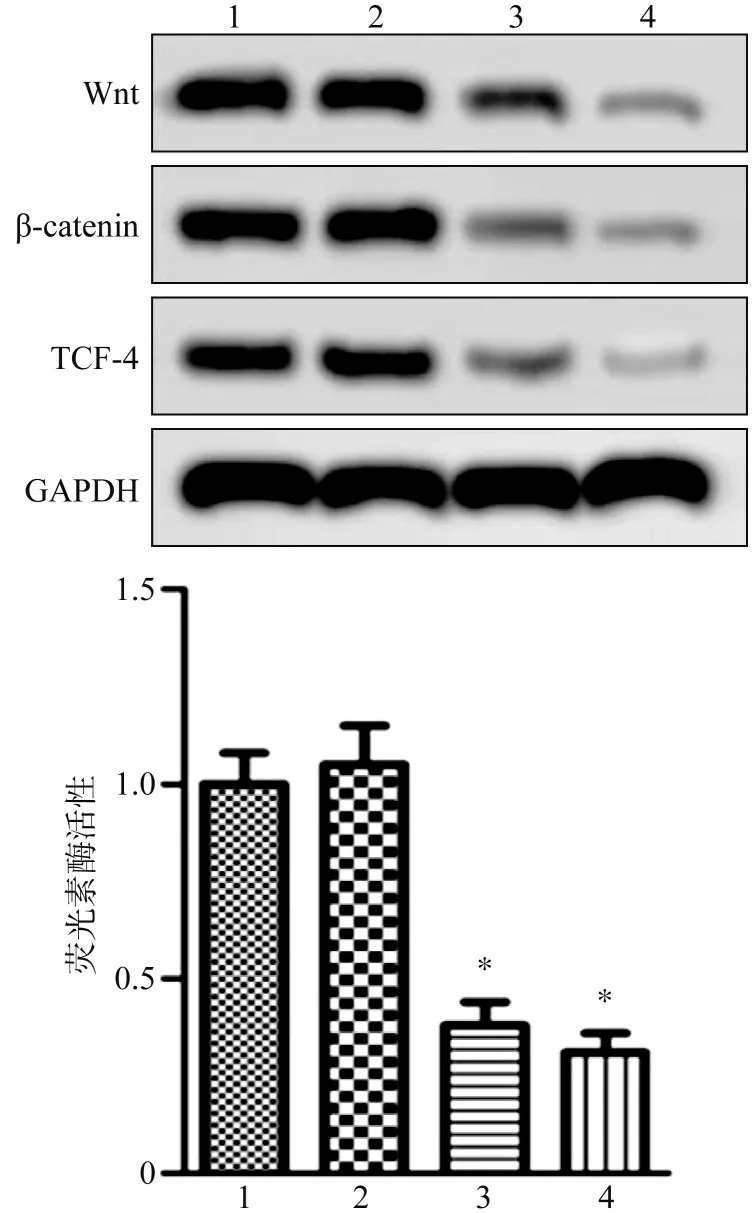
图6 Wnt、β-catenin和TCF-4蛋白表达量Fig 6 The protein expression levels of Wnt,β-catenin and TCF-4
3 讨论
OSCC起源于口腔上皮,是头颈部最常见的恶性肿瘤。尽管OSCC的治疗取得了很大进展,但它仍然是一种具有高复发风险和预后不良的致死性疾病[11]。外科手术技术、放射疗法和多药化疗是目前OSCC最常见的治疗方法。然而,耐药的存在和发展在很大程度上限制了化疗药物的临床应用[12]。SOX9 被证明参与各种类型癌症的发生和发展,癌细胞中SOX9 高表达与不良的临床结果呈正相关[13]。而目前有研究[14]发现SOX9 可能在OSCC 的癌变发展过程中发挥重要作用。因此,本研究进一步探索SOX9对人OSCC细胞CAL27微管形成和上皮间质转化的影响及其作用机制,寻找对OSCC新的靶向治疗策略。
SOX9 的异常表达已在一些人类癌症中被观察到。SOX9 在癌症进展中发挥关键作用,它调节一系列的基因转录,促进细胞增殖、迁移、侵袭和血管生成[15]。研究[16]发现SOX9 可以抑制NBAT1的表达,NBAT1 过表达能引起毛细血管形成明显减少,而SOX9 可通过抑制NBAT1 促进毛细血管形成。与其他研究结果相似,本研究发现干扰SOX9 细胞微管样结构的形成数量明显减少,表明SOX9可诱导OSCC细胞CAL27微管形成。
上皮-间充质转化发生在上皮肿瘤的进展过程中,以增加癌细胞的迁移性和侵袭性。上皮-间充质转化的一个特殊特征是上皮标记物E-cadherin 的下调和间质标记物如Vimentin、Fibronectin 和Ncadherin 的增加[17]。研究发现敲除SOX9 可明显抑制甲状腺癌细胞的侵袭和迁移以及Vimentin 和Ncadherin 的表达,并上调E-cadherin 的表达[18]。同样,Huang 等[19]研究发现在SOX9 基因敲除的细胞中,上皮细胞标志物E-cadherin 和γ-catenin 的表达在蛋白水平上调而间质细胞标志物Vimentin 和Ncadherin 的表达下调[19]。与其他研究结果相似,本研究发现干扰SOX9 后E-cadherin 蛋白表达水平升高,N-cadherin 和Fibronectin 蛋白表达水平降低,OSCC 细胞中Vimentin阳性细胞数减少,表明干扰SOX9能抑制OSCC上皮间质转化过程。
在经典的Wnt/β-catenin信号传导中,Wnt配体与其同源膜受体的结合导致β-catenin 降解复合物失活,从而导致细胞质β-catenin 的稳定。一旦积累,β-catenin 就会定位于细胞核,并与DNA 结合蛋白的Lef-1/TCF 家族相互作用,从而生成功能性转录因子复合物[20]。β-catenin与细胞核中TCF/LEF家族的转录因子结合,从而调节靶基因的表达[21]。据报道,异常的Wnt/β-catenin 信号转导与多种人类癌症之间存在关联[22]。已经显示出Wnt/β-catenin信号传导会影响OSCC 细胞的增殖、分化以及上皮-间质转化[23]。与其他研究结果一致,本研究发现干扰SOX9 明显抑制Wnt、β-catenin、TCF-4 的蛋白表达,同时荧光素酶报告实验结果显示,干扰SOX9可降低TCF报告质粒荧光素酶活性,表明Wnt/β-catenin通路的激活明显受到抑制,上述结果说明SOX9 影响OSCC 的发展与Wnt/β-catenin 信号通路激活抑制存在一定的联系。
综上所述,本研究通过干扰SOX9 降低了Vimentin 的含量,抑制微管形成,上皮间质转化标记分子的蛋白表达,并抑制了Wnt/β-catenin 通路的激活,表明SOX9可诱导人OSCC细胞CAL27微管形成和上皮间质转化,这一作用与Wnt/β-catenin通路激活抑制存在一定的联系,有待后续研究进一步探索,为临床上OSCC 的靶向治疗提供实验依据。
利益冲突声明:作者声明本文无利益冲突。
——水芹主要害虫识别与为害症状

