吉西他滨联合不同药物治疗晚期膀胱癌的临床效果比较
文小程
泌尿系统最常见的恶性肿瘤为膀胱癌,其发病率具有区域性和民族性,发病率在美国和西欧较高,而在日本则较低,美国白人比黑人高,男女比率为3∶1,约50%的血尿患者是膀胱癌造成的[1]。现在认为,膀胱癌的致病因素与人体内病毒或某些化学性致癌物激活了癌基因有关,其治疗效果与肿瘤类型有密切关系,肿瘤移行细胞癌的治疗效果更佳。原发膀胱癌是一种高度恶性的细胞,在浸润前具有良好的治疗效果,但一旦浸润后,患者生存率明显降低。膀胱鳞状细胞癌和腺癌属于同高度恶性肿瘤,对于放疗不敏感,且效果不佳[2-3]。本研究选取医院收治的晚期膀胱癌患者50例分组治疗,对照组给予吉西他滨联合奥沙利铂治疗,观察组给予吉西他滨联合紫杉醇治疗,比较2组治疗前后血清相关因子、近期总有效率、不良反应发生率及中位生存时间,观察比较吉西他滨联合不同药物治疗晚期膀胱癌的临床效果,报道如下。
1 资料与方法
1.1 一般资料 选取2018年1-12月红安县人民医院收治的晚期膀胱癌患者50例,根据随机数字表法分为观察组和对照组,每组25例。观察组年龄45~79(65.24±2.13)岁;体质量41~85(62.01±11.11)kg;TNM分期:Ⅲ期14例,Ⅳ期11例;病理分型:移行上皮癌的患者有23例,鳞癌有1例,未分化癌1例;白细胞计数(5.98±1.33)×109/L,血红蛋白(108.98±12.56)g/L,血小板计数(107.92±17.31)×109/L。对照组年龄44~78(65.45±2.41)岁;体质量41~82(62.01±11.34)kg;TNM分期:Ⅲ期15例,Ⅳ期10例;病理分型:移行上皮癌的患者有22例,鳞癌有2例,未分化癌1例;白细胞计数(5.97±1.31)×109/L,血红蛋白(108.91±12.51)g/L,血小板计数(107.94±17.21)×109/L。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,患者及家属均知晓研究内容并签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1)晚期膀胱癌患者;(2)之前未接受其他治疗,无其他肿瘤病史;(3)卡氏评分≥70分,预计生存时间>3个月;(4)有可观测的客观病灶。排除标准:(1)严重心、肾功能衰竭患者;(2)凝血功能障碍患者;(3)存在严重心脑血管并发症、化疗方案和放疗治疗禁忌者。
1.3 治疗方法 对照组给予吉西他滨联合奥沙利铂治疗,观察组给予吉西他滨联合紫杉醇治疗。化疗前24 h检查肝肾功能、血常规及心电图等,检查结果正常后方给予化疗。第1、8天,给予注射用盐酸吉西他滨[齐鲁制药(海南)有限公司生产,国药准字H20113286]800 mg/m2静脉注射,第2天奥沙利铂(江苏奥赛康药业股份有限公司生产,国药准字H20051985)120 mg/m2静脉注射,每3周化疗1次。化疗期间中性粒细胞≤1.5×109/L或血小板计数≤100×109/L患者,吉西他滨的用量降至600 mg/m2,出现骨髓Ⅳ度抑制者应将用药量降低30%以上,患者白细胞计数≤3.0×109/L或中性粒细胞≤1×109/L时,可在皮下注射重组人粒细胞集落刺激因子注射液(深圳新鹏生物工程有限公司生产,国药准字S19990075),随后观察患者白细胞计数及中性粒细胞恢复情况,当恢复正常后方可开始下一周期化疗。每3周化疗1次,每次为1个疗程,治疗5个疗程。观察组给予吉西他滨联合紫杉醇化疗,化疗前12 h口服地塞米松片(广东华南药业集团有限公司生产,国药准字H44024469)或盐酸苯海拉明片(山西太原药业有限公司生产,国药准字H14022436),防止紫杉醇导致的过敏反应,第1、8天静脉注射吉西他滨800 mg/m2,第2天紫杉醇注射液(扬子江药业集团有限公司生产,国药准字H20058719)150 mg/m2静脉注射,出现白细胞、中性粒细胞或骨髓Ⅳ度抑制晚期膀胱癌患者,用药方式及用量同对照组晚期膀胱癌患者。每3周化疗1次,每次为1个疗程,治疗5个疗程。
1.4 观察指标 比较2组患者治疗前后血清相关因子(可溶性细胞间黏附分子-1、E-钙黏素、血清细胞黏附分子、成纤维细胞生长因子、血管内皮生长因子)水平变化,近期总有效率、不良反应发生率及中位生存时间。
1.5 疗效评定标准[4]判断疗效的标准是根据世界卫生组织制定的评价标准:完全缓解:宫颈癌肿块完全消失;部分缓解:膀胱癌病灶缩小≥50%;稳定或无变化:膀胱癌病灶缩小<50%;进展:膀胱癌病灶增加。总有效率=完全缓解率+部分缓解率+稳定率。
2 结 果
2.1 血清相关因子水平比较 治疗前,2组患者可溶性细胞间黏附分子-1、E-钙黏素、血清细胞黏附分子、成纤维细胞生长因子、血管内皮生长因子(a、b、c)水平比较差异无统计学意义(P>0.05);治疗5个疗程后,2组可溶性细胞间黏附分子-1、E-钙黏素、血清细胞黏附分子、成纤维细胞生长因子、血管内皮生长因子(a、b、c)水平均较治疗前改善,且观察组优于对照组,差异有统计学意义(P均<0.01)。见表1。
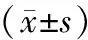
表1 2组患者治疗前后血清相关因子水平比较
2.2 近期总有效率比较 治疗5个疗程,观察组总有效率为88.00%,高于对照组的60.00%,差异有统计学意义(χ2=5.094,P=0.024)。见表2。

表2 2组患者近期治疗效果比较 [例(%)]
2.3 不良反应比较 观察组不良反应总发生率为20.00%,低于对照组的48.00%,差异有统计学意义(χ2=4.367,P=0.037)。见表3。

表3 2组患者不良反应发生情况比较 [例(%)]
2.4 中位生存时间比较 观察组患者中位生存时间为(17.21±3.41)个月,长于对照组的(12.25±2.45)个月,差异有统计学意义(t=5.906,P=0.000)。
3 讨 论
膀胱癌发病率呈上升趋势,吸烟和接触芳香胺类物质可能是诱发膀胱癌的主要危险因素。T2以上浸润性膀胱癌的患者中,40%~50%发生远端转移(小病灶),3年生存率仅40%左右。PT2或以上的患者预后较差。手术联合局部放疗、化疗、免疫治疗可提高生存率。准确的结论取决于前瞻性对照研究,但目前数据很少。近年来,术前化疗作为诱导治疗的辅助手段受到重视[5-6]。吉西他滨为一种新的胞嘧啶苷衍生物和核苷酸还原酶抑制剂,其有明显的细胞周期特异性,作用于S期,能抑制G1期向 S期转化。在静脉注射后,药物会迅速扩散到体内的各个组织。注入时间越长,分配的体积越大,半衰期越长;短程输注后的半衰期为320.94 ml,而最大血药浓度在3.2~45.5 g/ml。吉西他滨只有一小部分可与蛋白质结合,并在肝脏、肾脏、血液等组织中迅速完全代谢。二氟脱氧嘧啶是它进入人体后主要的活性产物,主要作用于 DNA合成期和G1晚期,阻止细胞从 G期进入 S期,通过独特掩蔽链完全抑制 DNA的自修复机制,阻止 RNA的合成,从而导致细胞毒性和凋亡[7-8]。
奥沙利铂属第3代铂制剂,可与 DNA结合,形成一个交联键,从而破坏 DNA的功能,阻止其复制,从而抑制肿瘤细胞分裂,起到双功能性烷化剂的作用,水溶性好、毒性小,抗肿瘤谱宽,疗效显著。奥沙利铂与 DNA在体内的结合速度比顺铂快10倍。奥沙利铂有很强的细胞毒性,无肾毒性,胃肠反应和血液毒性较小,对顺铂和卡铂无交叉耐药性,将其联合吉西他滨治疗有一定的抗癌作用[9-10]。
而作为最佳的天然抗癌药物,紫杉醇特别适用于晚期癌症患者的治疗,其作用机制是促进微管聚合,形成稳定的、失活的微管聚合物,使有丝分裂发生改变,引起细胞凋亡。从奥沙利铂的分离表明,奥沙利铂通过水合衍生物抑制 DNA的合成,而紫杉醇则能促进微管蛋白的聚合,抑制解聚,维持微管蛋白的稳定性,并抑制肿瘤细胞的有丝分裂与增殖,治疗效果更好,协同吉西他滨治疗,可发挥更好的抗肿瘤作用。
本研究结果显示,治疗5个疗程后,2组可溶性细胞间黏附分子-1、E-钙黏素、血清细胞黏附分子、成纤维细胞生长因子、血管内皮生长因子(a、b、c)水平均较治疗前改善,且观察组优于对照组;治疗5个疗程,观察组总有效率为88.00%,高于对照组的60.00%;观察组不良反应总发生率为20.00%,低于对照组的48.00%;观察组患者中位生存时间为(17.21±3.41)个月,长于对照组的(12.25±2.45)个月。
综上所述,吉西他滨联合紫杉醇用于晚期膀胱癌的治疗临床效果确切,优于吉西他滨联合奥沙利铂治疗,可有效改善患者血清学指标,且不良反应发生率低,延长患者生存周期,值得推广和应用。

