不同施氮方式和施氮量对马尾松和木荷幼苗根系土壤细菌群落的影响
郭萍萍, 黄幸然, 吴旺旺,3, 郑丽丽, 方 熊,*, 易志刚
1 福建农林大学资源与环境学院/土壤环境健康与调控福建省重点实验室, 福州 350002
2 福建闽江河口湿地国家级自然保护区管理处, 福州 350200
3 平潭综合实验区市政园林有限公司, 福州 350400
20世纪以来,随着科技进步和工农业的快速发展,化石燃料以及氮肥大量使用,人类向大气中排放的含氮化合物迅速增加。据估算,大气氮沉降量从1860年约31.6 Tg N/a增加到1995年的100 Tg N/a,并持续增加,2050年预计达到200 Tg N/a[1]。我国已成为继欧洲和北美之后的世界第三大氮沉降集中区[2],2000—2010年间大气氮沉降量平均增加了0.35 Tg N/a[3],我国15%的陆地氮沉降量超过临界值30 kg N hm2a-1以上[4]。
大气氮沉降是全球氮素循环的一个重要过程,对陆地生态系统的物质平衡和可持续发展产生了重要影响。氮的大量输入引起了一系列的生态问题:如土壤酸化[5],降低土壤微生物生物量[6];影响土壤温室气体的释放[7];影响植物的生长[8],造成植物死亡率上升[9],从而改变森林生态系统的生物多样性和服务功能。
细菌是土壤微生物的重要群落,参与营养元素循环、凋落物降解和土壤肥力变化等过程[10]。细菌群落能够对土壤生态系统生理生化过程做出敏锐反应[11]。已有研究表明氮沉降增加会改变土壤氮素循环过程,导致土壤C/N 降低[12],改变土壤酸碱基离子平衡,影响土壤硝化和反硝化作用[13],导致土壤细菌群落结构改变[14-15]。郝亚群等[16]通过野外模拟大气氮沉降试验,发现亚热带地区杉木幼林土壤高氮处理之后,酸杆菌门平均相对丰度下降,变形菌门平均相对丰度增加。刘蔚秋等[17]研究林缘和林内两个生境发现,施氮后无苔藓土壤细菌数量减少,林内比林缘减少更明显。Compton等[6]利用Biology和分子技术研究发现,长期施氮能够降低微生物量碳,改变固氮微生物群落结构。张海芳等[18]采用高通量测序技术研究发现,氮素和水分输入改变后,水分可改变氮添加对土壤细菌群落组成、丰度的影响。还有研究表明,施氮能够降低细菌丰度[19],改变真菌与细菌比率[20],从而改变土壤微生物群落结构,影响生态系统生物地球化学循环。当前,氮沉降对土壤细菌多样性和群落组成的影响并不十分明确。
已有研究表明,平均52%—59%的氮沉降被植物冠层截留[21],这部分氮量能够被植物冠层吸收和转化,满足生长季所需氮量的1/3[22],造成植物凋落物、根系分泌物、养分吸收速率和土壤性状的差异[23],从而使到达土壤中的氮量降低。目前我们对大气氮沉降的研究主要通过土壤表层或者林下直接施氮的模拟实验,忽略了植物冠层对氮沉降的吸收和利用,可能高估了氮沉降对土壤中生理生化的影响[24-25]。
因此,本研究以土壤细菌群落为研究对象,设置了2种氮添加方式(土表施氮SAN、叶面施氮LAN)、3个氮浓度,以探讨不同施氮方式和施氮量对土壤细菌多样性和群落组成的影响,为更加深入探讨氮沉降对土壤生态系统影响研究提供科学依据。
1 材料与方法
1.1 实验设计
本研究选取亚热带典型树种马尾松(PinusmassonianaLamb.,P.massoniana)和木荷(SchimasuperbaGardn.et Champ.,S.superba),于2012年3月将生长状况相近的1a龄马尾松、木荷幼苗分别移栽至温室的花盆中(高30 cm、直径44 cm)。待2个月缓苗后进行实验处理。根据广州2006年大气氮沉降量为5.6 g N m-2a-1[26],设置3个氮添加处理:对照(CK,5.6 g N m-2a-1)、中氮(mN,15.6 g N m-2a-1)、高氮(hN,20.6 g N m-2a-1)。每个氮添加水平下设置2种氮添加处理方式:土表施氮(SAN:直接用花洒将溶液均匀洒在土壤表层);叶面施氮(LAN:从幼苗顶端用花洒喷洒时用塑料薄膜围在幼苗周围,防止溶液喷洒到盆外,尽量保证全部均匀喷洒在植株上)。共计12个处理,每个实验处理设置6个重复。依据广州年降雨量约为1700 mm,其中80% 分布在雨季(4—9月),每周五喷施NH4NO3,CK、mN、hN处理每盆所需NH4NO3量分别为0.047、0.130、0.172 g[27]。
1.2 样品采集
于2013年雨季(4月中旬)和旱季(10月中旬)进行两次采样。采样前移除盆栽中的凋落物,在植物周围约10 cm半径处用土钻采集0—20 cm土壤样品3个,同一处理随机2盆采集的土壤样品混合为一个样品,每个实验处理得到3个重复样品。采土后迅速挑出细根和碎石,过筛,分成两份:一份自然风干用于理化性质分析;另一份分别将3个重复待分析样品混匀为一个待分析样品,贮存于-80 ℃用于PCR-DGGE分析。
1.3 样品分析
(1)土壤理化性质分析

(2)土壤细菌群落分析(PCR-DGGE)
本研究采用土壤DNA提取试剂盒FastDNA®SPIN Kit for Soil(Q-Biogen, MP Biomedicals, CA, USA)提取土壤微生物总DNA。以土壤总DNA为模板,通用引物UF:5′-AGAGTTTGATCMTGGCTCAG-3′ 和引物UR:5′-ACGGTTACCTTGTTACGACTT-3′[29];PCR反应程序:94 ℃(5 min);94 ℃(1 min),55 ℃(1 min),72 ℃(2 min),30个循环;72 ℃(10 min),进行16S rRNA基因接近全长扩增(约1600 bp)。以16S rRNA基因产物为模板,选择大部分细菌特异性较高的V3区作为扩增片段,采用引物GC-341F:5′-GC-CCTACGGGAGGCA GCAG-3′(GC-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGG)和534R:5′-ATTACCGCGGCTGCT GG-3′[29];Touch-down PCR反应程序为:94 ℃(7 min);94 ℃(1 min),65 ℃(1 min),每个循环-1 ℃,72 ℃(90s),10个循环;94 ℃(1 min),55 ℃(1 min),72 ℃(90 s),20个循环;72 ℃(10 min),进行16S rRNA基因V3区长度约200 bp的扩增。
PCR采用30 μL反应体系:15 μL 2×Taq Mastermix、1 μL引物1、1 μL引物2、1 μL DNA模板、12 μL ddH2O;PCR扩增实验中均同时采用阴性对照。
根据扩增产物的片段长度,选择浓度为8%(acrylamide/bis-acrylamide 37.5∶1)的聚丙烯酰胺凝胶进行条带分离。变性梯度为45%—60%(100%的变性剂为含有去离子甲酰胺40%、尿素7 M的混合物)。电泳温度62 ℃,条件120 V,10 min;60 V,990 min。银染法染色,拍照保存。DGGE凝胶中切下、回收、扩增、纯化特异性的、共有的优势条带,选择pEASY®-T1 Cloning Kit试剂盒克隆。克隆成功的阳性克隆产物由上海生工生物工程有限公司进行测序。
1.4 数据处理

(1)
(2)
式中:i为泳道中第i条条带,Pi为泳道中第i条条带灰度占该泳道总灰度的比例。
2 结果与分析
2.1 土壤理化性质

表1 土壤理化性质

表2 氮水平和氮添加方式对土壤理化性质的影响(多因素方差分析)
2.2 DGGE图谱分析和细菌多样性分析
DGGE指纹图谱得到多条清晰条带,说明土壤细菌群落丰富。
土壤细菌香农威纳指数(H)和辛普森优势度指数(D)表明,氮添加方式影响土壤细菌多样性。旱季LAN处理,土壤细菌多样性高于SAN处理;雨季LAN处理,木荷土壤细菌多样性高于SAN处理,马尾松土壤细菌多样性与SAN处理差异不大。氮水平之间,马尾松土壤细菌多样性随氮添加水平增加先降低后增加,木荷土壤细菌群落多样性施氮处理后表现为增加(表3)。
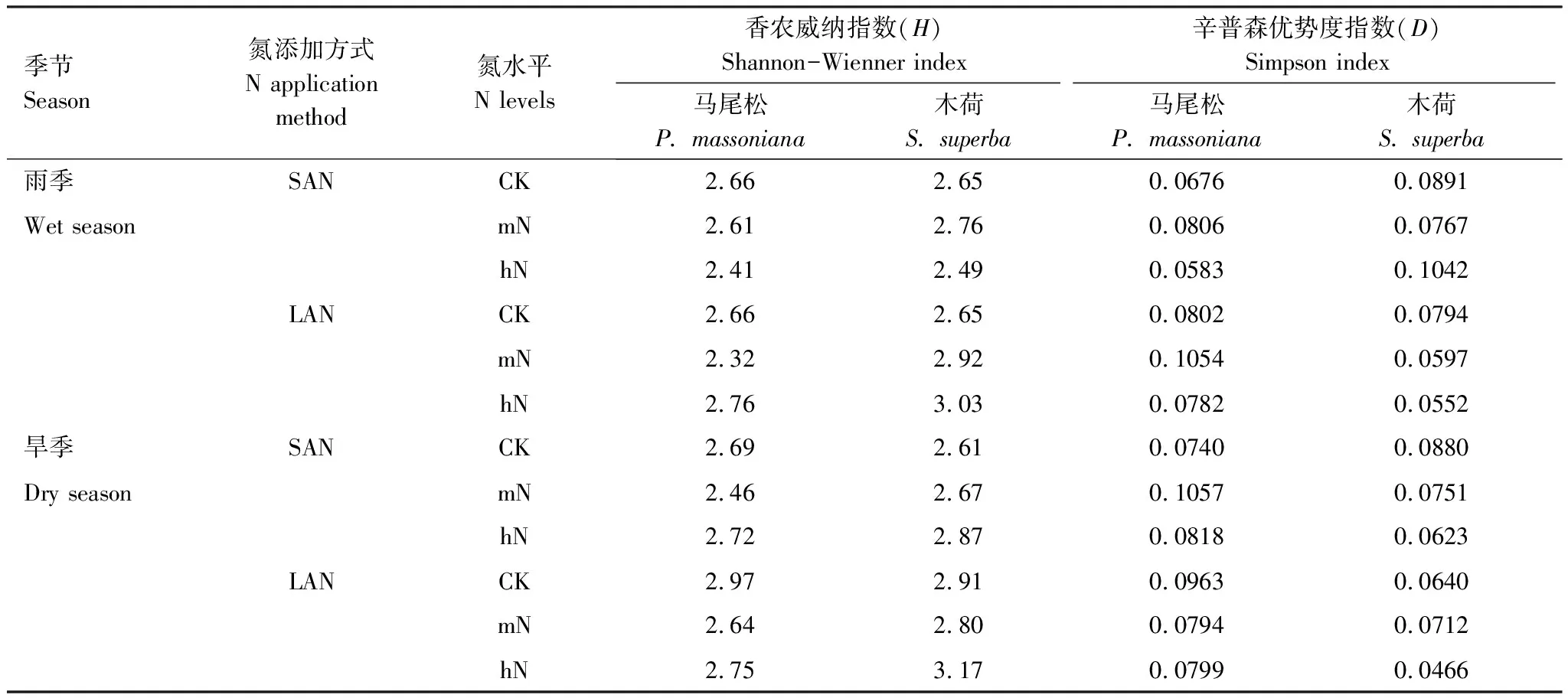
表3 氮添加量和添加方式对土壤细菌群落多样性的影响
2.3 DGGE条带序列、系统进化树及不同处理主要菌群相对丰度分析
聚丙烯酰胺胶中回收不同位置的条带64条(图1),克隆测序获得其中34条条带序列,均在GenBank数据库中搜索到相似菌株序列,且除B55,相似度均高于95%(表4)。
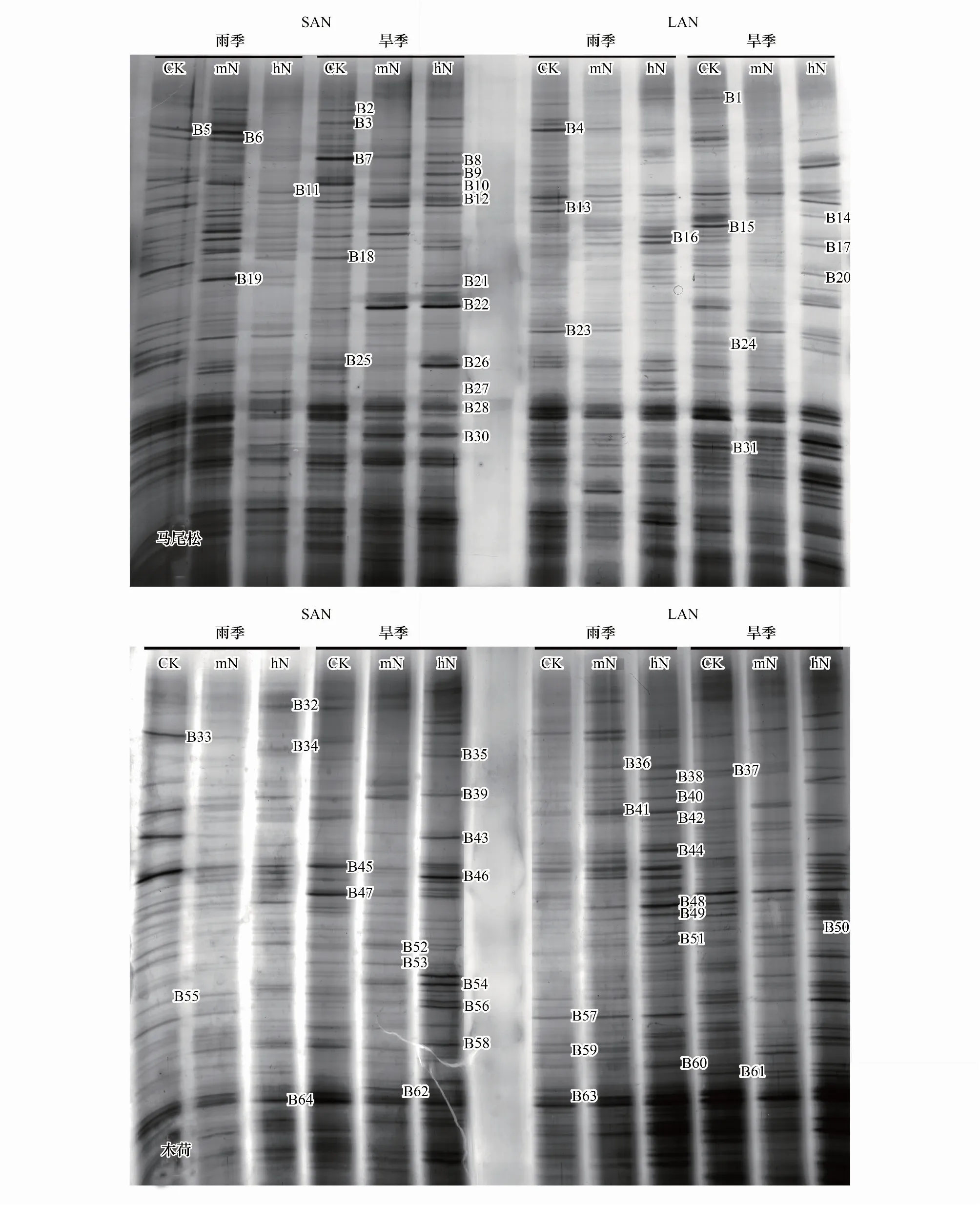
图1 马尾松和木荷根系土壤细菌16S rRNA V3区变性梯度凝胶电泳图谱(DGGE)
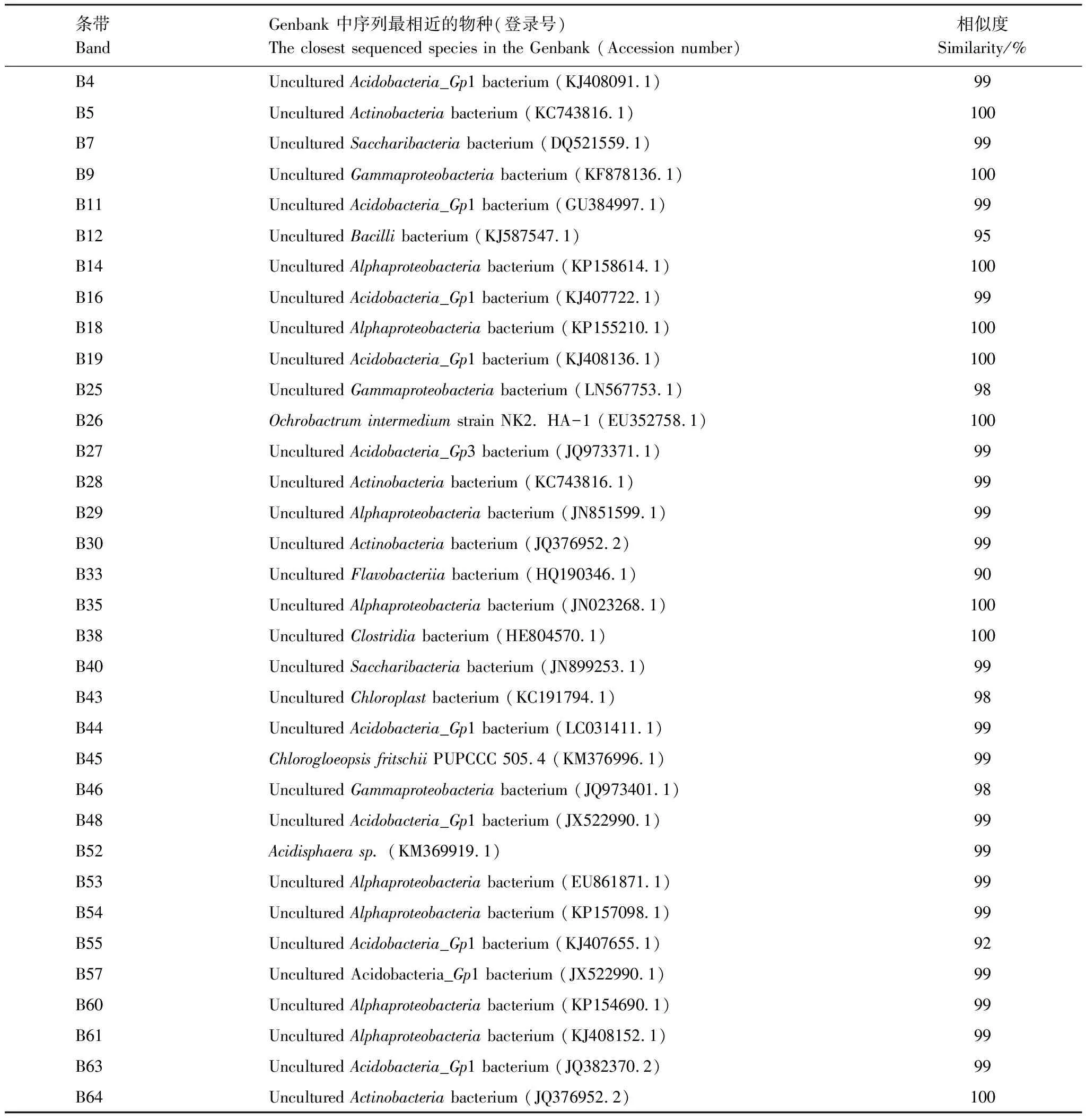
表4 DGGE回收条带序列比对结果
马尾松和木荷土壤细菌群落属于Clostridia、Actinobacteria、Chloroplast、Cyanobacteria、Saccharibacteria、Acidobacteria_Gp1、Flavobacteria、Acidobacteria_Gp3、Gammaproteobacteria、Alphaproteobacteria等10个不同的类群(图2)。
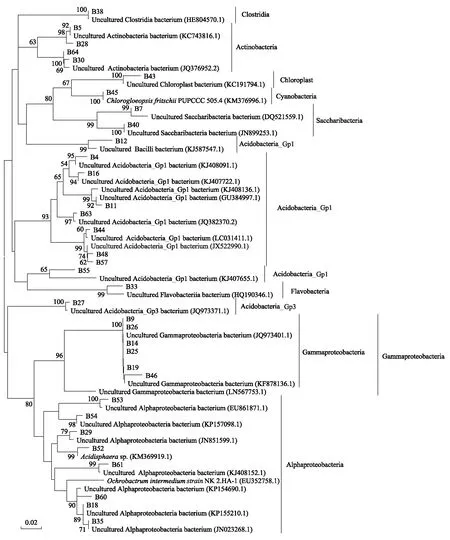
图2 土壤细菌群落系统进化树
马尾松土壤细菌群落的优势菌群为Acidobacteria_Gp1(14.2%—33.3%)、Gammaproteobacteria(0%—29.4%)和Alphaproteobacteria(7.0%—29.2%)。氮添加方式之间,雨季LAN处理,土壤Acidobacteria_Gp1相对丰度显著高于SAN处理(F=16.465,P=0.015),土壤Alphaproteobacteria相对丰度显著低于SAN处理(F=12.147,P=0.025);旱季LAN处理,土壤Acidobacteria_Gp1相对丰度也显著高于SAN处理(F=23.492,P=0.008)(图3)。氮水平之间,SAN处理对土壤细菌类群相对丰度影响不大,而LAN处理增加土壤细菌类群相对丰度。雨季,SAN-hN处理增加酸杆菌门Acidobacteria(Acidobacteria_Gp1、Acidobacteria_Gp3)相对丰度。旱季,施氮增加土壤Actinobacteria相对丰度,LAN-mN增加酸杆菌门Acidobacteria(Acidobacteria_Gp1、Acidobacteria_Gp3)相对丰度。雨季和旱季,土壤变形菌门Proteobacteria(Alphaproteobacteria、Gammaproteobacteria)相对丰度均随氮水平增加而增加。不同季节之间,SAN处理,雨季土壤Alphaproteobacteria相对丰度显著高于旱季(F=109.308,P<0.001)。
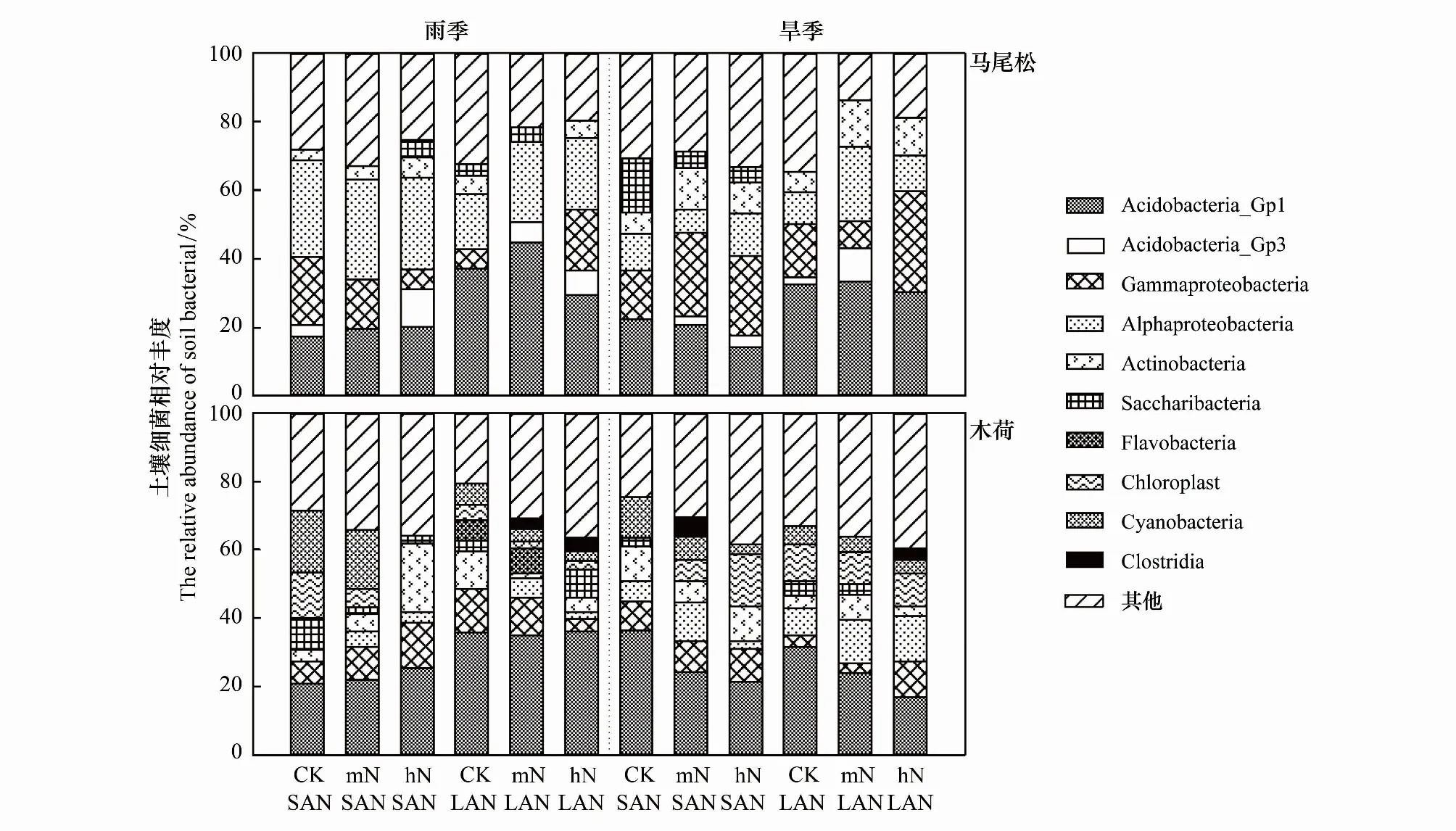
图3 不同处理条件下马尾松和木荷根系土壤细菌相对丰度
木荷土壤细菌群落的优势菌群为Acidobacteria_Gp1(16.7%—36.5%),并出现了Flavobacteria、Chloroplast、Cyanobacteria和Clostridia。氮添加方式之间,雨季LAN处理,土壤Acidobacteria_Gp1相对丰度显著高于SAN(F=83.659,P=0.001),旱季LAN处理,与SAN处理没有显著差异。氮水平之间,土壤细菌类群相对丰度随氮水平的升高而降低。雨季,施氮处理使土壤Cyanobacteria相对丰度升高,SAN处理使变形菌门相对丰度增加;旱季,土壤酸杆菌门相对丰度随氮水平的升高而降低,LAN处理使变形菌门相对丰度升高。土壤Clostridia仅出现在施氮处理中。不同季节之间,LAN处理,旱季土壤Chloroplast显著高于雨季(F=55.740,P=0.002)(图3)。
2.4 土壤细菌群落与环境因子的相关性分析(RDA)
马尾松土壤RDA前2个排序轴分别解释35.5%和23.8%的土壤细菌种群与环境因子之间的关系。雨季样品主要集中在第二、三象限,旱季样品主要集中在一、四象限,说明第一轴可以解释土壤细菌群落对氮添加的响应受到季节的影响。CK、mN、hN样品大致是由左下到右上分布,施氮量能够影响土壤细菌群落组成。土壤pH(F=1.721,P=0.042)与马尾松细菌群落变化显著相关,能够解释14.9%的细菌群落变化(图4)。
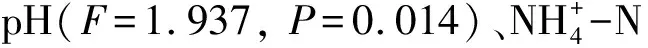
3 讨论

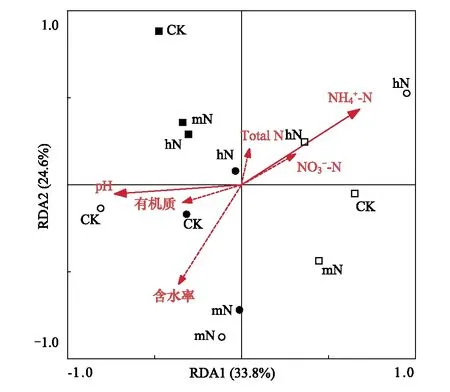
图5 木荷根系土壤细菌群落与环境因子的RDA分析
本研究还发现,土壤细菌群落组成对不同施氮方式和施氮量的响应受季节影响(图4, 5)。SAN处理,雨季马尾松土壤Alphaproteobacteria相对丰度显著高于旱季(F=109.308,P<0.001)(图3)。季节引起的差异主要由土壤水分、温度等气候条件、植物生长状况和微生物可利用底物等导致的。广州4月为雨季初,土壤温度升高、降水量增加,但此时植物生长缓慢,微生物可利用底物较少。10月为雨季末旱季初,植物生长旺盛,土壤凋落物累积,分解速率较快,微生物可利用底物较多,施氮使土壤中氮素不断累积,促进了异养型细菌的生长繁殖[16]。同时,土壤含水率影响微生物分解土壤有机质的过程,促进养分运输,进而影响土壤微生物生长[46]。本研究发现,旱季施氮处理,马尾松放线菌门(Actinobacteria)相对丰度升高(图3)。张海芳等认为,放线菌门Actinobacteria相对丰度在常规条件下施氮显著升高,但在灌溉条件下施加hN时显著降低,可能与其自身在不同水分条件下的形态特征有关,放线菌门对氮增加的响应依不同的水分状况存在差异[18]。因此,研究不同施氮方式和施氮量对土壤细菌群落的影响有必要考虑水分的影响。
4 结论