七株鹅肠道沙门氏菌的分离鉴定、药敏试验及毒力基因、耐药基因的检测
李 珂, 黄凯伦, 解新迪, 郭伟娜,刘 畅, 张 宁, 李贺侠, 路振香*
(1.安徽科技学院 动物科学学院,安徽 凤阳 233100;2.南京市栖霞区动物卫生监督所,江苏 南京 210046;3.安徽省和县动物疫病预防与控制中心,安徽 和县 238200)
沙门氏菌(Salmonella
) 是人和多种动物的致病菌,各个年龄段的动物均可感染沙门氏菌,但以幼年动物更易感, 感染者主要表现为急性腹泻、肠炎及败血症等。全世界每年大约有 1600 万人感染沙门氏菌病,其中,因为感染该病而死亡者约 60 万。沙门氏菌能引起多种动物的全身性的感染以及人类的食物中毒等,全世界每年因沙门氏菌引起的食物中毒人数经常占各类细菌性食物中毒首位。目前,沙门氏菌耐药性问题日益突出,给临床治疗该菌造成的感染带来很大困扰。本研究拟对2018年以来养殖户送检的7个批次在当地经过治疗没有效果,以肝脏、脾脏肿大、瘀血斑驳样,肠道广泛性出血,气囊浑浊为主要病理变化病死鹅进行病原分离鉴定、药敏试验、毒力基因、耐药基因的检测,为养殖户用药提供指导,并对其致病机理和耐药机制进行初步探讨。
1 材料与方法
1.1 材料
1.1.1 病料 2018年初至2019年底安徽滁州地区养殖户送检的7个批次在当地经过抗菌药物治疗没有任何效果的病死雏鹅若干只。
1.1.2 药敏纸片 庆大霉素、复方新诺明、头孢他啶、阿米卡星、头孢唑林、大观霉素、头孢曲松等抗菌药物纸片购于杭州滨和微生物试剂有限公司,生产批号是20190315。
1.1.3 试剂 引物均由安徽通用生物技术(安徽)有限公司合成。DL2000及2×Taq PCR MasterMixTM均购自宝生物工程(大连)有限公司。引物均由安徽通用生物技术(安徽)有限公司合成。
1.2 方法
1.2.1 病原菌的分离培养、纯化 用无菌接种环蘸取病死鹅的肝脏组织,分别在营养琼脂平板和麦康凯琼脂上划线进行病原菌的分离,37 ℃培养18~24 h。将麦康凯琼脂平板上培养出的单个典型菌落划线接种于普通营养琼脂平板上纯化,挑取纯化后的分离菌进行革兰氏染色,油镜下观察。
1.2.2 分离菌生化试验 将纯化后的分离菌分别进行糖发酵、吲哚形成、甲基红、VP和产HS试验。
1.2.3 分离菌DNA模板制备 对病原菌进行2次分离纯化,待镜检确保无杂菌后,用水煮法提取分离菌的DNA模板。
1.2.4 分离菌16S rRNA序列PCR扩增 使用细菌16S rRNA通用引物, 27F:5'-GCTTTATCCTCTGGCCTT-3' 和1492R:5'-GGTTAACCTTGTTACGACTT-3'。
PCR扩增体系(50 μL):Mix 25 μL,上、下游引物各2 μL,细菌模板2 μL,超纯水19 μL。
PCR扩增程序:95 ℃预变性5 min;94 ℃变性30 s,46 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃终延伸10 min。
1.2.5 分离菌体外抑菌试验 采用圆纸片法。分别用无菌涂布棒蘸取适量分离菌新鲜纯培养物均匀涂布于营养琼脂平板表面,将圆纸药片均匀地贴于其上,37 ℃培养16~18 h,观察记录结果。
1.2.6 分离菌毒力基因PCR扩增 根据文献[6~10]报道的沙门氏菌毒力基因序列合成试验所需的沙门氏菌毒力基因引物,引物序列如表1所示,PCR扩增反应条件见表2。

表1 分离菌毒力基因引物序列

表2 分离菌毒力基因PCR扩增反应条件
PCR扩增反应体系:PCRbuffer 2.5 μL、细菌模板1 μL、dNTP 1 μL、Taq酶0.25 μL、超纯水18.25 μL、上、下游引物各1 μL。
1.2.7 分离菌耐药基因PCR扩增 根据文献[11~12]报道的沙门氏菌耐药基因序列合成本次试验所需耐药基因引物,引物序列如表3所示,PCR扩增反应条件,见表4。

表3 分离菌耐药基因引物序列
反应体系25 μL:PCRbuffer 5.0 μL、超纯水15.75 μL、dNTP 1.0 μL、Taq酶0.25 μL、细菌模板1.0 μL、上、下游引物各1.0 μL。
1.2.8 琼脂糖凝胶电泳 在1%琼脂糖凝胶的第一孔加6 μL D2000Maker作为对照,其他孔分别加5 μL PCR扩增产物与1 μL Loading Buffer 的混合物。电压设定为110 V,电泳30 min。
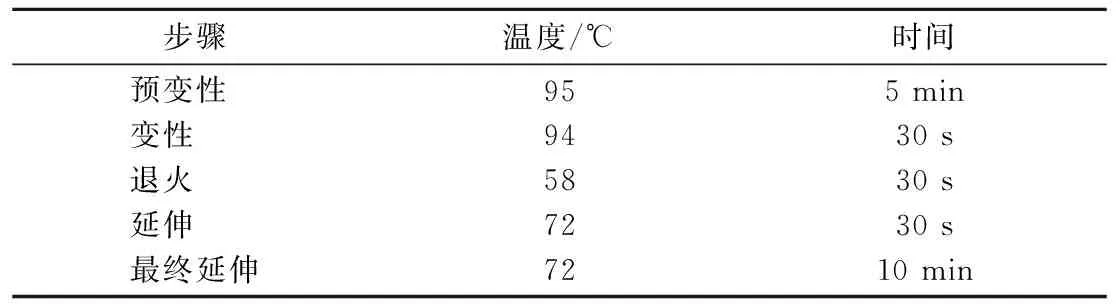
表4 分离菌耐药基因PCR扩增反应条件
2 结果与分析
2.1 病原菌分离培养及形态观察结果
从7个批次送检的病死鹅肝脏组织中分离到7株均为革兰氏阴性、单个散在的中等大小杆菌,该分离菌在麦康凯营养琼脂平板上均为淡橘红色透明、边缘整齐、光滑、圆形的小菌落,在营养琼脂平板上菌落均为灰白色圆形、边缘整齐、光滑湿润、半透明的小菌落。
2.2 分离菌生化试验结果
7株分离菌均能发酵葡萄糖、麦芽糖和甘露醇既产酸又产气,不能利用乳糖和蔗糖;吲哚形成试验和甲基红试验阳性,VP试验阴性,均产HS。
2.3 分离菌药敏试验结果
7株分离菌药敏试验结果见表5。
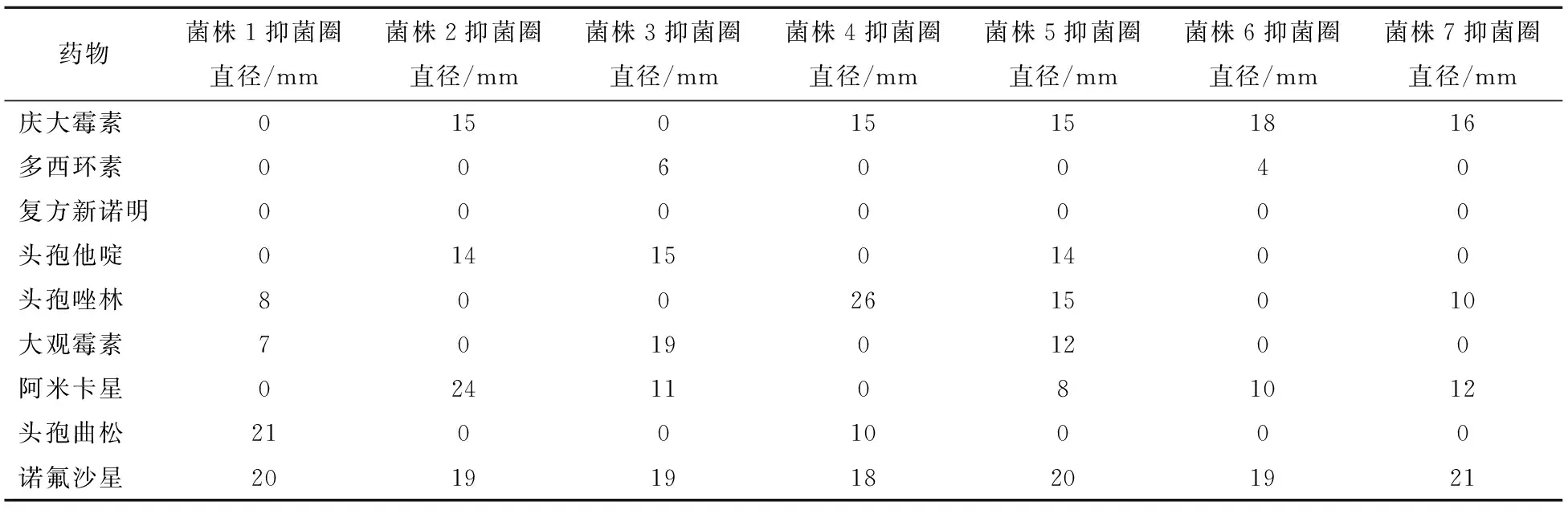
表5 7株分离菌药敏试验结果
2.4 分离菌16S rRNA序列PCR扩增结果
由图1可知:扩增出了与预期大小一致的目的基因。
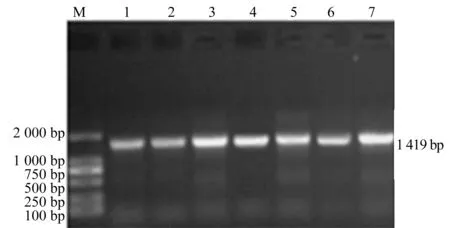
注:M:DL2000 marker;1~7:7株分离菌。
2.5 分离菌16S rRNA序列系统发育分析结果
由图2可得,7株分离菌均与GenBank中的肠道沙门氏菌同源性在99%以上,因此,分离菌均为肠道沙门氏菌。
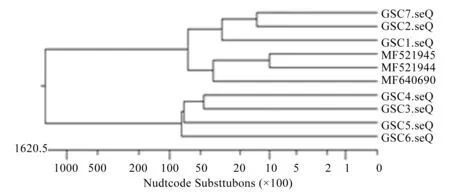
注: 图中GSC1~7为7株分离菌的序列。
2.6 分离菌毒力基因PCR扩增结果
分离菌毒力基因PCR扩增结果详见图3~5。结果显示,7株分离菌均没有扩增出毒力岛基因misL
和毒力岛基因ssaB
。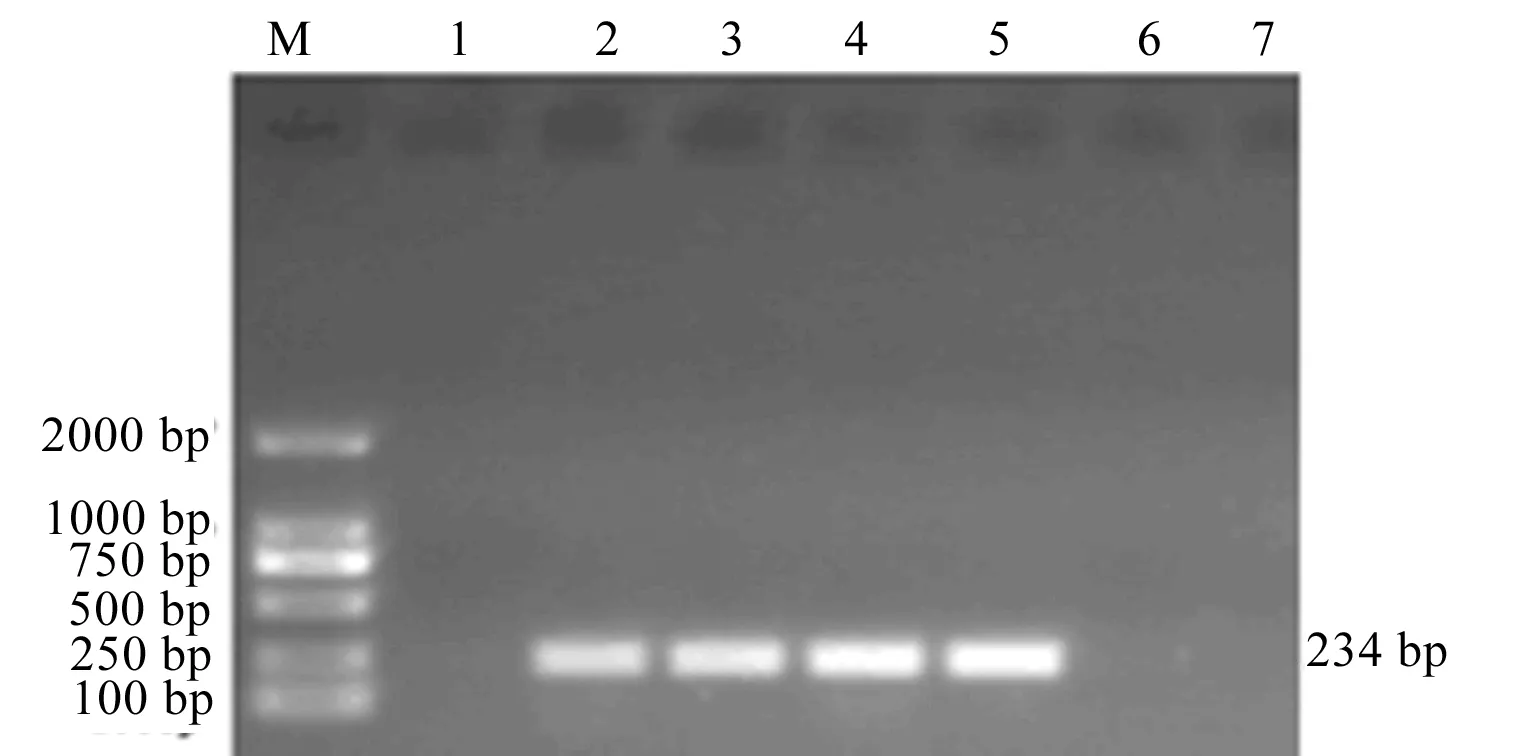
注:M:DL2000 marker;1~7:7株分离菌。下同。
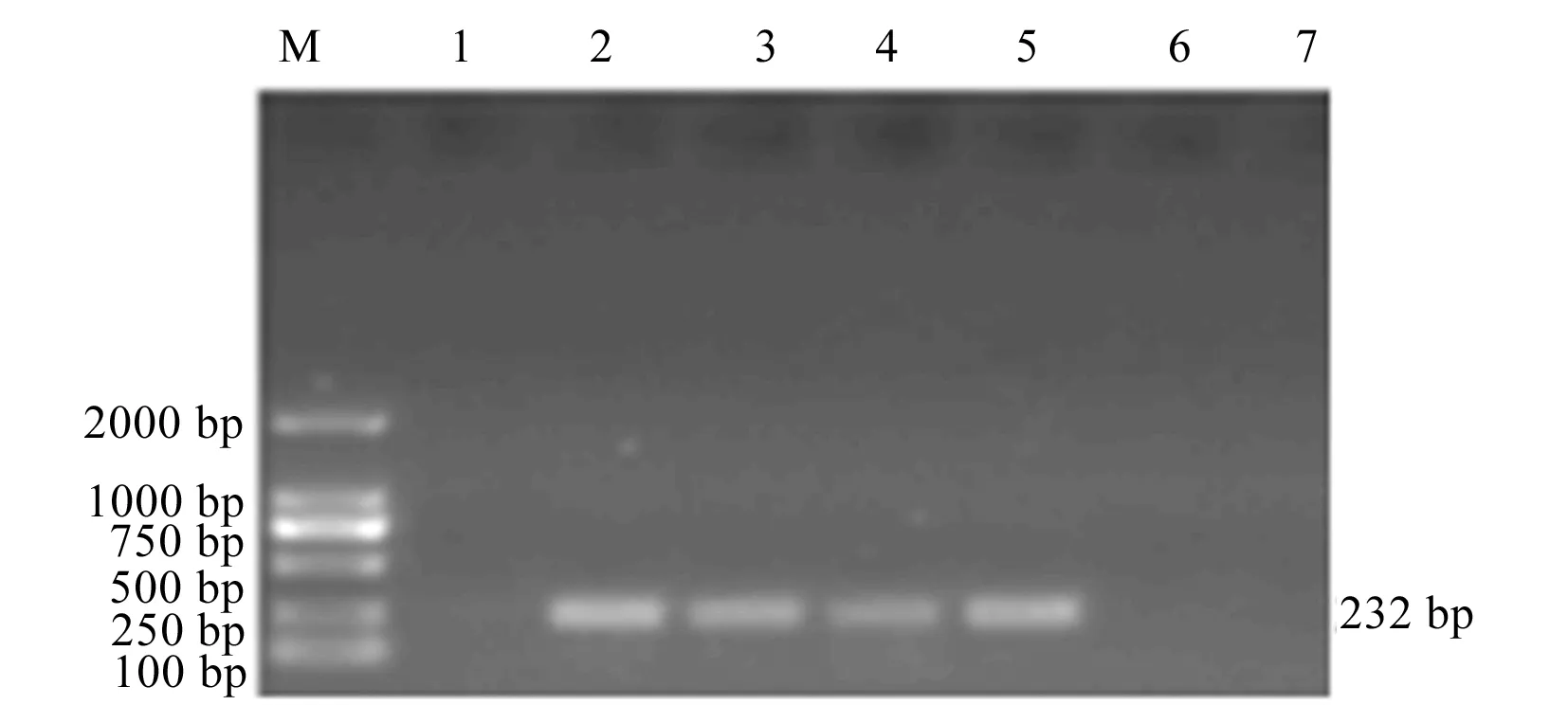
图4 分离菌菌毛基因invJ凝胶电泳图

图5 分离菌菌毛基因sipA凝胶电泳图
2.7 分离菌耐药基因PCR扩增结果
由图6~9可得,分离菌均没有扩增出喹诺酮类耐药基因qnr
。
图6 分离菌β-内酰胺类耐药基因blatem-1凝胶电泳图

图7 分离菌β-内酰胺类耐药基因baCMY-2凝胶电泳图
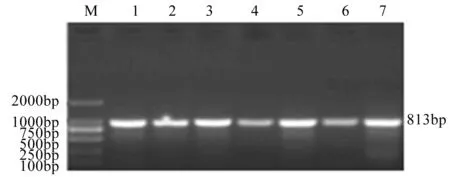
图8 7株分离菌磺胺类耐药基因sul1凝胶电泳图
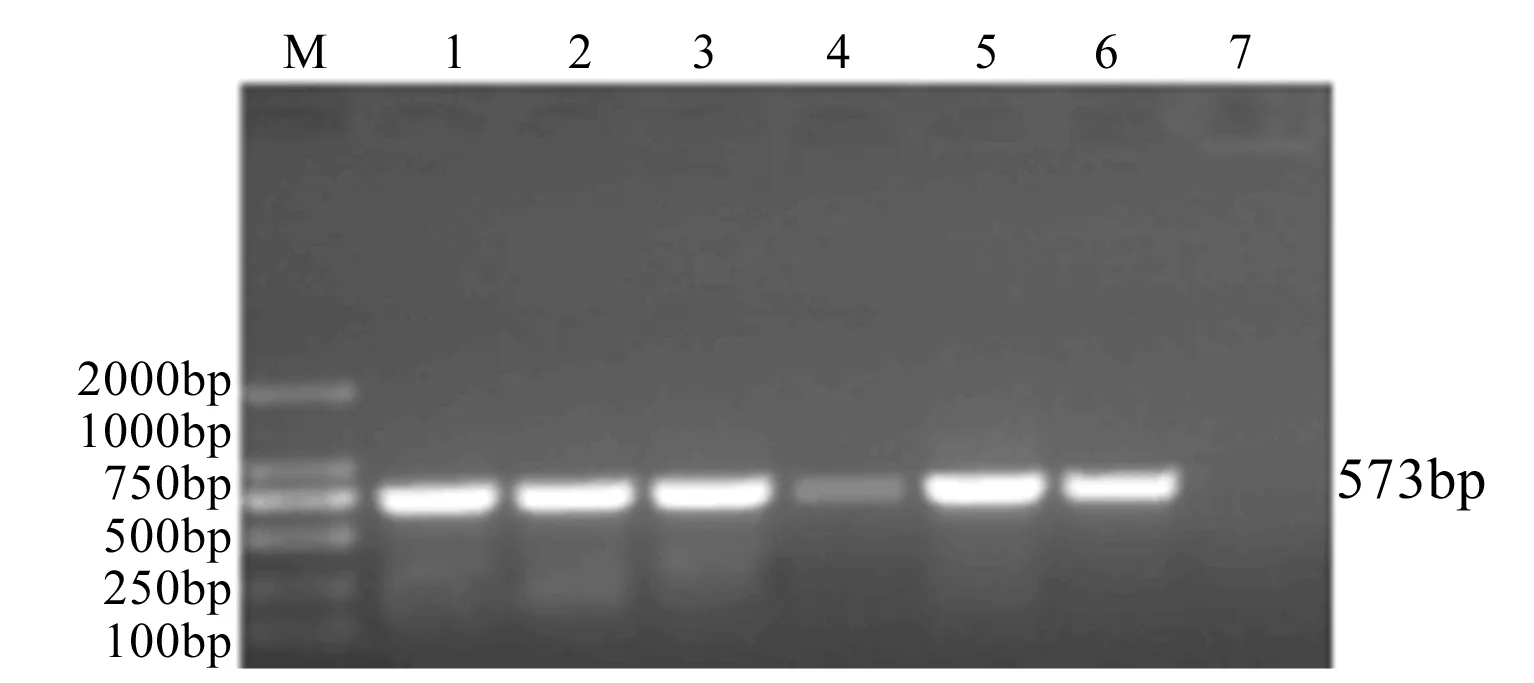
图9 分离菌卡那霉素耐药基因aadA1凝胶电泳图
3 结论与讨论
本研究从2018年初至2019年底养殖户7次送检的在当地经过抗菌药物治疗没有效果的病死鹅的肝脏中分离得到7株均为单个存在、革兰氏阴性中等大小杆菌,同源性分析结果显示:7株分离菌均为肠道沙门氏菌,并且分离株之间同源性较高,可能是由于该菌能够引起多种动物感染发病,并且该菌在患病动物排泄的粪便中含量高,这些病菌可以通过粪便污染土壤、饲料和水等,带有该菌畜禽粪便可以借助水源散播,鸭、鹅等水禽可以经水感染。产蛋种禽如果感染了该菌,能够通过种蛋将其传递给雏禽。送检病死鹅均来自滁州地区养殖户,饲喂的鹅苗有的来自同一家孵化场同一批次种蛋。
从药敏试验及耐药基因PCR扩增结果可知:7株分离菌株均表现出较强的耐药性,均对磺胺类药物(如:复方新诺明)耐药,并且都扩增出了磺胺类耐药基因sul1
;6株对阿米卡星耐药,且6株均扩增出卡那霉素耐药基因aadA1
;2株扩增出blaterm
-1
基因,3株扩增出β
-内酰胺酶类耐药基因baCMY
-2
,均未扩增出喹诺酮耐药基因qnr
。药敏试验结果与耐药基因扩增结果一致,细菌耐药性的产生与耐药基因的存在密切相关。毒力基因PCR扩增结果显示:4株分离菌扩增出肠毒素基因stn
和菌毛素基因invJ
,3株扩增出菌毛素基因sipA
,均未扩增出毒力岛基因misL
和毒力岛基因ssaB
。沙门氏菌的毒力因子有多种,主要包括脂多糖、肠毒素、菌毛、毒力岛、毒力质粒等。肠毒素是沙门氏菌中重要的致病因子,带有菌毛的菌株致病力很强,因菌毛具有黏附作用能与纤连蛋白结合抵抗消化道内的杀菌物质,从而降低机体抵抗力。
