小鼠胰腺发育几个关键转录因子的研究进展
陈雯,蔡亚欣,张金三,,李校堃,
(1.温州大学 生命科学研究院,浙江 温州 325035;2.温州医科大学附属第一医院 精准医学中心,浙江温州 325015)
胰腺是哺乳动物重要的器官之一,由内分泌腺和外分泌腺构成,内外分泌腺细胞的缺失或功能发生障碍会引起多种胰腺相关疾病,如青年发病的成年型糖尿病(maturity onset diabetes of the young,MODY)。同时,在先天性疾病中,胰腺的发育畸形及不全也是小儿外科领域的重要疾病之一[1-2]。因此,胰腺发育的研究是生命科学的重要领域,其中转录因子Pdx1、Ptf1a、Ngn3、Sox4、Sox9、GATA6在胰腺发育期间至关重要,调控祖细胞增殖、分化,并对祖细胞命运起决定性作用,其调控网络和作用机制或将为糖尿病防治及先天性疾病的防控提供重要的理论依据。为此,本文针对胰腺不同发育阶段及相关的几个核心转录因子表达及其作用的相关研究进展进行综述。
1 小鼠胰腺早期发育
小鼠胰腺发育过程包括早期细胞的分离、细胞谱系限定、组织扩张和重塑。根据胰腺形态发生变化可以将其分为三个阶段。即胚胎期E8.5-E12.5,此期间为胰腺发育第一过渡阶段,胰腺开始出芽,背侧和腹侧胰芽逐渐融合,形成细胞谱系;E12.5-E16.5,为胰腺发育第二过渡阶段,此时胰腺特异性基因快速增殖,形成祖细胞池[3]。随后,细胞增殖能力逐渐降低,胰腺形态发生变化,导管和腺泡(即外分泌部分)开始形成,呈现出独特的分支形态;而内分泌前体细胞则通过分层的方式从分支中脱离,聚集在主干中[3]。E16.5-出生后为第三个过渡阶段,此阶段胰腺的内外分泌部得到重塑并趋于成熟。
1.1 胰腺发育的第一个阶段(E8.5-E12.5)
在胚胎期E8.5-E12.5,小鼠胰腺开始第一次形态演变。E8.5胰腺诱导发生,内胚层中预定的胰腺前区,诱导胰腺标志物表达,进一步抑制预定的胰腺内胚层中Shh的表达。E9.5左右,前肠上皮开始增厚,单层上皮细胞向复层上皮细胞转化,并与周围间充质结合形成背侧和腹侧原基,随后前肠两侧形成胰腺的腹芽和背芽,腹芽与十二指肠相连,而背芽则沿着胃的一侧向脾脏方向生长[4]。胰芽由胰腺多能祖细胞(multipotent progenitor cells,MPCs)组成,并表达多种转录因子,包括羧肽酶A1(carboxypeptidase A,CPA1)、胰腺十二指肠同源盒1(Pdx1)、胰腺特异转录因子(Ptf1a)、Sox9、Nkx6.1以及Ngn3等[5],相互协调促进MPCs增殖。这一阶段,背芽和腹芽独立生长,其上皮细胞具有多潜能特征,能够分化为导管、腺泡和胰岛细胞[6]。E9.0-E11.5,胰芽呈现树状上皮样的微区,由顶端极性细胞和躯干成形细胞组成,每个微区在E10.5左右会继续演变形成微腔,背芽向前延伸。直到E12.5,肠道旋转,背芽和腹芽融合在一起,此时胰腺一端与胃、脾相连,另一端与十二指肠形成胰腺雏形[7]。
1.2 胰腺发育的第二个阶段(E12.5-E16.5)
大约在E12.5,胰腺开始进入“二次转变”。这个阶段,胰腺的发育遵循分支形态发生的协调过程,背腹芽的前体细胞能够自我更新并增殖形成细胞索,这群细胞反复分支,密集排列的上皮细胞也开始重塑其导管结构[8],形成导管和腺泡。此过程由导管末端或附近的前体细胞驱动,导管末端相连的细胞群驱动导管伸长和分支。此时MPCs群体将逐渐分为两部分:分支顶端群体以及前内分泌细胞和导管祖细胞的双潜能祖细胞群。
导管末端前体细胞,包括多能干性祖细胞和腺泡及导管的祖细胞,它们协同促进胰腺生长。在导管重塑的同时,前体细胞逐渐移动到胰腺的“顶端-躯干成形”区域,形成一个中央包含多个憩室的管丛。分支形态发生阶段,管丛中的微腔扩展延伸为胰腺导管。随后,“顶端-躯干”区域开始发生分离,顶端细胞被认为是形成腺泡的前体细胞群,而躯干细胞分化为导管细胞和内分泌细胞,诱导导管区域扩张形成成熟的导管。此时,胰岛前体细胞开始分层。在“二次转变”过程中,导管末端存在少量具有自我更新潜能的前体细胞,这些细胞驱动导管网络扩张。通过连续的导管分支,这些活跃的前体细胞在新形成和已经扩张的导管末端分离,诱导导管网络的形成[8]。
根据导管和腺泡细胞的大小分布以及空间组织的相关性,在分叉过程中,腺泡前体细胞必须与自我更新的导管前体细胞共同定位,并经历相同的动力学过程,才能正常发育[6]。E12.5 后,腺泡室的大部分扩张是由腺泡前体细胞的自我更新引起的。从E13.5开始,顶端细胞致力于腺泡的命运,并开始大规模的增殖,迅速增加腺泡在网络中的数量。同时胰腺形态发生较大改变,比如快速生长的主干,经历独特的分支演变后形成导管和腺泡(外分泌部分);内分泌部分通过分层从分支中脱离,在躯干区域形成不成熟的胰岛,这些不成熟的胰岛接受神经系统的管控,分散在外分泌组织和血管区域,以确保胰腺成熟后血液中内分泌激素的有效分泌[5]。
在第二阶段,MPCs分化为顶端(胰腺腺泡部分)祖细胞,继而分化为干细胞群(即导管和内分泌干细胞群)。祖细胞增殖能力逐渐丧失,胰腺特异性基因(Ptf1a、CPA1、GATA4和Nkx6.1等)表达增加。
1.3 胰腺发育的第三个阶段(E16.5-成熟)
E16.5后,小鼠腺泡尖端细胞分化,启动成熟腺泡细胞的标记物表达,如羧肽酶A。在胰腺“躯干”中,导管祖细胞分化,形成胰管,连接腺泡和十二指肠。而内分泌前体细胞则迁移到周围的间充质中,分化为α细胞、β细胞、δ细胞、PP细胞,同时分泌激素,最终形成胰岛[9]。小鼠出生后,胰腺在各级信号及外界环境的相互调控下继续完善。胰岛β细胞经过出生后2~3周的重塑具备完整的功能,导管和腺泡功能也日趋完善,最终形成具有完整功能的成熟胰腺。
2 小鼠胰腺发育相关转录因子调控
胰腺的正常发育与转录因子Pdx1、Ptf1a、Sox4、Sox9、Ngn3以及GATA6 的精准调控密切相关。第一阶段,Pdx1、Ptf1a及Sox9调控祖细胞增殖,诱导胰芽生长。第二阶段,Ngn3、Pdx1、Ptf1a、Sox4、Sox9调控MPCs的分化,其中内分泌细胞均由Ngn3+的细胞发育而来。E13.5之后,Pdx1主要表达于小鼠胰岛中。第三阶段,Pdx1、GATA6、Ptf1a在胰腺功能成熟中发挥作用(见图1)。在此,我们对这几个转录因子在胰腺发育三个阶段的主要作用作一阐述。
2.1 Pdx1
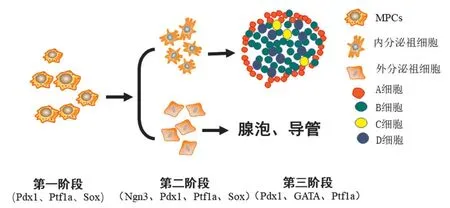
图1 小鼠胰腺发育不同阶段的关键转录因子示意图
Pdx1,也称为胰腺十二指肠同源盒1 或胰岛素启动子因子1,为包含同源结构域的转录因子。Pdx1的表达最早出现在小鼠的E8.5的5~6个体节期间[10]。E9.5之前,Pdx1的表达仅限于前肠的胰腺区域。此后,Pdx1在十二指肠上皮、胆管和胃后部也有少量表达[11]。E13.5,小鼠胰腺上皮中可看见一些Pdx1表达水平较高的细胞。E14.5,Pdx1在这些细胞中表达量更多[11]。而在小鼠的新生期和成熟期,Pdx1仅特异性表达于90%的β细胞和10%左右的δ细胞中。在胰岛素的调控过程中,Pdx1通过结合到胰岛素基因的启动子上,单独或协同其他因子调节胰岛素的合成[12]。
Pdx1促进胰腺发育和胰岛细胞分化,是胰腺早期胚胎发育和分化所必需的。当从E11.5(正常的胰腺上皮和小管形成之后)开始到整个分娩过程中阻断Pdx1的表达时,小鼠胰腺的发育也会被阻滞,此时发育不全的胰腺仅由导管组成,而不是腺泡或胰岛细胞[13]。在小鼠成熟的β细胞中,Pdx1的减少引起葡萄糖耐受不良,这提示Pdx1 在维持小鼠β细胞功能中具有关键作用[13]。Pdx1单基因缺陷引起人类的MODY,也支持了该推论。在非肥胖糖尿病(NOD)小鼠和人类1型糖尿病(T1D)患者中,检测到Pdx1自身抗体,表明Pdx1可能是T1D的自身抗原[14]。在人类2型糖尿病(T2D)中,胰岛β细胞的Pdx1表达水平也受到损害[15]。这些数据表明Pdx1在人体和小鼠早期胚胎胰腺形成,内分泌谱系的特异性分化以及β细胞成熟后的功能中具有关键作用。
2.2 Ptf1a
Ptf1a,又称为胰腺特异性转录因子,是一种螺旋-环-螺旋(bHLH)蛋白。E9.0-E9.5,Ptf1a与Pdx1在小鼠胰腺背侧和腹侧的上皮中共表达。E10.5,Ptf1a仅限于胰腺原基的上皮中,与十二指肠有清晰的边界。E12.5,Ptf1a在胰腺分支上皮的生长端表达,但最终只在腺泡细胞中表达[11]。
Ptf1a对小鼠MPCs的增殖、腺泡细胞的分化和维持具有重要作用[16]。小鼠细胞谱系追踪实验表明,早期胰腺上皮中Ptf1a表达的细胞会形成腺泡、导管以及内分泌等胰腺所有细胞类型[17]。因此,在胰腺发育早期阶段,Ptf1a表达阳性的细胞其实是未分化的祖细胞。此外,在斑马鱼实验中发现胰腺内外分泌腺的发育与Ptf1a之间存在剂量依赖性,低水平的Ptf1a表达会抑制外分泌腺发育,而高水平表达则会抑制内分泌腺发育[18],由此推断在小鼠胰腺发育过程中存在一个胰腺细胞内调控Ptf1a表达的机制。总之,Ptf1a对胰腺命运以及维持腺泡细胞的分化状态至关重要。
遗传谱系追踪实验表明,Pdx1 和Ptf1a是胰腺遗传谱系中最主要的转录因子,较高水平的Pdx1是维持胰腺谱系的基本条件。Ptf1a通过与Pdx1 的增强子结合增加其表达水平[19]。Pdx1与成纤维生长因子10(FGF10)之间有广泛的交叉调节网络。另外,Sox9与FGF信号通路相互作用,协同Pdx1调控多能干细胞的扩增以及器官发生的同一性[20]。小鼠发育中FGF10/FGFR2b/Sox9形成反馈环,调控胰腺发育,三者缺一不可。FGF10 缺失的多能干细胞中缺少FGFR2b和Sox9会导致肝脏发育畸形[21]。因此,通过了解胰腺转录因子可以为解决胰腺发育中出现的问题提供方向和思路。
2.3 Ngn3
Ngn3,属螺旋-环-螺旋(helix-loop-helix)家族转录因子中的一员,参与神经外胚层中神经前体细胞的分化。E8.5~E11.0,小鼠胰芽内瞬时表达Ngn3的细胞被认定为内分泌祖细胞。E8.5-E8.75 期间,Pdx1+细胞区域可以检测到少数Ngn3+细胞;E9.0,小鼠胰腺背侧上皮中Pdx1+细胞结构域内可检测到较多的Ngn3+细胞,但在该结构域外也有少量表达。E9.5,Ngn3在小鼠腹芽中开始表达,E11.5开始主要在胰腺中央上皮集中表达[11]。从E12.0开始,Ngn3表达量持续增加,E15.5时在胰腺中的表达量达到峰值,E18.5 时又急剧下降。Ngn3 表达量的改变与小鼠内分泌腺的形成过程密切相关[22]。同时,E12.5-E18.5,小鼠内分泌细胞开始出现[11],而后这些内分泌细胞经过分层、聚集形成胰岛,同时胰腺的神经丛也快速的扩张和重塑。
Ngn3在小鼠胰腺祖细胞维持、细胞命运分配和神经丛形态发生的协调关系中发挥作用,调节导管网络的生长和组装,继而形成分散的内分泌系统。胰岛主要由α细胞、β细胞、δ细胞和PP细胞组成。其中,β细胞分泌的胰岛素和α细胞分泌的胰高血糖素共同调节机体内葡萄糖稳态[3],它们均由Ngn3+祖细胞分化而来。
2.4 Sox
Sox基因家族是由众多具有HMG-box保守序列的基因构成的超基因家族[23]。在小鼠胚胎胰腺和成年鼠的胰岛中可以检测到多个Sox转录因子的表达[24]。
胰腺第一次转化期间,Sox4 在小鼠胰腺顶端和躯干祖细胞中表达[25]。第二次转化过程中,Sox4在小鼠胰腺上皮细胞中的表达逐渐减少,但在表达Ngn3的内分泌祖细胞和新形成的内分泌细胞中仍保持较高水平[26]。而小鼠胰腺祖细胞的形成与Sox4的失活关联不大[24-25]。同时,Sox11和Sox12在小鼠胚胎期也有表达[25,27-28]。Sox12突变体没有明显的形态缺陷[29],但Sox11突变体却表现出胰腺发育不全[30]。
小鼠胰芽出现之前,Sox9在假定的胰腺和近端十二指肠(位于前肠和中肠/后肠之间)中就能检测到[19],并与Pdx1表达重叠[21,31]。同时,Fgf10/Fgfr2b/Sox9反馈通路参与调控胰腺祖细胞和邻近间质中维持胰腺祖细胞的分化[32]。Sox9调节小鼠胰腺祖细胞中Fgfr2b的表达,Fgfr2b从间充质传递Fgf10 信号,Fgf10 反向维持Sox9 和Fgfr2b在胰腺祖细胞中的表达。此后,Sox9仅在小鼠胰腺导管细胞和躯干顶端交界处的细胞中表达[32-33]。
胰腺导管腺癌(PDAC)是最常见的外分泌恶性肿瘤,由于其早期诊断困难、转移和对常规放化疗的内在耐药性,是病死率最高的疾病之一。KRAS的高频突变是PDAC的一个主要标志。大量研究表明,致癌的KRAS突变诱导腺泡至导管上皮化生(ADM)、胰腺上皮内瘤形成(Pan IN),并最终导致PDAC。Sox9对于KRASG12D介导的ADM和Pan IN形成是必需的[34]。据报道,Sox9 可刺激ERBB途径中几个成员的表达,也是ERBB信号活性促进胰腺肿瘤发生所必需的[35]。这些研究通过促进ADM进一步巩固了Sox9在胰腺癌中的核心作用,特别是在KRAS突变和胰腺炎的背景下加速了癌前病变和PDAC的发展。这些发现为针对特定癌症驱动的信号分子(如ERBB2或FGFR2)的精确治疗开辟了新的前景。
综上所述,Sox因子可能是治疗肝病和糖尿病的主要靶点之一,值得继续挖掘。
2.5 GATA
GATA转录因子家族有6 个亚型,其中GATA1、GATA2及GATA3主要影响造血组织发育,GATA4和GATA5主要表达在小鼠心脏、性腺和内胚层衍生组织中[36]。而GATA6在小鼠的心脏、肺、肠、性腺、肾上腺和胰腺组织中均会表达[27,37]。已知GATA6可调节小鼠内皮源性器官的发育和内胚层基因的表达[37-38]。其中GATA6杂合子突变是导致小鼠胰腺发育不全的主要因素。在成人胰腺组织中,GATA6主要表达于胰岛和外分泌组织[39]。Amita Tiyaboonchai等[40]通过建立人离体PSC(pluripotent stem cells)模型系统,研究GATA6 在胰腺发育中的作用及β细胞的功能。他们在胰腺诱导过程中发现,GATA6突变株系会限制维甲酸(RA)信号传导,最后导致胰腺规格改变、β细胞显著降低。大多数胰腺发育不全患者还表现出其他缺陷,包括先天性心脏缺陷、肠道异常和宫内生长迟缓等[41]。这些数据表明,GATA6在人的内胚层发育和胰腺β细胞功能中起关键作用[42]。
3 小结与展望
胰腺相关疾病,如胰腺炎、胰腺癌和糖尿病严重危害人类健康,其发生发展与胰腺早期发育密切相关。胰腺各个发育阶段,转录因子的精准调节关乎胰腺以及邻近器官的命运。Pdx1是最先发现的胰腺特异性转录因子,目前关于糖尿病的治疗方式中,胰岛移植是有效手段之一,其中主要利用Pdx1对非胰腺β细胞进行重塑,使这些非胰腺β细胞转化为β细胞,对胰岛功能恢复的治疗展现很大的希望。已有研究表明胰腺发育中,生长因子与转录因子互作形成调控网络,比如Sox9 与FGF10、FGFR2b形成反馈环调控胰腺发育[43]。同时,我们发现FGF10缺失的小鼠血糖异常,这可能是生长因子与转录因子异常调控的结果,也可能是与1型糖尿病、胰腺癌、炎症相联系的关键节点。因此,了解Pdx1、Sox9、Ngn3、Ptf1a、GATA6与其他通路相互作用的机制,可以为胰腺癌、糖尿病及PDAC的治疗提供新策略。

