LAMA3在胰腺癌中的表达及其临床意义
李晨,宋洪亮,俞海波,单云峰
(1.温州医科大学定理临床学院 肝胆胰外科,2.温州医科大学附属第一医院 肝胆外科,浙江 温州 325000)
胰腺癌是具有较高病死率的消化道恶性肿瘤之一,并在未来的20~30年有可能成为恶性肿瘤患者中第二大死因[1-2]。在美国,目前胰腺癌的5年生存率约为10%,而在不发达国家其5年生存率低于5%。80%~85%的患者被发现时已属晚期,肿瘤难以切除[3],部分可以切除的患者中其5年生存率不到20%[4]。虽然近几年生物技术不断发展,围手术期管理不断进步,放化疗研究不断深入,但是胰腺癌仍缺少特异性强、敏感性高的诊断标志物以及有效的治疗手段。层粘连蛋白3(LAMA3)的编码基因位于18号染色体上,有76 个外显子,包括短链LAMA3 A转录本和长链LAMA3 B转录本,其转录本由39 至76 位外显子转录剪接而成。LAMA3目前已被证实广泛参与肿瘤的侵袭转移[5-7]。大量的文献已经报道LAMA3在胃癌[8]、卵巢癌[9]、肝癌[10]、膀胱癌[11]等肿瘤中表达异常,其在肿瘤中表达异常可能与其参与DNA甲基化以及组蛋白的去乙酰化相关。LAMA3在胰腺癌的研究鲜有报道,本课题拟分析LAMA3在胰腺癌患者中的表达情况并分析其与临床病理特征及肿瘤预后的相关性,以期判断其是否可以作为胰腺癌预后的分子标志物。
1 资料和方法
1.1 一般资料
回顾性分析2011年5月至2018年12月温州医科大学定理临床学院收住的胰腺癌患者40例,术后病理均确诊为胰腺导管腺癌,均行手术治疗,其中胰十二指肠切除术28例,胰腺体尾部12例,术前未进行辅助化疗。其中男17例,女23例,年龄56~74岁,平均65.2 岁,伴有淋巴结转移19 例。根据最新的AJCC胰腺癌TMN分期,I~II期15例,III~IV期25例。本研究方案经温州医科大学定理临床学院/温州市中心医院机构伦理委员会批准。
1.2 主要试剂
重组人抗LAMA3抗体[EPR8266](ab151715),购自美国Abcam。
1.3 实验方法
1.3.1 免疫组化评估LAMA3的表达情况:将胰腺癌组织及癌旁组织标本固定在10%中性福尔马林缓冲液中,并用石蜡包埋。切割,脱蜡并重新水化后,对5 μm切片进行抗原修复。组织切片与抗LAMA3的一抗(1:100稀释)在4 ℃孵育过夜。使用Image-Pro plus(IPP)6.0软件,通过染色强度和阳性染色细胞的百分比评估LAMA3的表达。根据IPP评分将染色强度分为四个等级:0(癌细胞无染色),1(弱染色),2(中度染色),3(强度染色)。阳性细胞的百分比评分如下:0(0),1(1%~25%),2(26%~50%),3(>50%)。染色总分=阳性细胞的百分比评分×强度得分。总分0~2定义为低表达,3~9分为高表达。
1.3.2 实时定量PCR(qRT-PCR)检测LAMA3 的mRNA水平:采用Trizol试剂,将总RNA(0.5 μg)反转为cDNA,用SYBR Green PCR测定LAMA3的mRNA水平,所有检测均重复三次。LAMA3 的相对表达分别相对于内参GAPDH进行了标准化。使用2-ΔΔCt法分析数据。GAPDH正向引物:5’-ATGGGGAAGGT GAAGGTCG-3’,反向引物:5’-GGGGTCATTGATGG CAACAATA-3’;LAMA3正向引物:5’-GTTTCACTG ATTTGGGCTTACC-3’,反向引物:5’-AGTCCAGAG TTGTCGCTTATTACA-3’。
1.3.3 Western blotting检测LAMA3蛋白水平:将胰腺癌组织和癌旁组织在含1 mmol/L PMSF的RIPA裂解缓冲液中于冰中裂解1 h,使用BCA蛋白测定对样品蛋白进行定量。通过SDS-PAGE分离等量的蛋白质,转移到PVDF膜上,并用抗体进行检测。一抗LAMA3和GAPDH的浓度为1:1 000,相应的二抗的浓度为1:2 000。
1.3.4 LAMA3 生物信息学分析:癌症基因组图谱(TCGA)数据库(https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)及Oncomine数据库(https://www.oncomine.org/resource/login.html)被用于验证LAMA3在胰腺癌组织中的表达情况。TCGA数据库总共包括87 个胰腺癌组织样本及80个正常组织样品。
1.4 统计学分析
使用统计软件包SPSS 19.00进行统计分析。率的比较采用χ2检验或Fisher精确检验。生存分析采用Kaplan-Meier方法,并进行对数秩(Log-rank)检验进行比较。P<0.05表示差异具有统计学意义。
2 结果
2.1 胰腺癌组织及癌旁组织中LAMA3的表达情况
免疫组织化学染色显示,在40对胰腺癌和癌旁组织中,24例癌组织LAMA3高表达(24/40,60%),而在癌旁组织中仅有10例LAMA3呈高表达(10/40,25%),两组高表达率对比有统计学差异(P<0.05),见图1。同时我们从40 例胰腺癌患者中随机选择了15组配对的胰腺癌组织和癌旁组织进行qRT-PCR检测,并随机从其中选择6组配对的胰腺癌组织和癌旁正常组织中进行蛋白质印迹分析。qRT-PCR和蛋白质印迹结果显示了癌组织中LAMA3 表达水平显著上调(图2A和2B)。
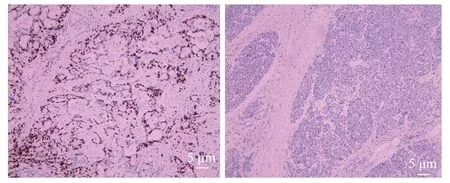
图1 胰腺癌组织及癌旁组织LAMA3阳性表达情况,阳性反应表现为棕色颗粒(免疫组化,×100)。
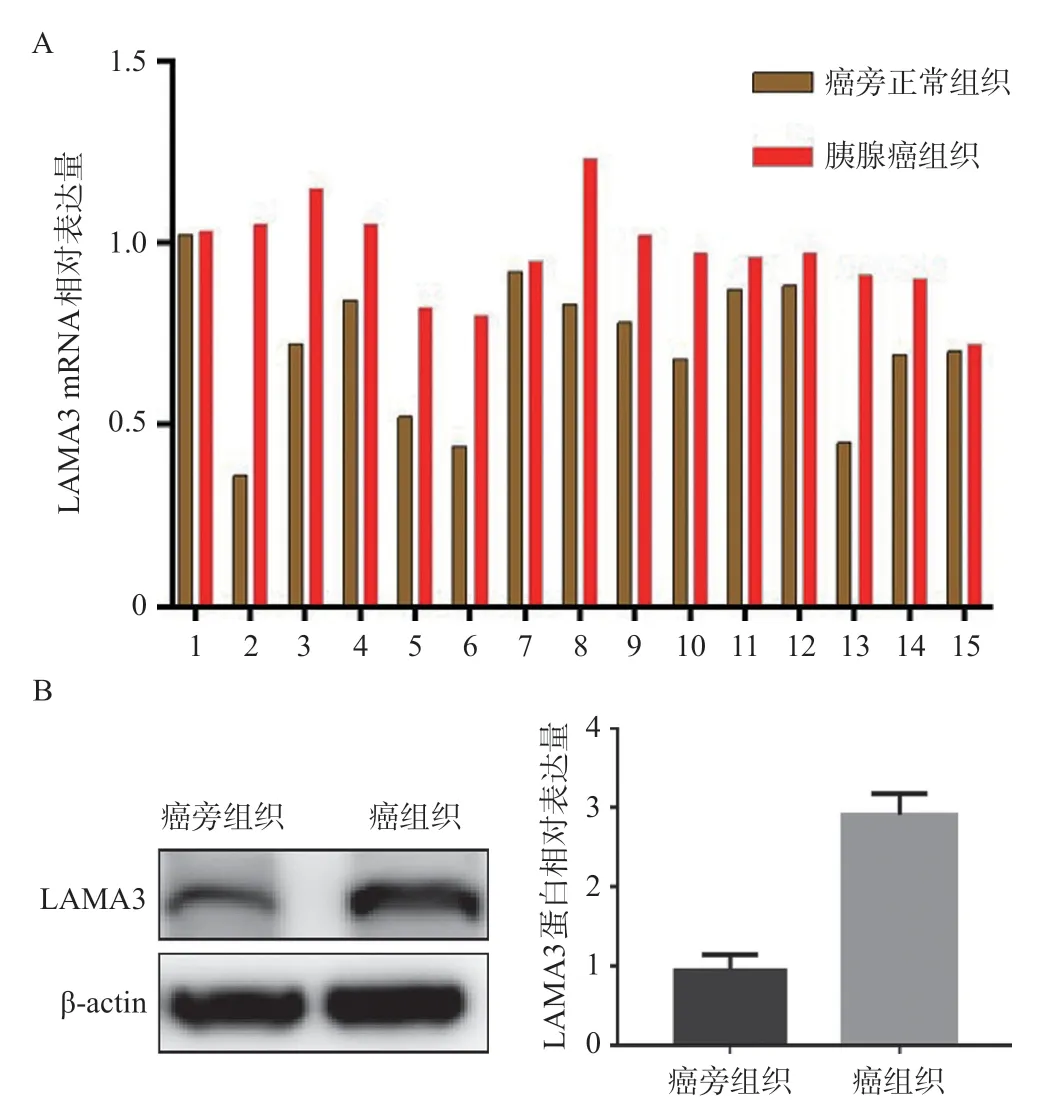
图2 胰腺癌组织及癌旁组织LAMA3 qRT-PCR和Western blotting检测结果
2.2 胰腺癌组织中LAMA3表达与临床病理特征的关系
分析表明胰腺癌组织中LAMA3的表达与患者的肿瘤大小、TNM分期有关(P<0.05),肿瘤大于2 cm以及TNM分期III~IV期的患者其表达水平更高。LAMA3 的表达与患者的性别、年龄、CA199 水平、分化程度、淋巴转移等无明显相关(P>0.05)。见表1。
2.3 LAMA3高表达组和低表达组胰腺癌患者的生存曲线
LAMA3 高表达组和低表达组胰腺癌患者的生存曲线如图3 所示。LAMA3 高表达的患者预后较LAMA3低表达更差(P<0.001)。
2.4 LAMA3在GEO及Oncomine数据库中的表达情况
对GEO及Oncomine数据库进行分析,LAMA3在GSE16515(P<0.0001)、GSE15471(P<0.0001)、GSE3654(P<0.0001)中的表达明显升高,其结果见图4。
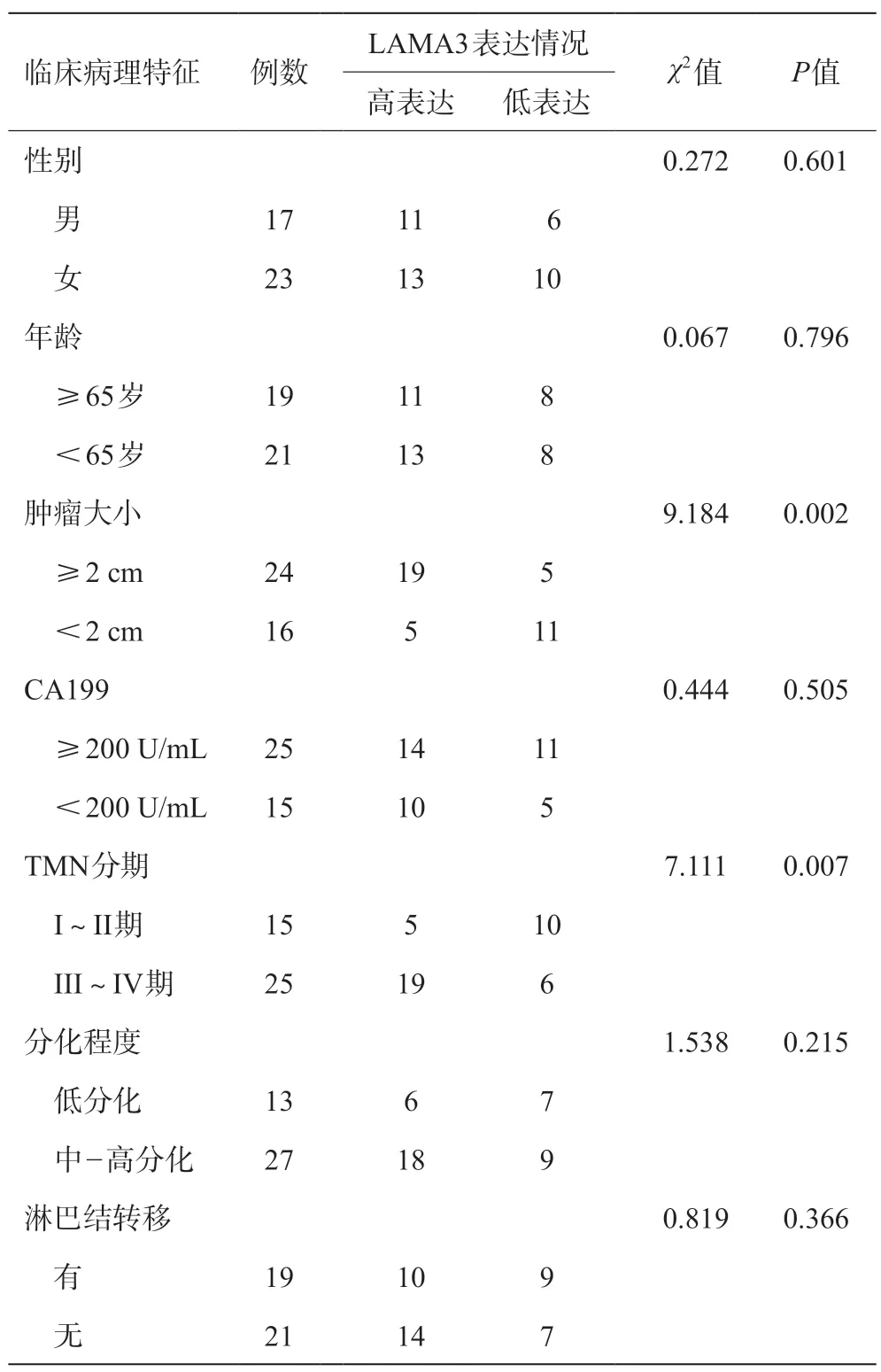
表1 LAMA3表达情况与患者临床病理特征的关系(例)

图3 LAMA3高表达组和低表达组胰腺癌患者的生存曲线

图4 GEO及Oncomine数据库分析提示胰腺癌患者LAMA3表达明显升高(P<0.0001)。
3 讨论
层粘连蛋白是由α、β和γ亚基组成的异三聚体分子,它们通过卷曲螺旋结构域组装。层粘连蛋白对于基底膜的形成和功能至关重要,并在调节细胞迁移和信号转导方面具有比较重要的功能[12]。而LAMA3基因则主要编码层粘连蛋白α亚单位,其变异会影响层粘连蛋白的表达,进而影响层粘连蛋白的生物活性。LAMA3蛋白在肿瘤发生发展中具有重要的作用。研究表明,在卵巢癌中LAMA3的表达水平低于正常组织和癌旁组织,LAMA3高表达组无复发生存率和总生存率明显高于LAMA3低表达组[9]。一项关于cDNA芯片研究与HCV感染相关的肝癌患者中,LAMA3表达显著上调[10]。LAMA3在肿瘤中的作用机制可能与DNA甲基化以及被miRNA调控有关。研究发现,胃癌组织中LAMA3甲基化水平显著升高,提示LAMA通过DNA的甲基化参与了癌细胞的发展[13]。另有研究表明miRNA-17/20a通过靶向LAMA3参与口腔癌的侵袭转移[14]。
课题组前期通过文献检索及生物信息学筛选,发现LAMA3在胰腺癌中存在差异表达,可能与胰腺癌的发生发展相关。为了进一步明确LAMA3在胰腺癌中的表达及其与临床病理特征的关系,我们对40例胰腺癌组织标本进行了免疫组化检测,同时对部分组织进行了Western blotting检测以及qPCR检测,发现LAMA3蛋白和mRNA在胰腺癌组织中呈现明显的高表达,三者结果相符,以上结果证实了LAMA3在胰腺癌的发展发展中可能扮演着癌基因的角色。通过统计分析,结果证实了LAMA3表达水平与患者的肿瘤大小、TNM分期明显相关,而与患者的性别、年龄、CA199水平、分化程度、淋巴转移等无关,肿瘤大于2 cm以及TNM分期III~IV期的患者其表达水平更高。本研究结果提示LAMA3 可能成为判断胰腺癌患者预后的肿瘤标志物。为进一步了解LAMA3表达与患者预后相关性,我们进行了生存曲线分析,该结果验证了我们的假设,LAMA3低表达的胰腺癌患者具有更长的生存时间。
本研究结果提示LAMA3 可能在胰腺癌的发生发展中起重要作用,但是由于我们的研究样本量小,为了进一步验证我们的结果,我们进行了在线生物信息分析,从临床样本库的生信分析中,发现其结果与我们的研究相符,临床样本库的结果同样提示在胰腺癌患者中LAMA3的表达水平明显升高。
综上所述,在胰腺癌中LAMA3高表达,提示预后不良,其可能成为判断胰腺癌患者预后的肿瘤标志物,并且可能成为胰腺癌患者靶向治疗的潜在靶点,但其在胰腺癌中发挥作用的机制有待于进一步研究。

