miR-542-3p对肝癌细胞恶性生物学行为的影响及机制探讨
周显飞,张阳,兰勇,聂寒秋,邢人伟,牟永华
(台州学院附属台州市立医院 肝胆外科,浙江 台州 318000)
肝细胞癌(Hepatocellular carcinoma,HCC)是常见的恶性肿瘤之一,病死率仍高居癌症第二位,在我国每年肝癌新增病例数占到全球的二分之一[1]。目前在肝癌的早期诊断、手术切除治疗、介入治疗以及靶向化疗等方面取得了较大进展,但肝癌患者的整体生存率并没有得到明显的提高[2]。因此,寻找肝癌早期诊断及治疗的标志物十分重要。HCC的发生发展与多种癌基因过度表达以及肿瘤抑制基因失活密切相关[3]。研究表明miRNA在肝癌中起到重要的作用[4],miR-542-3p是近来新发现的具有肿瘤抑制功能的microRNA,在肺癌、乳腺癌、食管癌、结直肠癌等中呈低表达,具有抑制肿瘤生物恶性生物学行为的特点[5-8]。有研究表明miR-542-3p在肝癌细胞中低表达,而且当下调miR-542-3p后肝癌细胞侵袭转移的能力增强[9]。本实验首先通过RT-PCR检测miR-542-3p在肝癌细胞及组织中表达情况,再通过体外转染miR-542-3p模拟物后,通过体外实验验证miR-542-3p对肝癌细胞恶性生物学特性的影响,并探讨其侵袭转移的可能机制。
1 材料和方法
1.1 组织标本收集及细胞培养
收集台州市立医院2014—2018 年收治的40 例肝癌患者病例资料,所有病例经病理诊断证实为原发性肝癌,且术前均未做任何治疗。人肝癌细胞系HCCLM3、Hep3B、Huh7、SMMC-7721、MHCC-97H、MHCC-97L以及人正常肝细胞LO2均取自台州学院医学院中心实验室。细胞培养于含10%胎牛血清的RPMI1640和DMEM培养基培养;于37 ℃、5%CO2的恒温培养箱中培养。视细胞生长情况,更换培养基。
1.2 miR-542-3p在肝癌组织及肝癌细胞中的表达量检测
实时荧光定量PCR:用Trizol试剂盒,根据操作说明提取组织标本及各细胞系细胞的总RNA,测定总RNA浓度,根据TaKaRa公司说明书严格进行逆转录及实时定量聚合酶链(RT-PCR)反应,每组3个复孔,以U6作为内参,在伯乐(Bio-Rad)实时定量PCR仪器进行检测,miR-542-3p的上游引物序列为5’-GGCGGTGTGACAGATTGATAA-3’,下游引物序列5’-TCGTATCCAGTGCAGGGTCCGAGGTATTCG CACTGGATACGACTTTCAG-3’;U6的上游引物序列为5’-TTATGGGTCCTAGCCTGAC-3’,下游引物序列5’-CACTATTGCGGGCTGC-3’,RT-PCR反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40 个循环。miR-542-3p的相对表达量采用2-△△Ct法计算。
1.3 转染miR-542-3p类似物(mimics)及阴性对照(NC)
miR-542-3p mimics及miR-542-3p NC由广州锐博生物科技有限公司合成提供。选取miR-542-3p表达最低的两株肝癌细胞MHCC-97H和HCCLM3,按照LiopfectamineTM3000试剂说明书操作,分别将miR-542-3p mimics(miR-542-3p过表达组)及miR-542-3p NC(阴性对照组)转染入MHCC-97H和HCCLM3中,均设置3个复孔。采用RT-PCR法验证转染48 h后转染效率。
1.4 对肝癌细胞增殖的检测
采用CCK-8法:将转染48 h的MHCC-97H和HCCLM3 细胞常规消化,PBS洗细胞两遍,培养基重悬细胞,调整细胞密度,以3×103个每孔细胞接种于96孔板中,设置3个复孔,每组分别设24 h、48 h及72 h检测时间点;检测前每孔分别加入CCK-8 试剂10 μL,避光37 ℃孵育2 h,轻轻振荡,保证每孔无气泡,放置于酶标仪上,450 nm波长处测定光密度(OD)值,观察miR-542-3p对肝癌细胞增殖的影响。
1.5 肝癌细胞侵袭及转移的检测
Transwell小室侵袭及转移实验:将转染48 h的MHCC-97H和HCCLM3细胞常规消化,PBS洗细胞两遍,用无血清的培养基制成单细胞悬液,按1×108/mL的细胞密度,分别加200 μL细胞悬液至无matrigel胶和已经铺好matrigel胶Transwell上室中,下室加入含12%血清的培养液700 μL,每个转染后的细胞均设置3 个复孔,常规37 ℃孵育24 h,取出上室,棉球拭去上室未侵袭的细胞,4%多聚甲醛固定20 min后,1%结晶紫染色20 min,PBS清洗干净后进行风干。显微镜观察细胞的侵袭转移情况,随机选取3个视野,拍照计数。
1.6 肝癌细胞上皮间质转化(EMT)的检测
Western blotting实验:取转染48 h的MHCC-97H和HCCLM3细胞,用RIPA蛋白裂解液裂解细胞,取2 μL蛋白样品用于BCA法测蛋白浓度,按50 μg上样量计算得出上样体积;采用聚丙烯酰胺凝胶电泳进行实验;敷孵育一抗β-Actin(1:5 000),E-cadherin、Vimentin、N-cadherin、Snail1(均为1:1 000)4 ℃摇床过夜;室温敷育二抗2 h后用ECL化学发光试剂曝光,用ImageJ 1.42软件进行灰度分析。
免疫荧光实验:取转染48 h的MHCC-97H和HCCLM3细胞,进行细胞爬片,于37 ℃二氧化碳培养箱中培养24 h后进行细胞固定,0.1% Triton X-100细胞透化处理,M-缓冲液洗涤细胞3 次,去除非特异蛋白,1% BSA(牛血清白蛋白,PBS新鲜配制)封闭液细胞封闭1 h,移去封闭液,在爬片上滴加大约20 μL稀释好的一抗,4 ℃冰箱中过夜进行一抗染色,对应一抗的的种属在相应的爬片上滴加大约20 μL稀释好的二抗,置于湿盒中,在37 ℃培养箱中温育反应2 h进行二抗染色,滴加大约10 μL的DAPI于玻片上进行细胞核染色,室温孵育10 min,PBS洗涤细胞两次,每次5 min。最后将染色处理完毕的玻片盖在封片剂上,置暗盒里待其风干。取制备好的玻片于共聚焦激光显微镜下观察并拍照。
1.7 统计学分析
采用SPSS 22.0对实验数据进行处理与分析,所得结果用(±s)表示。两组之间比较采用配对t检验;多组之间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-542-3p在肝癌组织及肝癌细胞系中的表达
miR-542-3p在肝癌组织(n=40)和癌旁组织(n=40)的表达量[(0.208±0.064)vs(0.746±0.093)]有统计学差异,肝癌组织表达明显低于其癌旁组织(P<0.05,图1A)。miR-542-3p在人肝癌细胞系SMMC-7721、HCCLM3、MHCC-97L、Huh7、Hep3B、MHCC-97H表达量分别为(0.688±0.049)、(0.221±0.034)、(0.473±0.041)、(0.561±0.029)、(0.764±0.059)、(0.162±0.031),均显著低于其在人正常肝细胞LO2中的表达量,差异具有统计学意义(P<0.05,图1B)。
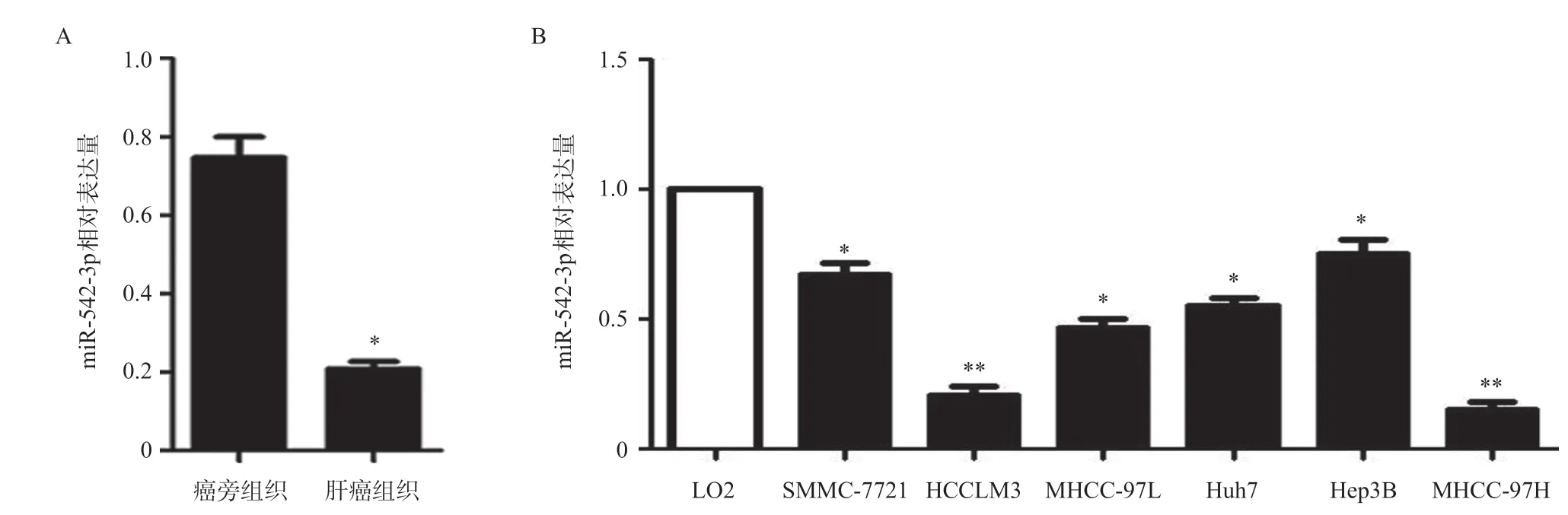
图1 miR-542-3p在肝癌组织中的表达水平(A)及肝癌细胞系中的表达水平(B)
2.2 转染miR-542-3p mimics效果
RT-PCR检测结果显示,miR-542-3p在转染miR-542-3p mimics与阴性对照HCCLM3[(1.054±0.156)vs(0.510±0.059)]和MHCC-97H[(1.193±0.244)vs(0.323±0.081)]中的表达量具有统计学差异(图2),这提示过表达miR-542-3p在HCCLM3 和MHCC-97H细胞中转染有效。
2.3 miR-542-3p对肝癌细胞增殖的影响
CCK-8 法检测结果表明,miR-542-3p过表达HCCLM3和MHCC-97H细胞的吸光度值低于阴性对照,差异具有统计学意义(P<0.05,图3);这提示上调miR-542-3p在肝癌细胞系中的表达可显著抑制肝癌细胞的增殖能力,且转染时间越长,抑制效果越明显。
2.4 miR-542-3p对肝癌细胞侵袭及转移能力的影响

图2 miR-542-3p过表达后在HCCLM3和MHCC-97H细胞系中的表达水平
Transwell小室侵袭转移实验,结果显示:miR-542-3p过表达组细胞穿过小室的细胞数量明显少于阴性对照组(图4)。这提示,miR-542-3p过表达可显著抑制肝癌细胞的侵袭及转移能力。
2.5 miR-542-3p对肝癌细胞上皮间质转化(EMT)的影响
Western blotting实验结果显示,在肝癌细胞系HCCLM3和MHCC-97H中,miR-542-3p过表达组Ecadherin蛋白的表达增加,Vimentin、N-cadherin和Snail1 蛋白的表达减少(图5A、B)。此结果说明过表达miR-542-3p具有抑制肝癌细胞EMT的作用。为进一步证实miR-542-3p对HCC细胞EMT的影响,我们应用免疫荧光检测过表达miR-542-3p后HCC细胞形态的变化以及EMT相关蛋白的表达变化。结果检测显示,过表达miR-542-3p后,上皮标志蛋白E-cadherin的红色荧光强度增高,而间质标志蛋白Vimentin、N-cadherin和Snail1的红色荧光强度降低(图5C),这表明过表达miR-542-3p后抑制HCC细胞EMT。
3 讨论

图3 miR-542-3p过表达组及阴性对照组在HCCLM3和MHCC-97H细胞系中的细胞增殖情况
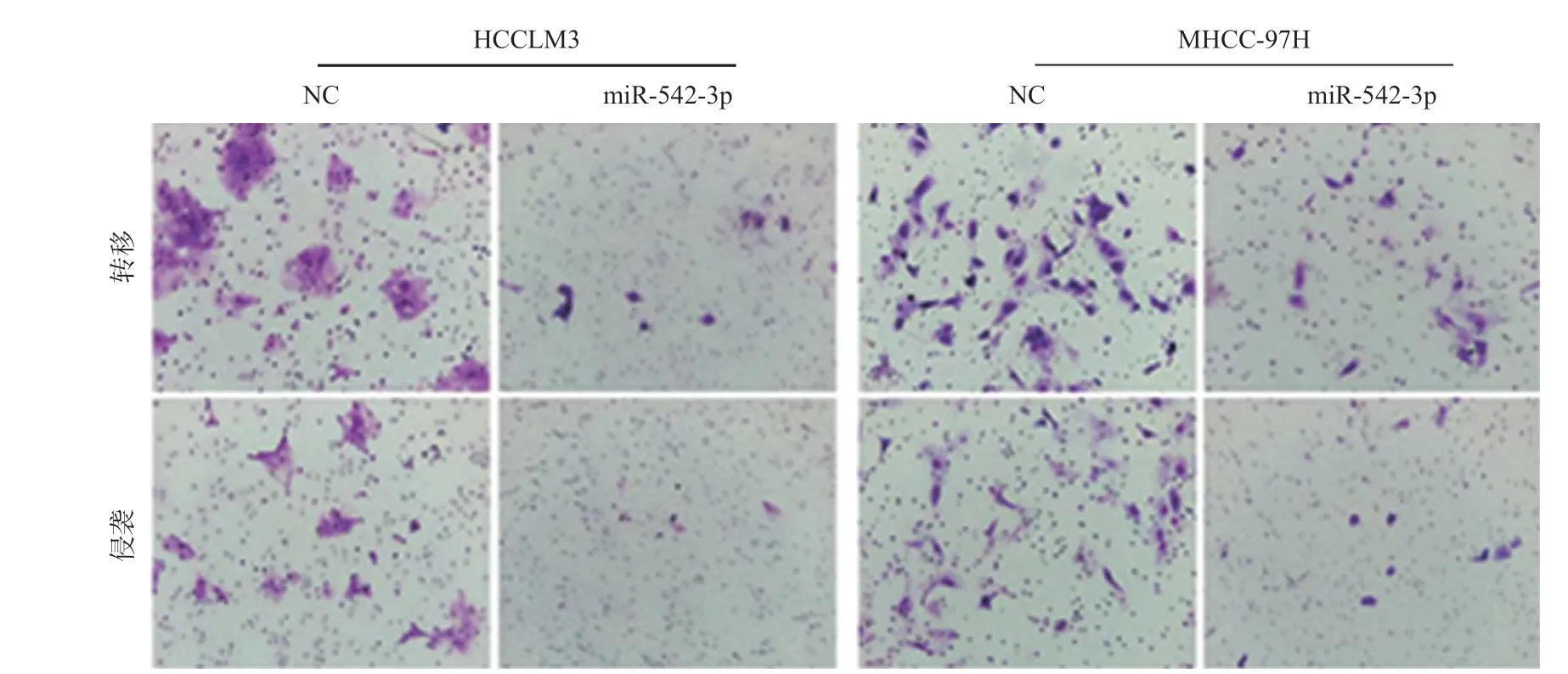
图4 过表达miR-542-3p对HCCLM3和MHCC-97H细胞侵袭转移的影响(结晶紫染色,×200)

图5 过表达miRNA-542-3p对EMT相关蛋白的影响
近年来肝癌发病率和病死率呈总体上升趋势,在我国每年约有38万人死于肝癌,占全球肝癌死亡病例数的51%[10]。由于肝癌临床症状隐匿,且其具有生长速度快、恶性程度高、易复发转移等特点,预后较差[11],因此临床上亟需探索新的肝癌生物标志物和新的治疗策略。miRNAs已被证实在肝癌的发生发展中具有重要作用。临床研究表明,miRNA在肝癌中表达谱变化较大,可用异常表达的miRNA来辅助诊断肝癌[12];此外Sato等[13]发现异常表达的miRNA谱可用于预测肝癌术后的复发情况。
miRNA-542-3p为新发现的肿瘤抑制因子,已经被证实在多种恶性肿瘤中呈低表达,如肺癌、乳腺癌、食管癌、结直肠癌[5-8]。Zhang等[9]研究发现miRNA-542-3p在肝癌中呈低表达,起到抑癌基因的作用。同样,在本研究中我们发现在肝癌组织及细胞系中miR-542-3p明显下调。
多项研究显示,miR-542-3p可以通过作用于靶基因如生存素[14]、PIM1[15]、p53[16]以及AKT信号通路[17]等共同调节肿瘤细胞的增殖、凋亡、细胞周期等多种生理活动从而调控肿瘤的发生发展进程。Wang等[18]研究发现过表达miR-542-3p能下调存活素,抑制HCC细胞增殖及裸鼠体内HCC瘤体生长。在本研究中,我们通过CCK-8实验证实miR-542-3p具有抑制肝癌细胞增殖能力,提示miR-542-3p参与肝癌的发生发展。
局部和全身转移是导致肝癌预后不理想的关键因素。越来越多的研究证实,miRNA是癌症转移的关键调节剂,包括肝癌[19]。Takeyama等[20]通过miRNA基因芯片及qRT-PCR分析研究发现,与不伴有肝转移的结直肠癌相比,伴有肝转移的结直肠癌组织中miR-542-3p的表达水平明显较低,说明miR-542-3p对结直肠癌的肝转移有抑制作用。在本研究中,Transwell实验表明miR-542-3p具有抑制肝癌细胞侵袭和转移的能力。
上皮间质转化(EMT)在肿瘤侵袭和转移中起着重要作用[21]。在肿瘤EMT过程中,上皮标志物E-钙黏蛋白(E-cadherin)、紧密连接蛋白ZO-1(zonula occluden-l)等表达下调,间质标志物波形蛋白(Vimentin)、N型钙黏蛋白(N-cadherin)等表达上调,表现为上皮源性的肿瘤细胞失去细胞极性,细胞间的连接变得疏松,胞内骨架蛋白发生重组。这一系列的改变导致肿瘤细胞的黏附能力下降,迁移运动能力增加,使得肿瘤细胞更易于离开原有位置,发生原位浸润或者随血行、淋巴等途径转移到体内远隔部位,重新定位于新的器官或组织,最终导致肿瘤患者死亡。EMT是肝癌转移的关键过程[22],本研究中Western boltting和免疫荧光实验结果均提示,当miR-542-3p过表达时,上皮标志物E-cadherin蛋白表达增加,而间质标志物Vimentin、N-cadherin、Snail1蛋白表达减少,证明了miR-542-3p具有抑制肝癌细胞EMT的作用,结果提示miR-542-3p通过抑制EMT表型抑制肝癌侵袭转移。
综上所述,miR-542-3p可以抑制肝癌细胞的恶性生物学行为,在肝癌的发生、发展、侵袭转移等过程中发挥重要作用,且与EMT通路有关。但其作用的下游靶基因尚不完全清楚,本课题组接下来将通过重点研究miR-542-3p可能的靶基因,进一步阐明miR-542-3p在肝癌发生、发展中的分子机制及其重要性。

