卵裂期无可移植胚胎患者行囊胚培养后早期囊胚的最佳移植策略
詹少泉,刘寒艳,杜红姿,李 莉,康祥锦,李 磊
(广州医科大学附属第三医院生殖医学中心//广东省生殖医学重点实验室//广东省产科重大疾病重点实验室//广东省普通高校生殖与遗传重点实验室,广东广州 510150)
辅助生殖技术(assisted reproductive technology,ART)中卵裂胚胎的形态评分是基于胚胎发育形态的不同,在一定程度上可以预测着床率。许多研究[1-3]支持胚胎质量与获得成功着床和最终活产之间的关系。另一种有助于提高成功率的方法是囊胚培养,由于囊胚非整倍体率降低[4],囊胚移植可以改善胚胎移植结局。临床上有部分预后差的患者,在卵裂期胚胎评分没有达到可移植的标准,在后续周期中可能面临同样的无可移植胚胎问题。已有研究针对有3 个以上优质卵裂胚胎行囊胚培养后发育迟缓的患者进行分析[5],并没有对无可移植胚胎行囊胚培养后发育迟缓的患者进行分析。而且目前尚未有研究进一步分析Ⅰ期囊胚和Ⅱ期囊胚新鲜移植结局的差异。尤其是Ⅰ期囊胚,是进行鲜胚移植,还是继续延长培养进行玻璃化,并在随后的解冻周期中移植,以使胚胎和子宫内膜同步化,获得更好的妊娠结局?本研究拟回顾性比较卵裂期无可移植胚胎的患者,在第5 天新鲜移植Ⅰ期,Ⅱ期囊胚,同时与同一队列患者FET 第6 天扩张囊胚及第3 天移植Ⅱ级胚胎的患者相比,临床结局是否有差异,以评估卵裂期无可移植胚胎患者,行囊胚培养移植的安全性,早期囊胚新鲜移植的妊娠结局,以及更好的胚胎-子宫内膜同步化对妊娠结局的改善作用,从而探讨最佳的移植策略。
1 材料与方法
1.1 研究对象
我们对2014年1月至2019年12月期间卵裂期无可移植胚胎行囊胚培养,第5 天移植的178 个移植周期(GardnerⅠ期囊胚97 个周期,Ⅱ期囊胚81个周期)进行了回顾性队列分析,并设置了两个对照组,第3天为2级胚胎的卵裂胚新鲜移植周期(对照组1,n=754),卵裂期无可移植胚胎行囊胚培养,第6 天冷冻囊胚的FET 周期(对照组2,n=144),并将对照组与研究组进行基线匹配。研究组和对照组均为单囊胚或单胚胎移植周期。纳入标准如下:卵巢刺激开始时母亲年龄<44岁,选择性新鲜或解冻周期单胚胎移植。排除标准如下:PGT;二次冷冻;辅助孵化。同一组中每名患者只纳入一次统计。该研究征得患者知情同意并获得医院伦理委员会的批准。
1.2 方 法
1.2.1 卵巢刺激和胚胎培养移植 使用以下三种方案之一进行卵巢刺激:GnRH 激动剂方案,GnRH拮抗剂方案或非常规方案。当至少两个卵泡直径>17 mm 时,用4 000~10 000 U 的hCG 诱导最终的卵母细胞成熟。在hCG触发后34~36 h进行卵母细胞采集。
传统的体外受精(in vitro fertilization,IVF)或卵胞浆内单精子注射(intracytoplasmic sperm injec⁃tion,ICSI)根据是否存在男性因素而进行。胚胎在覆盖矿物油(ovoil,vitrolife)的G1 Plus 培养基(vitrolife)的25 μL 液滴中单独培养,并在37 ℃和体积分数6% CO2的培养箱中孵育。第3 天的一些胚胎随后在G2 Plus 培养基(vitrolife)中,使用三气培养箱(体积分数5% O2/6% CO2/89% N2)培养至第5/6 天。受精在授精/注射后16~18 h 进行评估,并在第2、3、5 和6 天进行胚胎质量评估。
第3 天可移植胚胎评分标准为:5~12 个细胞,≤20%碎片,卵裂球大小均一或不完全均等大小,<50%空泡,<50%多核。不符合上述标准的胚胎被定义为不可移植胚胎。1 级胚胎评分标准为:7~9 细胞,≤20%碎片,卵裂球大小均一;其他可移植胚胎为2级胚胎。以上所研究的胚胎在第1天均为正常受精胚胎。
在囊胚阶段,根据Gardner 分类法在第5 天和第6 天评估胚胎质量,该分类考虑了扩张等级以及内细胞团(ICM)和外滋养层(TE)的发育情况[6]。Ⅰ期囊胚为囊胚腔体积<50%,未扩张;Ⅱ期囊胚为囊胚腔体积≥50%,未扩张;囊胚在3~6 级扩张、ICM 和TE 的发育至少达到一个B 级或以上时冷冻。
根据临床方案,在第3 天或第5 天下午进行新鲜移植。在囊胚培养中没有3 级以上囊胚的情况下,移植具有最佳质量的胚胎并将其他胚胎培养至第6 天。在第6 天达到冷冻标准行玻璃化冷冻,丢弃所有其他胚胎。
新鲜移植后的黄体期支持根据方案不同而定,拮抗剂方案或微刺激方案由戊酸雌二醇(6 mg/d)和微粒化黄体酮(300 mg/d)组成,激动剂方案仅需微粒化黄体酮(300 mg/d),均在卵母细胞取出当天开始并持续至妊娠8~10周。
1.2.2 FET 内膜准备、囊胚玻璃化冷冻和复苏 根据月经和排卵情况,准备冷冻胚胎移植的患者采用自然周期或人工周期。在人工周期中,在月经第2天和第3 天开始每天口服戊酸雌二醇(6 mg),持续11 d,在合适的条件下(如子宫内膜厚度≥8 mm,孕酮<4.5 nmol/L),在黄体酮转化的第6天进行胚胎移植。如果未达到该厚度,则视情况调整戊酸雌二醇的剂量。如果子宫内膜厚度仍不足或孕酮水平高于4.5 nmol/L,则取消胚胎移植。黄体支持持续到妊娠8~10周。
囊胚玻璃化冷冻和复苏具体见之前已发表的文献[7],采用商品化试剂盒,在玻璃化冷冻之前,先进行激光人工囊胚皱缩,冷冻过程在37 ℃下,ES液中2 min,VS中45~60 s。然后用最小体积的玻璃化溶液将囊胚装载到冷冻载体Cryotop 顶端,并立即在-196 ℃下浸入液氮中。复苏时,迅速将Cryotop顶端置于37 ℃的TS中1 min,然后在室温下依次将胚胎转入DS、WS1、WS2中各3 min。最后将存活的囊胚移入平衡过的培养液中,置于37 ℃、6%CO2的培养箱中培养等待移植。培养2~4 h后在超声引导下进行宫内移植。
1.2.3 临床结局 主要结果是活产率(LBR),即胚胎移植后在妊娠≥28 周时产下一个存活的婴儿。次要结果包括临床妊娠率(CPR)、早期流产率(EMR)、持续妊娠率(OPR)和新生儿情况。临床妊娠率是通过超声记录至少一个胎儿在妊娠6~7 周时有心跳来确定的。EMR 定义为妊娠12周前的宫内妊娠丢失。OPR 定义为12 周后怀孕。新生儿情况包括:平均孕周,胎儿体质量,身高。
1.3 统计学分析
采用SPSS 19.0 统计软件进行数据分析,符合正态分布的计量资料用均数±标准差(±s)表示,不符合正态分布的计量资料用中位数和四分位数描述,即M(P25~P75)。对于正态或非正态分布资料分别采用两独立样本t检验或Mann-Whitney’sU检验,计数资料用率(%)表示,采用χ2检验或Fisher 精确概率法。P<0.05 认为差异有统计学意义。
2 结果
与新鲜周期2 级卵裂胚胎移植组(对照组1)相比,第5 天的Ⅰ期和Ⅱ期囊胚移植组的获卵数均显著高于对照组1(P<0.05),其余指标包括获卵年龄,不孕年限,抗缪勒氏管激素(anti-Mullerian hormone,AMH),体质量指数(body mass index,BMI),原发不孕比例,不孕原因,卵巢刺激方案,HCG 日内膜厚度,授精方式差异均没有统计学意义(表1)。
新鲜周期第5 天的Ⅰ期和Ⅱ期囊胚移植组与新鲜周期2级卵裂胚胎移植组(对照组1)结局的比较。活产率Ⅰ期囊胚移植组显著低于2 级卵裂胚胎移植组(对照组1;7.22%vs.18.83%,P<0.01),临床妊娠率(11.34%vs.25.33%,P<0.01)和继续妊娠率(7.22%vs.19.89%,P<0.01)Ⅰ期囊胚移植组也显著低于对照组1,早期流产率和新生儿情况(出生孕周,身高,体质量)两组差异没有统计学意义(P>0.05,表2)。Ⅱ期囊胚移植组与对照组1 相比,活产率,临床妊娠率,早期流产率,继续妊娠率以及新生儿情况两组差异均没有统计学意义(P>0.05;表2)。
表1 与新鲜周期2级卵裂胚胎移植相比,Ⅰ期和Ⅱ期囊胚移植的基础参数Table 1 Analysis of the basic and treatment characters of Stage I and Stage Ⅱblastocyst transfer compared with grade 2 cleavage embryo transfer in fresh cycles [(±s),M(P25~P75),n(%)]
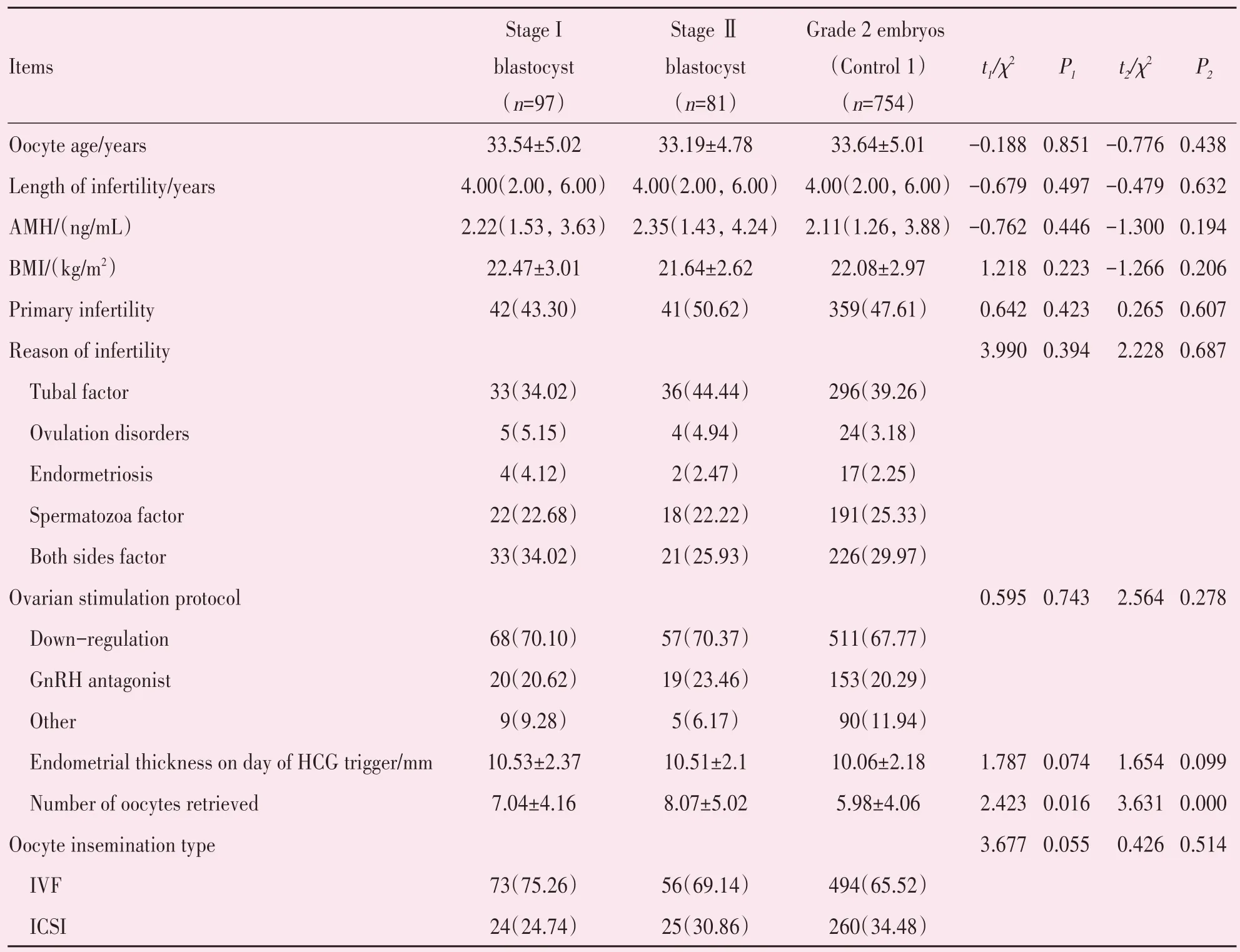
表1 与新鲜周期2级卵裂胚胎移植相比,Ⅰ期和Ⅱ期囊胚移植的基础参数Table 1 Analysis of the basic and treatment characters of Stage I and Stage Ⅱblastocyst transfer compared with grade 2 cleavage embryo transfer in fresh cycles [(±s),M(P25~P75),n(%)]
P1:Stage I blastocys vs. grade 2 embryos(Control 1);P2:Stage Ⅱblastocys vs.grade 2 embryos(Control 1);AMH:anti-Mullerian hormone;BMI:body mass index;IVF:in vitro fertilization;ICSI:intracytoplasmic sperm injection
与来源于第3 天无可移植胚胎,行囊胚培养后的第6 天冷冻囊胚移植组(对照组2)相比,新鲜周期第5 天的Ⅰ期和Ⅱ期囊胚新鲜移植组AMH 均显著低于对照组2(P<0.05),其余指标如获卵年龄,不孕年限,BMI,原发不孕比例,不孕原因,卵巢刺激方案,HCG 日内膜厚度,授精方式两组差异均没有统计学意义(表3)。
新鲜周期第5 天的Ⅰ期和Ⅱ期囊胚移植组与第6天冷冻囊胚移植组(对照组2)结局的比较。活产率I期囊胚移植组显著低于第6 天冷冻囊胚移植组(对照组2;7.22%vs.15.97%,P<0.05),临床妊娠率(11.34%vs.24.31%;P<0.05)和继续妊娠率(7.22%vs.15.97%;P<0.05)I 期囊胚移植组也显著低于对照组2,早期流产率和新生儿情况(出生孕周,身高,体质量)两组差异均没有统计学意义(P>0.05;表2)。Ⅱ期囊胚移植组与对照组2 相比,活产率,临床妊娠率,早期流产率,继续妊娠率以及新生儿情况两组差异均没有统计学意义(P>0.05;表4)
表2 在新鲜周期、Ⅰ期和Ⅱ期囊胚移植与2级卵裂胚胎移植的结果比较Table 2 In the fresh cycles,the outcomes of Stage I and Stage Ⅱblastocyst transfer compared with grade 2 cleavage embryo transfer [(±s),n(%)]
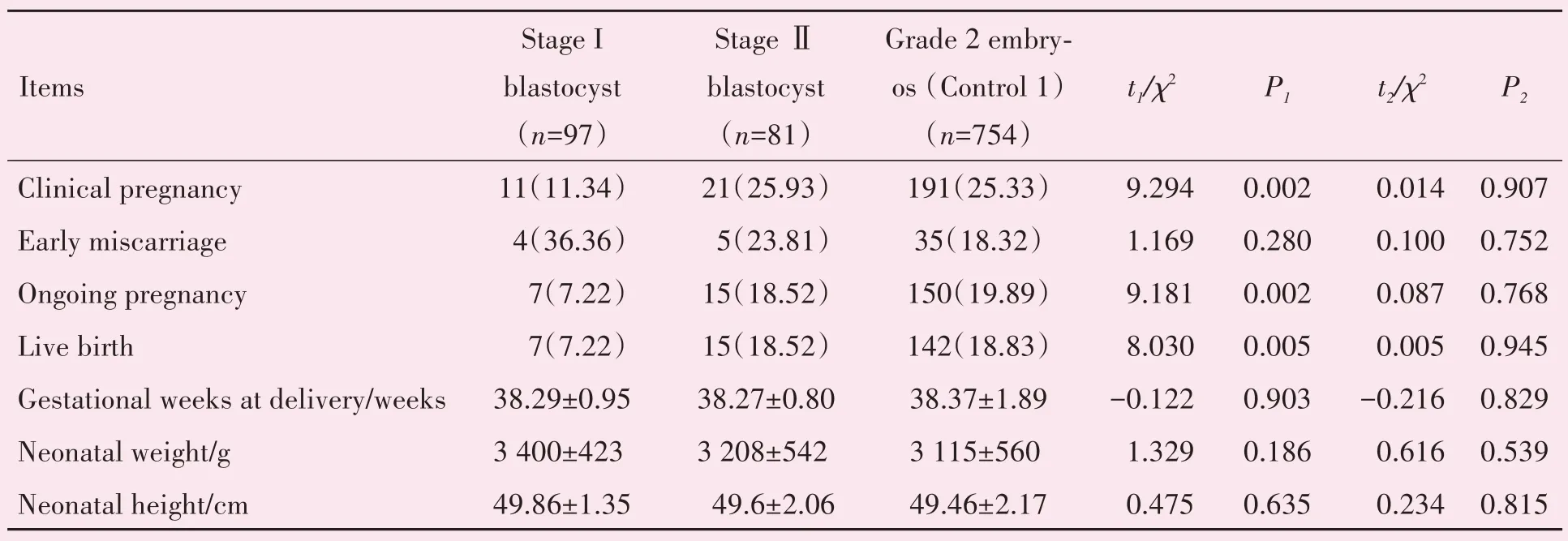
表2 在新鲜周期、Ⅰ期和Ⅱ期囊胚移植与2级卵裂胚胎移植的结果比较Table 2 In the fresh cycles,the outcomes of Stage I and Stage Ⅱblastocyst transfer compared with grade 2 cleavage embryo transfer [(±s),n(%)]
P1:Stage I blastocys vs.grade 2 embryos(Control 1);P2:Stage Ⅱblastocys vs.grade 2 embryos(Control 1)
表3 与第6天冷冻囊胚移植组相比,Ⅰ期和Ⅱ期囊胚新鲜移植的基础参数Table 3 Analysis of the basic and treatment characters of fresh Stage I and Stage Ⅱblastocyst transfer compared with D6 vitrified blastocyst transfer [(±s),M(P25~P75)]
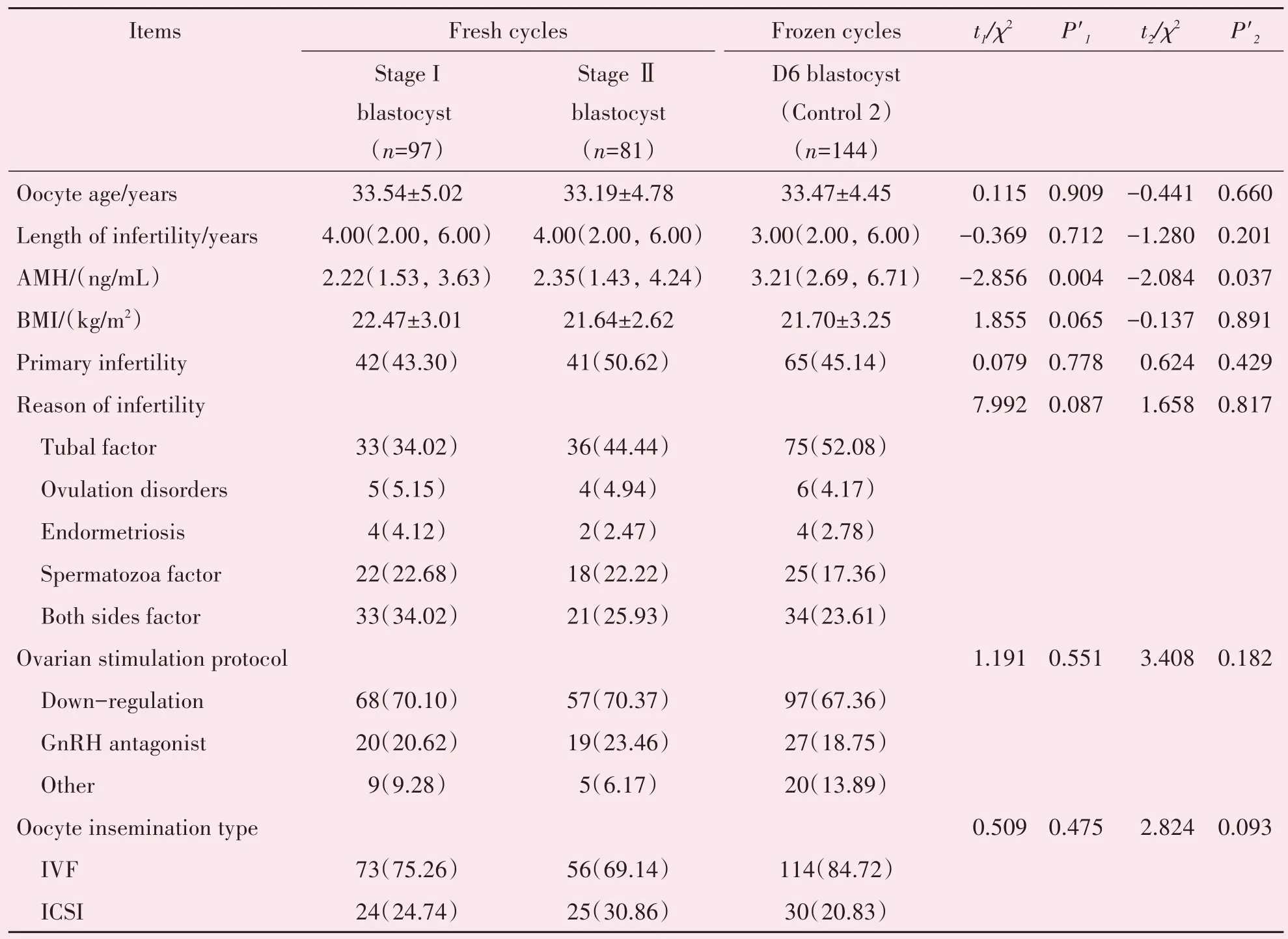
表3 与第6天冷冻囊胚移植组相比,Ⅰ期和Ⅱ期囊胚新鲜移植的基础参数Table 3 Analysis of the basic and treatment characters of fresh Stage I and Stage Ⅱblastocyst transfer compared with D6 vitrified blastocyst transfer [(±s),M(P25~P75)]
P'1:Stage I blastocys vs.D6 blastocyst in FET cycles(Control 2);P'2:Stage Ⅱblastocys vs.D6 blastocyst in FET cycles(Control 2);AMH:anti-Mullerian hormone;BMI:body mass index;IVF:in vitro fertilization;ICSI:intracytoplasmic sperm in⁃jection
表4 新鲜周期Ⅰ期和Ⅱ期囊胚移植与第6天冷冻囊胚移植的结果比较Table 4 Outcomes of fresh Stage I and Stage Ⅱblastocyst transfer compared with D6 vitrified blastocyst transfer [(±s),n(%)]
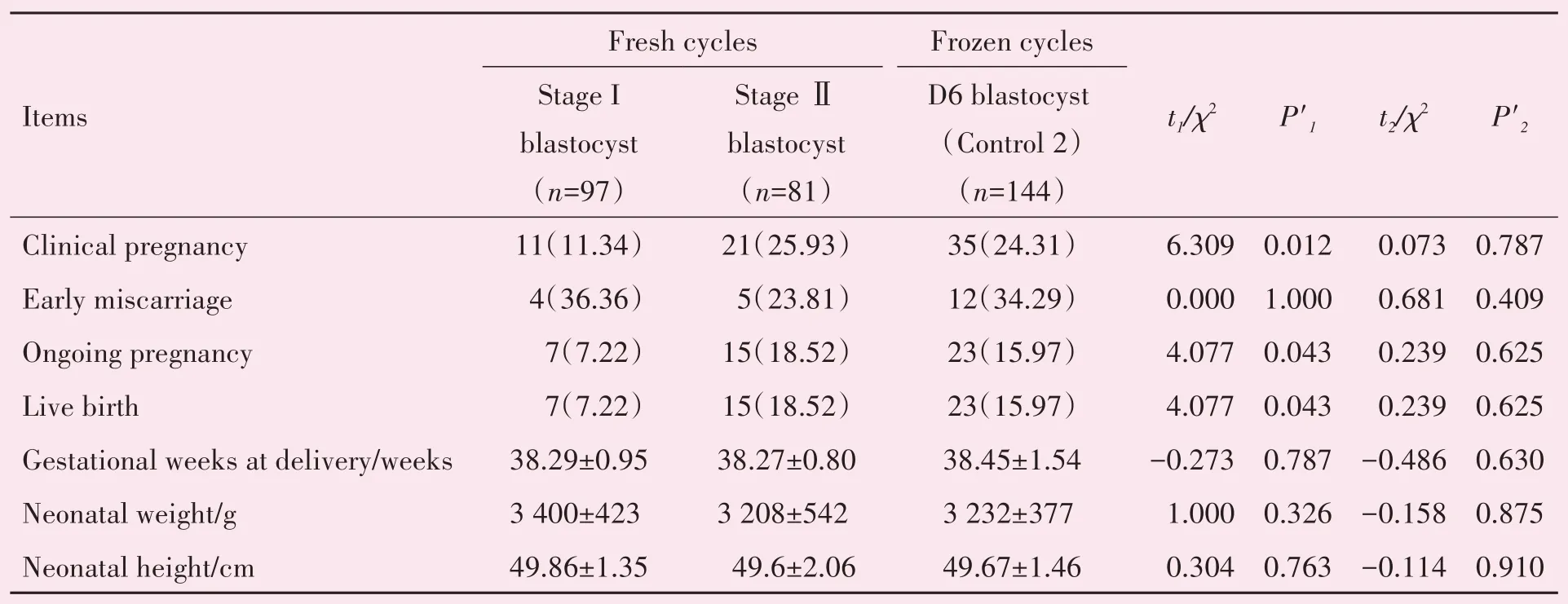
表4 新鲜周期Ⅰ期和Ⅱ期囊胚移植与第6天冷冻囊胚移植的结果比较Table 4 Outcomes of fresh Stage I and Stage Ⅱblastocyst transfer compared with D6 vitrified blastocyst transfer [(±s),n(%)]
P'1:Stage I blastocys vs.D6 blastocyst in FET cycles(Control 2);P'2:Stage Ⅱblastocys vs.D6 blastocyst in FET cycles(Control 2)
3 讨论
鉴定具有植入能力并能健康怀孕的胚胎(囊胚)是IVF 的关键部分,需要更多信息来确定在新鲜胚胎移植中应移植哪些胚胎,应进行玻璃化或应丢弃哪些胚胎。
在本研究中,我们的目的是确定卵裂期无可移植胚胎的患者,是否通过囊胚培养能获得较好的临床结局,将胚胎培养延长至第6 天来推迟发育迟缓的囊胚的移植,并在随后的FET 周期中移植该囊胚是否可以产生更好的妊娠结局。包括的胚胎为卵裂期不可移植胚胎,且囊胚发育缓慢,并且仅包括新鲜和FET 的单胚胎移植以避免处于不同发育阶段的胚胎一起移植。本研究结果同先前报道的结果一致,早期囊胚新鲜移植能获得与FET 第6 天扩张囊胚相似的结局[5]。但是,我们进一步分析了Ⅰ期囊胚和Ⅱ期囊胚移植的结局,并与卵裂期2 级胚胎移植进行比较,我们的结果证实了Ⅰ期囊胚可以继续延长培养,直到达到第6 天扩张囊胚,然后在随后的FET 周期中进行移植,而Ⅱ期囊胚可以行新鲜周期移植,同时我们也证实了卵裂期不可移植胚胎来源的Ⅱ期囊胚临床结局和卵裂期2 级胚胎移植结局相似,可以增加这类患者的移植率和改善妊娠结局。
Ⅰ期囊胚新鲜周期低临床妊娠率的可能原因:由于发育相对缓慢,这些胚胎中有绝大部分在第6天仍不能达到扩张囊胚,因此,胚胎-子宫内膜不同步导致新鲜周期不能成功植入。
有研究[8]表明,与第5 天囊胚相比,在第7 天达到囊胚然后FET 具有可接受的LBR(25.15%vs.46.5%,P<0.01),并且新生儿体质量,畸形发生率或新生儿死亡没有差异。因此,将胚胎培养延伸到第6 天以后,这可能是一种合适的策略,特别是在发育迟缓的情况下,可以继续培养至第6 天甚至第7 天。这可以提高适合冷冻保存的胚胎的数量并改善临床结局。
Campbell[9]发现,发育迟缓的囊胚具有更高的非整倍体风险,是否需要用PGS 检测囊胚,尤其是来源于差质量卵裂胚的囊胚,我们不推荐PGS用于那些只有低质量第3 天胚胎的患者。因为我们的结果显示,差质量卵裂胚患者的Ⅱ期囊胚可以获得与第3 天2 级卵裂胚相似的结果。一些研究[10-11]也表明PGS 并不能改善所有患者的总体预后。而且,关于PGS方法的临床和经济效益仍存在相当大的争议[12]。
我们的研究有一些局限性。首先,这项研究是回顾性设计,因此,可能会引入一些偏倚。第二,不同的差质量卵裂胚的定义会影响结果。我们的定义为第3 天<5 细胞,或>12 细胞,且满足以下的一个条件:>20%碎片,卵裂球大小严重不均等,≥50%空泡,≥50%多核。第三,我们中心70%的患者接受了双胚移植。单囊胚移植的标准为医学指征或仅有一个囊胚,限制了本研究的样本量。第四,本研究仅针对卵裂期无可移植胚胎的患者,是否可以扩展到所有行囊胚培养的患者,这需要进一步的研究。
总之,我们的研究结果表明,对于卵裂期不可移植胚胎行囊胚培养,发育迟缓的I 期囊胚继续延长培养后FET 移植,Ⅱ期囊胚新鲜移植,可导致较高的临床妊娠率和活产率。因此,胚胎-子宫内膜同步性,改良的胚胎选择过程,这两个主要因素可能起重要作用。

