针刺对帕金森抑郁模型大鼠的影响*
宋蕙杉,白妍,王顺
1.黑龙江中医药大学,黑龙江哈尔滨150040;2.黑龙江省中医药科学院,黑龙江哈尔滨150036
帕金森病(Parkinson′s disease,PD)是一种复杂的中枢神经系统退行性疾病,其病理学特征是黑质内大量多巴胺能神经元进行性缺失变性[1-2]。30%~40%的PD患者伴有以抑郁为主的非运动症状,同时抑郁可以影响运动症状,导致PD的病程加速[3]。PD伴发抑郁症状(Parkinson′s disease with depression,PDD),不仅影响患者生活质量,也给治疗增加了难度[4-5]。脑源性神经营养因子(brainderived neurotrophic factor,BDNF)是对中枢神经系统具有保护作用的神经因子,在皮层、海马区高度表达,能够防止神经元受损凋亡,参与神经细胞的生长分化,对神经元维持正常生理功能发挥重要作用。研究显示[6-8],BDNF参与PDD的发病与病理进程,BDNF的表达下调能够加速多巴胺能神经元损伤及脑组织结构改变,这是导致帕金森伴抑郁样行为的基础。目前对于针刺治疗PDD作用机制的研究较少,本文从BDNF表达方面探讨针刺对PDD的作用机制,现将研究结果报道如下。
1 材料
1.1 动物健康清洁级SD大鼠75只,雄性,8周龄,体质量200~250 g,由辽宁长生生物技术股份有限公司提供,许可证号:SCXK(辽)2018-0001,在黑龙江省中医药科学院动物实验室的动物实验房饲养,室内光暗交替时间为14 h/10 h,温度控制为22~25℃,相对湿度为50%~60%。整个实验过程按照中华人民共和国科技部颁布的《关于善待动物的指导性意见》进行操作。
1.2 药物与试剂阿扑吗啡(apomorphine,APO)(美国西格玛公司,批号:SLBB0077V);6-羟基多巴胺(美国西格玛公司,批号:MKBH3054);水合氯醛(天津市科密欧化学试剂中心,批号:20170305);盐酸氟西汀胶囊(法国Patheon France,批号:J20170022),多巴丝肼片(上海罗氏制药有限公司,批号:SH1001)。BNDF抗体(北京博奥森公司,货号:bsm-33042M);山羊抗兔IgG二抗(北京中杉金桥生物技术公司,货号:ZB-2301);DAB显色剂(北京博奥森公司,批号:6935688);大鼠BDNF ELISA试剂盒(ZIKER子科生物公司,批号:ZK-R3397)。
1.3 仪器Motic Med6.0病理图像分析系统;3000型显微摄影成像系统(美国moticam公司);脑立体定位仪(美国Stoelting公司);微量进样器(哈尔滨凯兴医用器械厂);移液器(Eppendorf公司);电热恒温箱(上海一恒公司);医用微波炉(广东格兰仕集团);全自动多功能酶标仪(美国Bio-TEK公司);高速冷冻离心机(美国BECKMAN公司);电泳仪(上海天能科技公司);RM2135型组织切片机(德国莱卡公司);722型可见分光光度计(上海光学仪器厂);0.25 mm×25 mm针灸针(安迪牌,贵州安迪药械有限公司)。
2 方法
2.1 动物分组与造模75只SD大鼠随机分为正常组、假手术组、模型组、对照组、针刺组,每组15只。采用单侧纹状体双靶点注射法进行PD模型制备[9]。将大鼠麻醉后,将大鼠固定于脑立体定位仪,按照大鼠脑定位图谱向大鼠纹状体缓慢注射6-羟基多巴胺,于术后6周,对大鼠进行APO背部皮下注射,5 min后记录大鼠旋转圈数,恒定转向左侧且平均转速≥6 r·min-1为阳性,作为合格PD的模型。继续采用慢性不可预见性温和性应激法制备PD伴发抑郁模型[10],每天随机安排1种应激且同种应激不连续出现,以免大鼠产生疲劳反应,应激包括:50℃高温环境5 min;夹尾1 min;4℃冰水游泳5 min;电压50 mV电击10 s;束缚4 h;昼夜颠倒12 h;接触陌生物体(如塑料杯、木勺等);噪音(60 Hz)12 h,潮湿垫料;断水24 h。连续21 d后进行行为学观察。造模结果发现模型组有11只大鼠造模成功,针刺组有12只大鼠造模成功,对照组有12只大鼠造模成功。假手术组:与模型组相同的注射方法及部位,注入同样剂量的含0.2%维生素C的生理盐水。正常组:正常饲养,不造模。针刺组:参照《实验动物针灸穴位图谱》,选取“百会透太阳”“中脘”,常规消毒,其中“百会透太阳”是使用无菌毫针刺入“百会”,向单侧“太阳”方向沿皮斜刺2~3 mm,两侧“太阳”交替使用;“中脘”采用直刺,穿透大鼠皮肤约3~5 mm,进针后平补平泻,以每分钟60次频率进行捻转,每间隔5 min捻转30 s,留针20 min。对照组:按氟西汀(6 mg·kg-1)+多巴丝肼片(6 mg·kg-1)的剂量给大鼠灌胃。每日上午9时给药,每周称体质量调整药量。正常组、模型组及假手术组每日相同时间与针刺组同样的方法抓取、固定,并予2 mL生理盐水灌胃。以上各组操作均每日1次,连续28 d。
2.2 观察指标与检测方法
2.2.1 体质量增长率变化分别测量各组大鼠体质量,计算大鼠体质量变化率。
体质量变化率=(给药后体质量-初始体质量)/初始体质量×100%
2.2.2 APO诱导的行为学变化于造模后6周,对大鼠进行APO背部皮下注射,5 min后大鼠开始出现以左后肢为支点向左侧旋转,身体侧屈成环,记录大鼠旋转圈数。
2.2.3 蔗糖溶液偏好实验将饲养笼两侧放置容量为500 mL的饮水瓶,两个饮水瓶在实验前24 h都装满1%蔗糖溶液。大鼠适应蔗糖溶液24 h后进行实验,两个饮水瓶分别装满1%蔗糖溶液和自来水,进行称重后随机放入饲养笼两侧。1 h后称量瓶中自来水和蔗糖溶液剩余量,每个瓶子的质量差为大鼠的摄入量。蔗糖溶液偏好率为消耗的蔗糖溶液相对于总液体消耗的百分比[11]。
蔗糖溶液偏好率=[蔗糖溶液摄入量/(蔗糖溶液摄入量+自来水摄入量)]×100%
摄入量=初始量-剩余量
2.2.4 旷场实验旷场反应箱为80 cm×80 cm×40 cm的木质敞箱,底面均匀划分为16个小正方形,保持测试环境安静、黑暗,把每只大鼠轻轻放置于网格的中央位置,允许其在箱内自由探索活动,观察并记录大鼠5 min内的活动情况,包括水平爬行格数、垂直站立次数。水平爬行格数是计算大鼠身体的一半以上从一个正方形移动到另一个正方形的格数,垂直站立次数为大鼠站立姿势的次数[12]。
2.2.5 ELISA法检测血清中BDNF的水平腹主动脉采血5 mL,将血液标本置于4℃冰箱静置2~3 h,离心半径8 cm,3000 r·min-1,离心15 min,取上清液存于-20℃冰箱,采用ELISA法进行血清BDNF水平的测定。将样品进行稀释,样品加于酶标板孔,混匀,封板后置37℃温育30 min,弃去液体,甩干,每孔加满洗涤液,静置30 min后弃去,重复5次;每孔加入酶标试剂,温育30 min,洗涤,显色,加终止液终止反应后进行测定。
2.2.6 脑组织HE染色大鼠以10%水合氯醛麻醉后,经左心室依次灌注生理盐水和4%多聚甲醛的溶液,至大鼠全身变硬后,断头取脑放入4%多聚甲醛液中,置于4℃冰箱内固定24 h后,进行脱水,石蜡包埋,制备组织切片。将切片放入烤箱溶蜡0.5 h后再放入二甲苯Ⅰ、Ⅱ溶液中各10 min,放入100%、95%、80%、70%梯度乙醇,流水冲洗10 min 2次;苏木素染色5 min,流水冲洗10 min;盐酸酒精分化1次,流水冲洗15 min;伊红染色2 min,流水冲洗10 min;95%乙醇、100%乙醇Ⅲ各10 min;二甲苯Ⅰ、Ⅱ溶液各10 min;中性树胶封片,显微镜下观察。
2.2.7 免疫组织化学法检测大鼠脑组织BDNF的表达切片常规脱蜡,于过氧化氢液中孵育10 min,PBS冲洗3次,每次2 min。将切片泡入枸椽酸盐缓冲液中,放置在微波炉中烘烤2次,每次5 min,自然冷却至室温。滴加一抗,于4℃冰箱内24 h,PBS冲洗3次,每次2 min;滴加二抗,于37℃恒温箱中孵育30 min,PBS冲洗3次,每次2 min;DAB显色10 min后充分冲洗干净,苏木素复染1 min;常规脱水封片后,于显微镜下观察。采用Motic Med 6.0病理图像分析系统,在100倍视野下,随机观察每组图像并进行计数。进入图像分析系统,选择免疫组织化学法分析模块,通过灰度调节来区分视野内阳性信号面积,进行分析后计算阳性细胞总数,取其平均值。
2.3 统计学方法采用SPSS 20.0软件进行单因素方差数据分析,数据以均数±标准差(±s)表示,组间数据比较采用单因素方差分析,采用LSD检验进行组间两两比较,以P<0.05为差异具有统计学意义。
3 结果
3.1 各组大鼠体质量增长率变化与正常组比较,假手术组大鼠体质量增长率变化不明显(P>0.05),模型组大鼠体质量增长率显著减慢(P<0.01);与模型组大鼠相比,针刺组、对照组大鼠体质量增长率均显著加快(P<0.01)。见表1。
表1 各组大鼠体质量增加百分率比较 (±s)
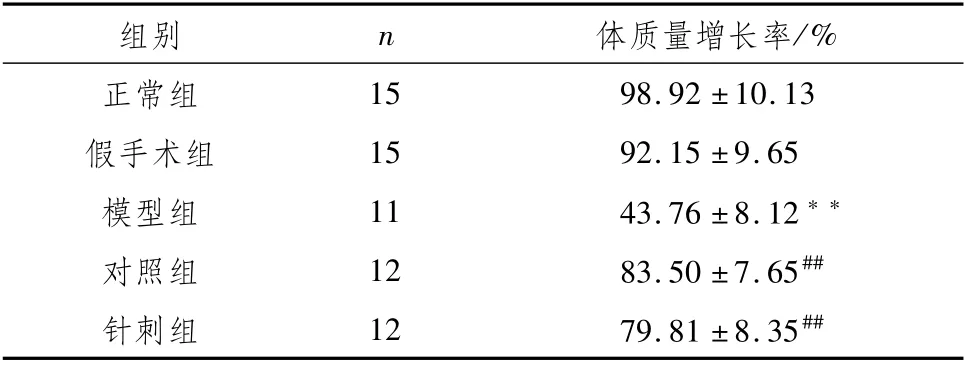
表1 各组大鼠体质量增加百分率比较 (±s)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01
/%正常组组别n体质量增长率15 98.92±10.13假手术组15 92.15±9.65模型组11 43.76±8.12**对照组12 83.50±7.65##针刺组12 79.81±8.35##
3.2 各组大鼠APO诱导的行为学变化造模后,有35只PDD模型大鼠出现恒定转向左侧且平均转速≥6 r·min-1,正常组和假手术组以相同方式注射APO后未出现旋转行为;与模型组比较,对照组和针刺组大鼠旋转圈数明显减少(P<0.05)。见表2。
表2 各组大鼠APO诱导行为学比较 (±s)

表2 各组大鼠APO诱导行为学比较 (±s)
注:与模型组比较,#P<0.05
-1组别n旋转圈数/r·min 15 0假手术组15 0模型组11 10.76±3.12对照组12 6.02±2.35#针刺组12 6.31±3.43正常组#
3.3 各组大鼠蔗糖溶液偏好率与正常组相比,模型组大鼠蔗糖溶液偏好率明显降低(P<0.05),假手术组大鼠蔗糖深液偏好率无明显变化;与模型组相比,对照组和针刺组大鼠蔗糖溶液偏好率均明显增加(P<0.05)。见表3。
表3 各组大鼠蔗糖溶液偏好率比较(±s)

表3 各组大鼠蔗糖溶液偏好率比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05
/%正常组组别n蔗糖溶液偏好率15 70.25±3.18假手术组15 69.30±8.65模型组11 49.76±7.12**对照组12 59.50±5.65#针刺组12 60.31±6.35#
3.4 各组大鼠旷场实验与正常组相比,假手术组的水平距离、垂直运动次数均无明显差异,模型组大鼠水平距离、垂直运动次数均显著减少(P<0.01);与模型组相比,对照组和针刺组大鼠的水平距离有显著增加(P<0.01),对照组和针刺组的垂直得分明显增加(P<0.05)。见表4。
表4 各组大鼠旷场实验比较(±s)
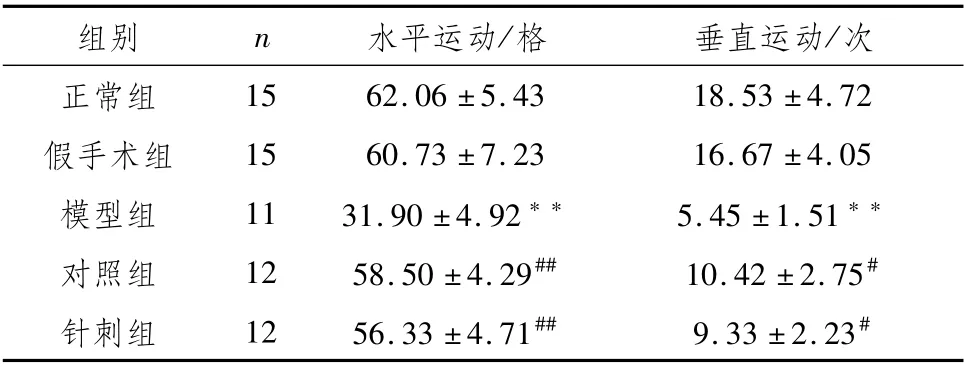
表4 各组大鼠旷场实验比较(±s)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01,#P<0.05
组别n水平运动/格垂直运动/次15 62.06±5.43 18.53±4.72假手术组15 60.73±7.23 16.67±4.05模型组11 31.90±4.92**5.45±1.51**对照组12 58.50±4.29##10.42±2.75#针刺组12 56.33±4.71##9.33±2.23正常组#
3.5 各组大鼠血清BDNF水平与正常组相比,模型组血清BDNF水平明显降低(P<0.05),假手术组无明显变化;与模型组相比,针刺组和对照组BDNF水平明显升高(P<0.05)。见表5。
表5 各组大鼠血清中BDNF水平的比较(±s)
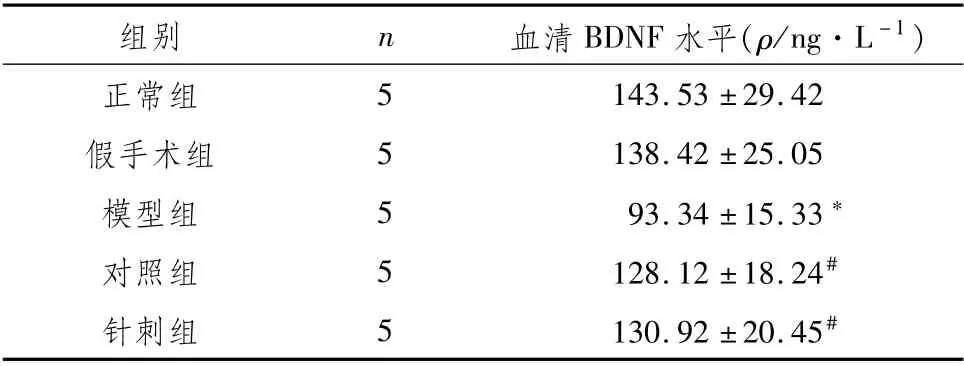
表5 各组大鼠血清中BDNF水平的比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别n血清BDNF水平(ρ/ng·L-1)5正常组143.53±29.42假手术组5 138.42±25.05模型组5 93.34±15.33*对照组5 128.12±18.24#针刺组5 130.92±20.45#
3.6 各组大鼠脑组织HE染色正常组和假手术组大鼠脑组织神经元结构形态及大小正常,核仁明显,结构清晰;模型组大鼠神经元数目明显减少,排列紊乱,形态不完整,染色较浅,部分结构溶解消失;针刺组和对照组细胞形态完整,排列较整齐,结构较清晰。见图1。
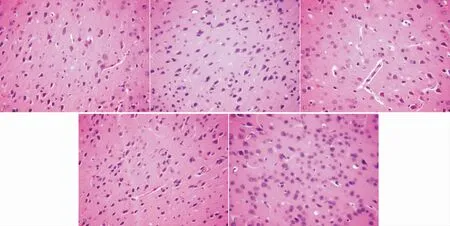
图1 各组大鼠脑组织HE染色的比较(×100)
3.7 各组大鼠脑组织BDNF表达正常组大鼠的BDNF阳性细胞表达较强,其细胞数量多,排列相对紧密,胞浆染色较深。与正常组相比,假手术组无明显差别,模型组的阳性细胞总数明显减少(P<0.05),排列相对稀疏,胞浆着色明显变浅;与模型组相比,对照组和针刺组的阳性细胞数均有明显增加(P<0.05)。见图2,表6。
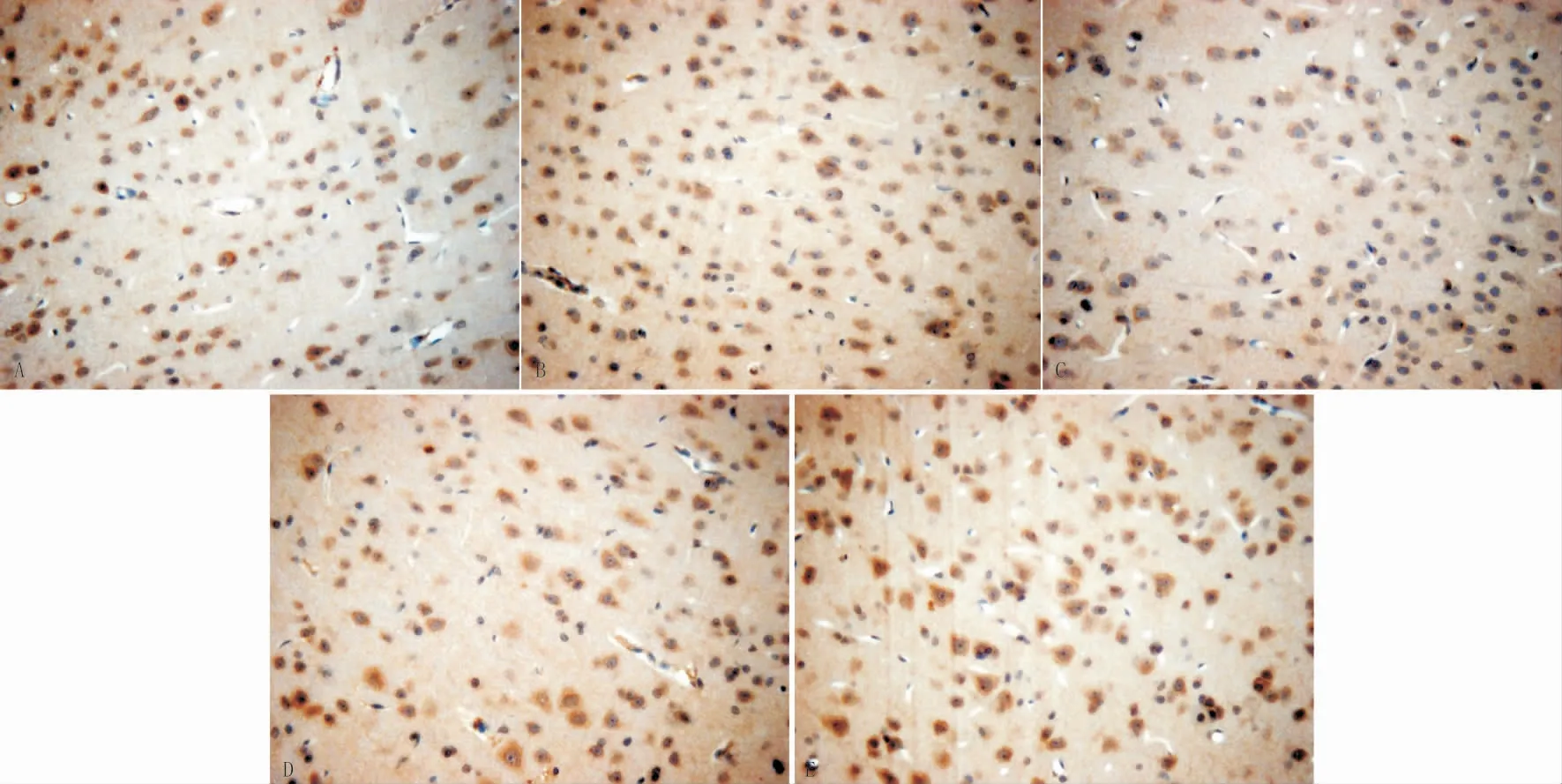
图2 各组大鼠脑组织BNDF阳性神经元的比较(×100)
表6 各组大鼠脑组织区BDNF阳性细胞数比较(±s)
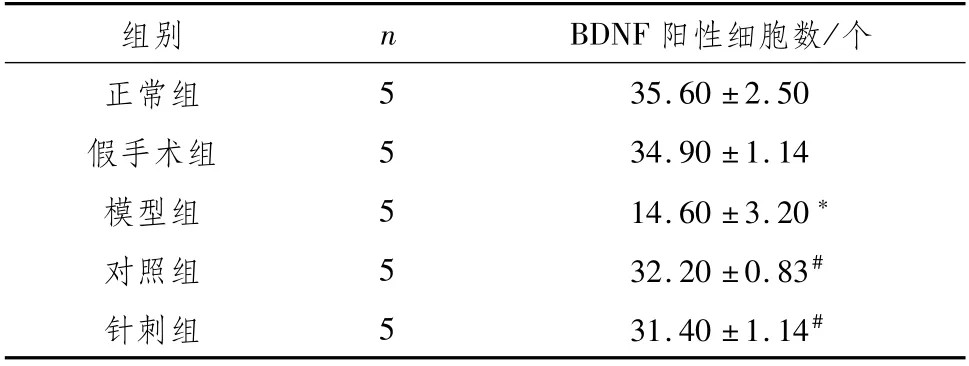
表6 各组大鼠脑组织区BDNF阳性细胞数比较(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
组别n BDNF阳性细胞数/个35.60±2.50假手术组5 34.90±1.14模型组5 14.60±3.20*对照组5 32.20±0.83#针刺组5 31.40±1.14正常组5#
4 讨论
脑源性神经营养因子是中枢及周围神经系统中的高度表达的蛋白质,在神经细胞再生、分化和可塑性中起着重要的作用[13-14]。BNDF通过与肌球蛋白相关激酶B(TrkB)受体结合导致TrkB的磷酸化,从而激活神经细胞的下游细胞内信号,维持多巴胺能神经元的完整性,避免细胞受损和凋亡[15-17]。临床研究显示,BDNF在前额皮质区及海马区高度表达,成为帕金森病、阿尔茨海默病、抑郁症和情感障碍等神经和精神疾病病理生理的关键因素[18]。BDNF能调节多巴胺能通路,发挥对多巴胺神经元抗凋亡、抗氧化的作用,促进多巴胺的释放,改善帕金森病导致的认知功能、自主神经功能障碍,对抑郁等伴随的非运动症状有良好的调节作用[19-22]。研究表明,PDD患者的血清BDNF水平显著减少,通过治疗后血清BDNF水平明显提升[13]。此外,提高血清及脑组织BDNF的水平,可以调节多巴胺能神经元的凋亡和神经兴奋性,从而改善帕金森的伴随症状[23-25]。
帕金森抑郁属中医“颤证”合并“郁证”范畴。“颤证”由肝肾阴虚,筋脉失养所致,病位在脑,脑为神明所聚,是意识思维的基础[26]。患者久病不愈,气机不畅,肝气郁结,而引发“郁证”[27]。针刺选取“百会透太阳”“中脘”,具有醒脑开窍,调神畅情之效。《千金要方》记载:“头者,人神所注……皆上归头。”百会属于督脉,联系脑络,与脑关系密切,可治疗各种神经系统疾病。百会透太阳区域连接正营、悬厘,横贯督脉、膀胱经、胆经三经,穿越顶、额、颞三叶区,一穴透多穴、多经、多区,具开窍熄风、调畅气机之功效,对帕金森病导致的抑郁症状具有良好的调节作用[28]。研究发现,针刺百会能够提高抑郁大鼠脑内的内啡肽含量,通过参与体内的应激反应来调节大鼠的抑郁样行为[29-30]。中脘属于任脉,为胃之募穴,主治消化系统疾病,针刺中脘可以促进胃肠道的消化吸收,使脾胃运化功能恢复正常。实验发现,中脘穴可以对大脑皮层网络起到调控作用,刺激内啡肽的释放[31],其机制可能是针刺中脘穴作用于胃肠道,通过脑肠轴进行信息传递达到作用目的,对帕金森抑郁的治疗具有重要意义。
本实验中PDD模型是在PD模型成功的基础上采用慢性不可预见性温和性应激法制备。PD模型的制备目前主要有6-羟基多巴胺双靶点注射法、MPTP注射法以及转基因技术等,其中6-羟基多巴胺很容易被大脑认为是神经递质进入神经元,从而破坏神经细胞,使PD模型大鼠的病理表现、发病进程以及行为学表现与人类相似,且操作相对简单,易成功。可采用APO诱导行为学来评估模型成功率,因此,本实验选用6-羟基多巴胺双靶点注射法制备PD模型[32]。采用慢性不可预见性温和性应激法制备伴发抑郁模型,大鼠出现精神萎靡,体质量增长明显减缓,旷场实验中的水平爬行距离和垂直运动次数较正常组明显减少,蔗糖溶液偏好率明显低于正常组,提示大鼠出现探究行为减弱,快感缺失等行为,且造模后的大鼠BDNF表达显著降低,这与临床中帕金森伴发抑郁的行为及病理表现一致。假手术组与正常组大鼠的行为学表现及BDNF表达无明显差异,说明手术操作对实验结果无影响,模型组的改变是由于6-羟基多巴胺破坏多巴胺能神经元所致。
多巴丝肼片能够对抗多巴胺能神经元凋亡、保护神经细胞,可有效改善PD患者的运动及非运动症状,且多巴丝肼片作为左旋多巴与苄丝肼的合成制剂,可减轻单一用药的不良反应。氟西汀属于选择性5-羟色胺再摄取抑制剂,可阻断5-羟色胺受体通路,恢复多巴胺水平,是抗抑郁治疗的一线用药,且具有成分安全,不良反应小,起效快,方便给药以及很少干扰其他药物作用的优势。因此,选取美多芭和氟西汀作为阳性对照药物。
本实验结果显示,与模型组相比,针刺干预后大鼠的体质量变化率、APO诱导的大鼠旋转圈数、水平运动距离、垂直站立次数及蔗糖溶液偏好率均有明显改善,免疫组化法及ELISA法检测显示脑组织及血清中BDNF表达明显升高,表明针刺能够改善PDD大鼠的行为学表现,同时提高其脑组织及血清中BDNF表达。进一步证实,针刺可能是通过提高BDNF表达水平,调节多巴胺能神经元的兴奋性,从而改善帕金森伴发抑郁的症状,为针刺治疗PDD的机制研究提供了新依据,同时为临床治疗PDD提供了新的思路和方法。

