基于全肿瘤区域MRI纹理分析鉴别肺癌脑转移瘤病理类型的研究
李瑞,葛亚琼,张明珠,郑星星,冯峰
脑转移瘤是中枢神经系统最常见的肿瘤,约9%~50%的恶性肿瘤患者会发生脑转移[1],其中以肺癌最为多见,肺癌最常见的组织学亚型为腺癌,而非腺癌诸如小细胞肺癌、鳞癌等也常发生脑转移。如果脑转移瘤的影像学特征可以帮助确定原发性恶性肿瘤或缩小鉴别诊断范围,将会对临床诊断及治疗策略的制定有所帮助。MRI是脑转移瘤最常用的诊断方法,由于常规MR图像(如位置、形状、环形增强)的典型征象评估存在很强的观察者间和观察者内差异[2],并且难以识别转移瘤病理类型[3],因此需要额外的成像和有创活检来进行更明确的诊断。近年来,影像组学弥补了上述不足。纹理分析是最常用的影像组学方法,它可以对图像像素及其排列方式的细微变化进行客观、定量测量,利用大量的特征提取与机器学习技术结合获得可靠的诊断[4],且不依赖放射科医师的主观评价,反映了肿瘤在病理和组织学水平的空间变异,包括瘤内细胞结构、血管生成、细胞外基质和坏死区域等[5]。目前,纹理分析逐渐应用于多种肿瘤的鉴别、分级及预后评估[6-8],但在脑转移中的应用较少。本研究应用纹理分析,在磁共振增强T1加权像(contrast enhanced T1-weighted images,CE-T1WI)、液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)及表观扩散系数(apparent diffusion coefficient,ADC)序列上进行肿瘤全体积异质性分析,探究肺腺癌及非腺癌脑转移瘤异质性与病理类型的关系。
材料与方法
1.临床资料
搜集2012年3月-2020年5月行常规磁共振 CE-T1WI、FLAIR及扩散加权成像(diffusion weighted imaging,DWI)检查,并经手术病理或影像随诊证实的肺癌脑转移瘤患者93例,其中腺癌53例,非腺癌40例(其中鳞癌17例、小细胞肺癌23例),男性65例,女性28例,年龄34~81岁,中位年龄64岁。入组标准:①有明确原发灶病理类型;②检查前均未接受脑部放化疗及手术治疗;③CE-T1WI、FLAIR及ADC图像无明显伪影,满足诊断要求。最终入组病灶总数127枚,其中腺癌68枚,非腺癌59枚。
2.检查方法
采用Siemens Magnetom Espree 1.5T超导型磁共振扫描仪,采用8通道标准头颈联合线圈。扫描序列及参数:横轴面T1WI(TR 218 ms,TE 4.76 ms,FOV 230 mm×208.38 mm,矩阵320×252.8,层厚5 mm),CE-T1WI采用高压注射器注射对比剂Gd-DTPA(拜尔先灵药业,广州),剂量0.2 mmol/kg,注射流率为2.0 mL/s,紧接着注射生理盐水20 mL冲管。FLAIR序列(TR/TE=7500 ms/84 ms,FOV 230 mm×201.25 mm,矩阵192×172.8,层厚5 mm),DWI(TR/TE: 3900 ms/106 ms;FOV 230 mm×230 mm;矩阵128×128;b=0,1000 s/mm2,X、Y、Z轴3 个扩散方向,层厚5.0 mm)。图像以DICOM格式导出。
3.图像处理
将常规CE-T1WI图像、FLAIR图像及b值为1000 s/mm2的ADC图像、传至免费开源软件ITK-SNAP 3.8.0(http://www.itksnap.org/),由两位具有6年MRI诊断经验医师取得一致意见后,分别在每个序列上的每个层面手动勾画整个肿瘤(包括任何囊性、坏死、出血性区域)三维兴趣区(three-dimensional region of interest,3D ROI),其中ADC图像3D ROI的勾画对照CE-T1WI及FLAIR。具体方法为:利用ITK-SNAP 3.8.0软件将ADC图与CE-T1WI及FLAIR图相同层面显示,根据FLAIR序列上病灶区域及CE-T1WI图像上病灶的强化区域在ADC图上勾画靶区,范围尽可能与CE-T1WI一致。最后,采用人工智能工具包(Artificial Intelligence Kit,A.K)(GE healthcare,version 3.2.0)自动分析提取出394个纹理特征。
4.统计学方法
采用R软件(version 3.5.1:www.R-project.org)进行统计学分析。采用Mann-WhitneyU检验比较ADC、CE-T1WI及FLAIR序列纹理特征在不同病理类型肺癌(腺癌与非腺癌)脑转移瘤之间的差异,以P<0.05为差异具有统计学意义。将这些特征进行单因素logistic回归分析,其中OR值(odds ratio)用以说明某一特征下疾病的发生率,等于1代表该特征与疾病的发生没有关联,大于1代表该特征值越大越可能发生这一疾病,反之亦然。最后将P<0.1的特征值放入多因素logstic回归模型,得到用于肺部原发肿瘤病理分型的纹理分析预测模型[9-10];P<0.05的特征被认为是独立预测因子。采用受试者操作特征(receiver operating characteristic,ROC)曲线分析其预测效能。考虑到病灶纹理分析只有训练集没有验证集,因此采用boot632法进行重采样,以7:3将队列随机分为训练组及验证组,进行100重复验证分析。

表1 鉴别肺腺癌与非腺癌脑转移瘤纹理分析预测模型所含特征
结 果
1.肺腺癌与非腺癌脑转移瘤纹理特征的差异
肺腺癌与非腺癌脑转移瘤两组间共有137个ADC纹理特征、93个CE-T1WI纹理特征、8个FLAIR纹理特征以及152个ADC/FLAIR/CE-T1WI联合组(Combined组)特征差异有统计学意义(P<0.05)。
2.构建区分腺癌与非腺癌脑转移瘤的纹理分析预测模型
首先将差异具有统计学意义的特征参数行单因素logistic回归分析,137个ADC纹理特征参数中共有77个有统计学意义(P<0.1);93个CE-T1WI纹理特征中共有56个具有统计学意义(P<0.1);8个FLAIR纹理特征中共有2个具有统计学意义(P<0.1);152个Combined组纹理特征中有7个具有统计学意义(P<0.1)。对上述有统计学意义的特征参数(ADC组、CE-T1WI组FLAIR组及Combined组)进行多元logistic回归分析(后退式),得到纹理分析预测模型,其最终包含的特征参数汇总至表1。
3.四种模型鉴别肺腺癌及非腺癌脑转移瘤的效能
ROC曲线用于评价基于ADC、CE-T1WI及FLAIR序列纹理特征的预测模型在区分肺腺癌与非腺癌脑转移瘤中的诊断效能,结果发现三种方法所得到的预测模型都有一定的鉴别能力,其曲线下面积(area under curve,AUC)分别为0.87(95%CI:0.79~0.92)、0.81(95%CI:0.73~0.88)及0.64(95%CI:0.55~0.72),联合三种序列纹理分析诊断效能最高,其AUC为0.89(95%CI:0.83~0.94),见图1。最后采用boot632的重采样方法进行100次重复验证分析,分析模型的敏感度、特异度及符合率的平均值见表2。
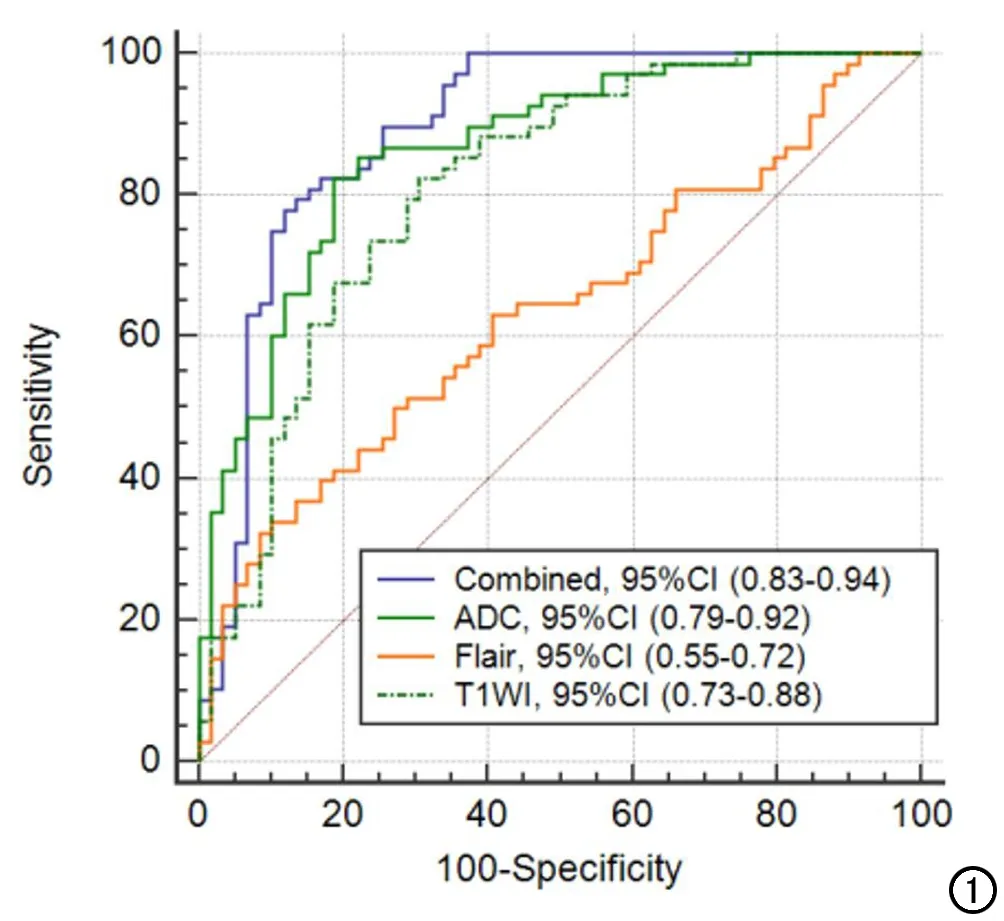
图1 ADC、CE-T1WI、FLAIR序列及联合序列(Combined)所得纹理分析预测模型鉴别肺腺癌与非腺癌脑转移瘤的ROC曲线。
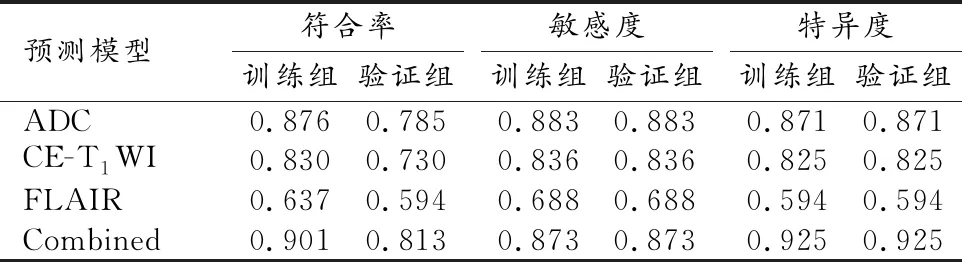
表2 boot632重采样方法进行100次重复交叉验证所得诊断效能平均值
讨 论
本研究结果显示磁共振ADC、CE-T1WI及FLAIR序列纹理分析预测模型均有助于鉴别脑转移瘤肺部原发病灶病理类型(肺腺癌与非腺癌)(AUC均>0.60),这可能与肺癌病理类型不同导致的肿瘤的生物学特征差异较大有关。肺腺癌细胞可以分泌管腔或细胞质空泡粘蛋白,具有腺泡/管状、乳头状或微乳头状分化的组织学特征,而其他肺癌病理类型则少有此特点,如小细胞肺癌肿瘤细胞形态小,呈弥漫或片状分布,细胞质稀少,边界模糊,肺鳞癌以细胞间桥或角蛋白形成为特征。以上病理特征也为本研究采用纹理分析预测模型评价肿瘤异质性鉴别脑转移瘤肺部原发病灶不同病理类型奠定了基础。
在本研究单一序列中,从ADC图像中提取的纹理特征构建的预测模型具有更高的诊断效能。DWI序列是目前唯一能够检测活体组织内水分子扩散运动的无创方法,可间接反映组织微观结构特点及其变化,相关研究表明,ADC值和肿瘤的胞质具有很好的相关性[11]。ADC图基于DWI序列图像生成,采用ADC图进行纹理分析在鉴别脑转移瘤肺部原发病灶不同病理类型中展现了较好的前景。熊飞等[12]根据ADC图的直方图特征(一阶特征)对腺癌及鳞癌脑转移瘤进行鉴别,发现ADCmin阈值为0.600×10-3mm2/s时,诊断效能最佳,AUC为0.70,诊断敏感度为64.7%,特异度为74.2%。本研究发现利用ADC图像上获取的直方图联合肿瘤高阶纹理特征对不同病理类型肺癌脑转移瘤进行鉴别时,所得结果的诊断效能更高。其原因可能是相比于一阶的直方图特征,采用直方图联合形态特征、GLCMS及GLCM高阶纹理参数表征了体素与其邻域之间的关系,反映了图像分布的均匀性和灰度特征的粒度,更能反映肿瘤的异质性,因此鉴别效能更高。就纹理参数而言,本研究全病灶纹理分析显示上述参数中的百分位数(Percentile)、相关性(Correlation)、能量(Energy)、短行程高灰度优势(Short Run High Grey Level Emphasis)及长行程高灰度优势(Long Run High Grey Level Emphasis)等参数是不同病理类型肺癌脑转移瘤之间的鉴别要点。其中百分位数、相关性及能量是一阶特征,用来描述图像区域内体素(体积元素)强度的分布,而短行程高灰度优势及长行程高灰度优势可以反映出灰度分布的空间信息。
本研究显示CE-T1WI纹理分析预测模型在鉴别脑转移瘤不同病理类型原发病灶效能尚可(AUC为0.81),可能是因为CE-T1WI可以很好的显示脑转移瘤边缘区域,且CE-T1WI图像的纹理分析主要是基于肿瘤强化程度、灌注信息导致的信号变化,因此可以反映肿瘤血供的非均质性特点[13]。Li等[14]的研究也证明了CE-T1WI纹理分析与原发性肺恶性肿瘤脑转移的病理类型有关,其诊断效能优于DWI序列纹理分析。这一研究结果与本研究ADC图纹理分析模型优于CE-T1WI有所不同,其原因可能是Li等[14]勾画病灶ROI是基于肿瘤的最大截面且避开了囊变坏死区域,而本研究考虑到肿瘤的坏死囊变是脑转移瘤发生发展过程中异质性表现之一,且可以提供丰富的肿瘤分化信息,因此采用肿瘤全体积ROI纹理分析,所得结果充分反映了脑转移瘤的异质性,也获得了比CE-T1WI更高的鉴别肺部原发病灶病理类型的诊断效能。
很多研究都是从MRI单一序列中获取组学参数来评估肿瘤细胞数量、坏死等。在本研究中,不仅使用CE-T1WI和ADC图,而且还使用了FLAIR序列。FLAIR序列反映了脑转移瘤形态学信息,CE-T1WI加权图像反映肿瘤血供情况,DWI功能成像所生成的ADC图反映肿瘤水分子扩散受限的异质性,能从多方面提供肿瘤异质性信息,辅助临床诊断与治疗[15-16]。本研究与Helge等[17]研究类似,他们在机器学习分类器中使用常规T1平扫、FLAIR及CE-T1WI颅脑MR图像的定量特征,在预测脑转移瘤的三分类和五分类原发肿瘤类型方面提供了较高的判别准确性。因此,采用多种成像序列可以提供更多的信息。本研究中CE-T1WI序列与ADC序列纹理分析模型在鉴别肺腺癌与非腺癌脑转移瘤的AUC分别为0.81和0.87,且三种序列联合诊断效能最佳,其AUC为0.89。因此,MRI多序列纹理分析预测模型有可能成为区分不同病理类型肺癌脑转移的有价值的临床工具。
本研究的局限性包括:第一,单一的机构样本数较少,易导致选择偏倚,因此所获结果的实用性和准确率尚需大样本量前瞻性研究证实;第二,由于ROI采用人工手绘,这在一定程度上导致了肿瘤靶区勾画的误差,且未做ROI组间一致性分析;第三,本研究鉴别的病理类型有限,不包括少见的肺癌病理类型脑转移。
综上所述,基于脑转移瘤的ADC、CE-T1WI及FLAIR序列纹理分析预测模型有助于鉴别肺部原发病灶病理类型(腺癌与非腺癌),且三种序列联合纹理分析分类预测模型效能最佳,有望成为鉴别肺癌脑转移瘤病理类型的一种无创方法。

