关于药品追溯的可行体系建设的研究
邵扬 马能溢

摘 要 本文着眼于形成可持续发展的药品追溯体系,通过梳理国家药品电子监管码的建设历程、当前的行业现状,分析了药品追溯体系发展过程中显现的问题,结合美国、欧盟等成功实例,在分析追溯体系相关方利益诉求的基础上,研究了建设具有可操作性、可落地性的药品追溯体系的重点要素,并提出了构想方案。
关键词 药品追溯 电子监管码 药品监管
中图分类号:R954 文献标志码:C 文章编号:1006-1533(2021)01-0050-05
Study on the establishment of a feasible system for drug traceability
SHAO Yang*, MA Nengyi
(Shanghai Pharmaceuticals Holding Co., Ltd., Shanghai 200020, China)
ABSTRACT This paper focuses on the formation of a sustainable drug traceability system, analyzes the problems in the development of drug traceability system by combing the construction process of national drug electronic regulatory code and the current industry status. The key elements of the drug traceability system with operability are proposed based on the successful examples of the United States of America and the European Union and the analysis of the interest demands of relevant parties in the traceability system.
KEy WORDS drug traceability; electronic regulatory code; drug supervision
2006年起,为加强药品电子监管工作,提高公众用药安全水平,实现药品全品种全过程监管,原国家食品药品监督管理局开始分三期推行药品电子监管工作,第一期包括麻醉药品、第一类精神药品制剂、小包装原料药,第二期为二类精神药品、中药注射剂、血液制品、疫苗,第三期为批准注册的药品及医疗器械[1]。
但2016年2月20日,原食药监总局发布《关于暂停执行2015年1号公告药品电子监管有关规定的公告》[2],暂停执行药品电子监管相关制度。2017年3月1日起,阿里健康不再继续更新中国药品电子监管网系统,6月,阿里健康推出“码上放心”追溯平台,成为第三方追溯平臺供药品生产经营企业选用。
1 问题及分析
自2006年以电子监管码为核心的药品追溯体系启动实施,到2016年的暂停、再到后监管码时代的企业自建,在一波三折的建设历程中,可以发现不少典型问题。
1.1 信息无法闭环
目前大部分生产企业为符合追溯政策的形式合规而维持原监管码方式上传生产数据,但流通企业,若没有制药企业的强制要求,均不再扫码上传,零售终端、医院由于成本控制及业务流程因素,基本不扫码上传,在数据不完整情况下,追溯无法实现。
1.2 应用目标过多
药品追溯体系的目标是为了实现来源可查、去向可追、责任可究,要能够防伪鉴真,精准召回,还要防止串货,覆盖全品种全流向等。建设目标应更聚焦,不应把串货、全流向设为追溯的目标内容。
1.3 未考虑药品风险等级
高风险药品,如疫苗,其供应链短,因其价值、风险等因素,全流程数据闭环相对较易达成;而如OTC类风险低的药品,供应链反而更复杂,全流程的收集成本高、收益小、压力大、数据繁杂、且很难实现信息闭环。原有体系没有综合考虑不同类型药品之间风险等级的差异,增加了推广难度。
1.4 编码标准不统一
原药品电子监管码为独立编码标准,需解码无法直读,与国际GS1码不兼容,可读性差,推广性不强,编码以一维码呈现,包装利用率低。
1.5 成本收益难平衡
经调研,针对药品生产企业,使用阿里“码上放心”,平均一个生产基地的追溯码使用成本每年共计约100万。
针对药品流通企业,针对所有药品进行扫码上传,预计每个库房需增加10人,年成本100万元,以全国各级省平台共计200个库房计算,每年增加人力成本约2亿元,但所收集的细颗粒度追溯信息本身对流通企业内部基本无增值效益。
针对连锁药房,对所有药品扫码,为保证出入库时扫码、同时不降低现有工作效率,连锁总仓需增加18人,年成本180万元;连锁门店进行扫码,为保证效率以平均每5家需增加1人(年成本10万元/人)计,600家门店增加人力成本约1 200万元/年;总计1 380万元/年,对于本身已经是微利运营的零售企业,成本压力较大。
针对医院等医疗机构,医药分离后,药品零加成,成为医院的成本中心。医院用药时仅关注药品品种、药品效期,不关注单盒包装的流向,且由于运营流程及成本,基本没有条件及人员实现对单盒药品的扫码。
1.6 平台权威性、安全性不足
药监局具有公信力,但原平台运营过程中出现不合理情况,政策暂停。阿里缺少公信力,难以广泛覆盖。哈药自建追溯平台,被广东、陕西药品零售行业协会强烈反对和联合抵制。
相关利益方涉足平台管理,企业自身数据的安全及使用得不到保障,使企业逐步对平台失去信任。
追溯体系是有效监管和有序市场的基础,因此体系建设应当有足够的权威性,避免将此类监管核心环节推给市场决定,增加监管难度。
2 国外药品追溯体系现状概述
2.1 美国
2011年2月15日,美国FDA召开了关于处方药跟踪与追溯系统的公众研讨会,对标准化数码表述(standardized numerical identification,SNI)的应用进行了初次介绍。SNI是一套序列化的国家药品编码(serialized National Drug Code,sNDC),包含美国《联邦规章典集》第21篇207部分阐述的“国家药品编码”(National Drug Code,NDC)以及序列号。在NDC的基础上加上一组不超过20个字符的数字序列所形成的sNDC(SNI),可链接到包含药品批号、有效期、分销信息以及其他有关药品标识的数据库中,有助于处方药包装识别、验证、跟踪与追溯。SNI允许制造商或分包商为每个药品包装分配序列号,与NDC组合可形成独有标识,并且能够支持数以亿计上市药品的SNI不重复。
为满足FDCA法案的505D中关于“SNI应统一、可行,可在国际范围内认可”的要求,sNDC可与GTIN实现兼容,创造出一个序列化的GTIN(sGTIN)。GTIN是由国际标准1(Globe Standard 1,GS1)建立的药品标识全球标准,GS1是以协商一致为基础、非盈利性的国际标准组织,GS1系统是世界上最被广泛使用的供应链标准系统。GTIN可被用于整个供应链包装的独有标识。
美国2013年11月27日颁布《药品供应链安全法案》,规定:将药品身份数据在最小销售单位以二维码形式喷码,并以人眼可读文字印刷。各环节将药品流通数据存储至少6年,并要求在规定时间内响应FDA、联邦或地方政府的核查要求[3]。
美国采用“全流程追溯”模式,由企业承担主体责任,药品生产企业或分包装商自行选择符合法规的商业化信息平台服务商来实现药品序列化,将追溯相关信息传递至下级分销商,由分销商验证信息的准确性,并将追溯相关信息传递至下级销售商作进一步验证。该模式的特点是在药品供应链的每一个环节都进行交易信息验证,从而保障供应链安全。美国FDA实行“触发式追溯”,平时不审核企业存储的药品追溯信息,只有在接到药品问题投诉,或是对某批次产品产生怀疑时,才通知企业配合进行追溯和检查。
美国暂时未建设全国性的统一平台,FDA仅提供指导,但不参与平台组建,现有市场上有3个主要的商业追溯平台(也称L4平台),这些平台承担了数据保管和响应FDA核查并反馈的义务。
2.2 欧盟
欧洲制药工业协会联合会(European Federation of Pharmaceutical Industries and Associations,EFPIA)于2006年2月联合药品供应链中各利益相关集团,着手建立一套在欧洲范围内通行的药品电子监管系统,即欧洲药品验证系统(European Medicines Verification System,EMVS)。
欧盟于2008年9月成立了专门的EMVS系统指导委员会。该委员会由EFPIA、欧洲药房联盟(PGEU)和欧洲药品批发企业联盟(GIRP)作为正式成员,欧洲仿制药商联盟(EGA)作为观察员,4个机构共同组成。各机构分别代表原研药商、药房、药品批发企业和仿制药商的利益,共同对EMVS的推行事宜进行指导和决策。
相对均衡的机构设置,有效平衡了各大集团的利益,有利于药品电子监管制度的积极推行。
2011年7月,欧盟通过了《欧盟反伪造药品指令》(The EU Falsified Medicines Directive,DIRECTIVE2011/62/ EU)[4],明确要求为欧盟境内流通的每一份药品建立“可供验证其真实性”的安全档案,并建立一个欧盟国家通行的数据库,储存药品安全信息。该法案的颁布为欧洲药品电子监管系统的实施奠定了法律基础。
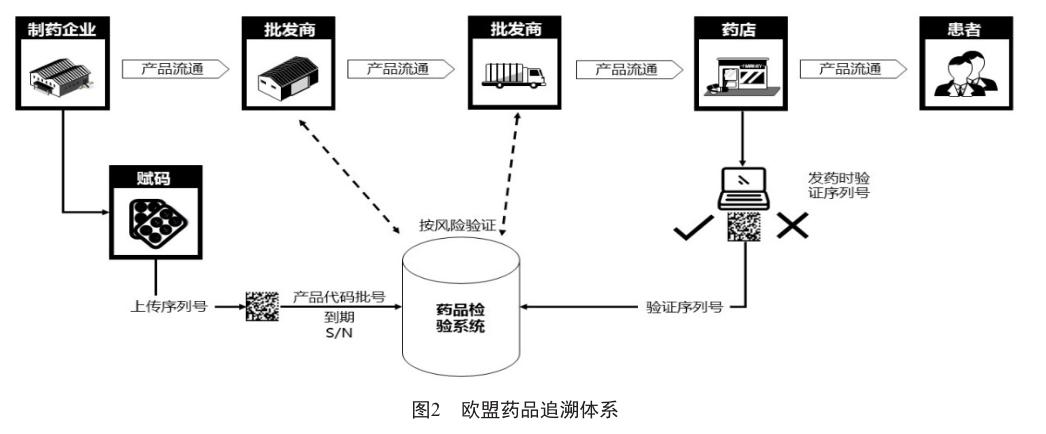
欧洲药品电子监管系统利用“二维码”对单件药品进行赋码,采用“配药点验证”模式(图2),通过强制实行发药前监管码信息验证,以实现对药品的安全监管及流向追溯的系统。运行多年,该模式在欧洲各国受到广泛认可,目前在各国已基本实现全面覆盖。
欧盟《防止假药法案》2019年2月9日正式生效,欧盟委托第三方组织建立了统一的数据交换平台EUHUB,采用“一头一尾”的模式,由企业承担主体责任,药品生产商/进口商对药品进行序列化,将药品信息上传到统一的平台,再由零售药房/配售点的药剂师在销售前扫描验证药品的真实性,并在销售确认后把药品状态标记为“已售出”。该模式的特点是不强制要求批发环节验证,而是由零售環节验证药品真假,防止假药。
2.3 小结
从上述实例可以看出,美国、欧盟的追溯体系均以产品序列化为基础,包装印刷二维码得到了广泛应用,且序列化均符合或者兼容于GS1标准,GS1标准在世界范围内覆盖也有利于药品的全球化追溯。
另一方面,各个国家建立药品追溯体系均有其明确的侧重点:美国旨在保障药品供应链中各节点的安全,欧盟则将目标指向打击假药。
只有通过对原有制度中的问题以及行业痛点诉求的分析,针对不同药品现有的运营形态,结合实际监管要求,最终明确追溯体系建立的根本目的,才能最大程度保证该体系的可持续发展。
3 方案构想与建议
针对以上问题,我们对药品追溯体系的建设提出以下建议:
1)建设原则与目的 依据本研究对追溯体系中各环节涉及方的调研及沟通,我们提出建设的原则是:应当遵循“风险分级控制”与“成本效益平衡”的原则。
建议将追溯体系建设的主要目的定义为:杜绝假药,保障药品购销安全及可追溯性,对高风险药品实行全流程监管,对低风险药品,实行“一头一尾”方式监管。
2)管理模式 对不同风险等级的药品采取不同模式的监管方式。已上市药品的追溯级别划分为两个级别:第一级为疫苗、血液制品、特殊药品(有毒品、麻醉药、精神类和放射性类药品),以及高风险的处方药(如治疗窗窄、抗生素等),第二级为普通处方药及非处方药。
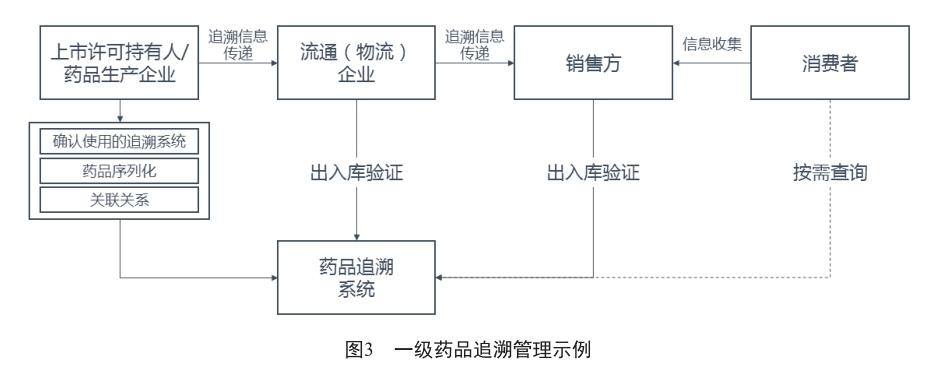
一级追溯药品,采用“全流程追溯”的模式进行监管:上市许可持有人及药品生产企业在生产环节完成各级包装(到最小销售包装)药品序列化、代码关联,上传系统,出库后将追溯相关信息传递至流通(物流)企业;流通(物流)企业进行药品出入库进行信息验证,并将追溯相关信息传递至销售方;销售方进行出入库验证,并在销售前验证源头信息并标记“已出售”状态。
若发生召回事件,一级追溯药品可全部由追溯平台完成。
二级追溯类药品采用“一头一尾”的模式进行监管:上市许可持有人及药品生产企业在生产环节完成各级包装(到最小销售包装)药品序列化、代码关联,上传追溯系统;流通企业按自身需要,对全部或部分药品进行扫码验证;终端销售方在销售出库前验证源头信息并标记“已出售”状态。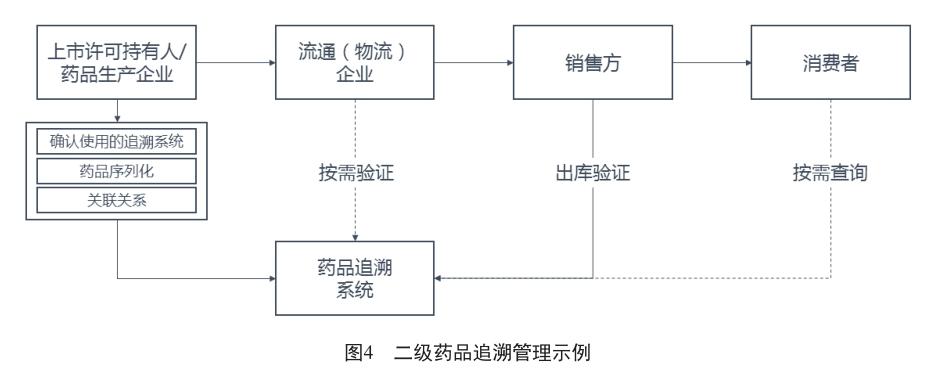
若发生召回事件,二级追溯药品可采用:以批号为主对供应链中的药品进行召回,同时利用追溯平台锁定药品状态使其无法在终端进行销售相结合的方式应对。
3)追溯码编码原则 由国家权威部门制定追溯编码统一的组成、生成、读取标准,追溯码编码标准应当采用或能够兼容现有商品流通所用GS1码标准,采用二维码及明码相结合的方式进行印刷,编码信息中包含药品品种、生产批号、有效期、序列码等。
对于原有20位电子监管码(码上放心追溯码),应当设置一定时间的过渡期,如5年。
4 总结
建成一套目标专一、风险分级、标准统一、成本合理,且能够带来实际应用价值的追溯体系,是药品追溯健康良性发展的重要前提。新的追溯体系应当遵循“风险分级控制”与“成本收益平衡”的原则,在全面序列化基础上,根据药品风险级别,分别采用“全流程追溯”及“一头一尾、配药点验证”两种模式运行,并进一步完善追溯码的标准,与国际接轨,同时做好过往编码过渡工作,使新体系在具有可持续、可扩展的前提下,实现更好的过渡性,使医药行业逐步有序的走入药品追溯时代。
参考文献
[1] 国家食品药品监督管理局. 关于实施药品电子监管工作有关问题的通知[EB/OL]. (2008-04-10)[2020-04-21]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/ gzwjyp/20080410120001258.html.
[2] 国家食品药品监督管理总局. 关于暂停执行2015年1号公告药品电子监管有关规定的公告[EB/OL]. (2016-02-20)[2020-04-21]. https://www.nmpa.gov.cn/yaopin/ ypjgdt/20160220162301824.html.
[3] 黃薇薇, 华佳. 国外药品追溯体系对我国的启示[J]. 中国药事, 2016, 30(12): 1232-1236.
[4] 唐菀晨, 王迎利, 张熹, 等. 我国药品追溯方案和信息化架构研究[J]. 中国药事, 2018, 32(7): 874-876.

