菠萝COL基因的克隆及响应乙烯的表达特性分析
阮城城 胡福初 王祥和 郭利军 李玉静 范鸿雁 罗志文 陈哲 张治礼


摘 要:COL(CONSTANS Like)基因不僅响应光周期调控,还参与植物器官的发育及非生物胁迫的响应。本研究克隆了4个菠萝COL(AcCOL)同源基因,预测其蛋白的结构理化性质和启动子顺式作用元件,并探究AcCOL基因在乙烯利处理后的时空表达模式。结果表明:AcCOL1、AcCOL2基因分别编码387、243个氨基酸,都含有CCT结构域,属于第Ⅳ类COL基因;AcCOL3、AcCOL4基因分别编码394、411个氨基酸,均含有1个B-box和1个CCT结构域,属于第Ⅲ类COL基因。启动子顺式作用元件预测表明4个AcCOL的启动子中均含有光响应元件、昼夜节律表达相关元件。AcCOL1和AcCOL2启动子均含有生长素响应元件和乙烯响应元件;AcCOL3和AcCOL4启动子均含有细胞分裂素响应元件。实时荧光定量PCR分析结果显示,AcCOL基因主要在叶中表达。乙烯利处理后,4个AcCOL同源基因均有不同程度上调。与各自时期的对照相比,AcCOL1和AcCOL4在茎中表达上调较多;AcCOL2和AcCOL3在叶中表达上调较多。另外,AcCOL2基因在3个组织部位中与各自时期的对照相比均有显著上调。研究表明,4个AcCOL同源基因在乙烯利处理后,表达水平均有上调;其中AcCOL2更为显著,在3个组织部位中,与另外3个基因相比表达上调更多。说明AcCOL2基因对外施的乙烯利信号更加敏感,可能在乙烯作用途径中发挥作用。
关键词:菠萝;乙烯利;CONSTANS Like;表达分析
中图分类号:S813.3 文献标识码:A
Abstract: COL (CONSTANS Like) gene not only responds to photoperiod regulation, but also participates in the development of plant organs and abiotic stress response. In this study, four homologous genes of AcCOL were cloned, then bioinformatics was used to analyze the amino acid sequence and the cis acting elements of AcCOL, finally the spatiotemporal expression pattern of the genes after ethephon treatment was explored. The results showed that the genes of AcCOL1 and AcCOL2 encoded 387 and 243 amino acids respectively, both of which contained CCT domains and belonged to the group IV COL genes; the genes of AcCOL3 and AcCOL4 encoded 394 and 411 amino acids respectively, both of which contained a b-box and a CCT domain and beloned to the class III COL genes. The prediction of promoter cis acting elements showed that the four promoters of AcCOL contained light response elements and circadian rhythm expression related elements. AcCOL1 and AcCOL2 promoters both contained auxin responsive elements and ethylene responsive elements, and AcCOL3 and AcCOL4 promoters both contained cytokinin responsive elements. The results of real-time PCR showed that the expression of AcCOL genes were mainly in leaves. After ethephon treatment, the four homologous genes of AcCOL were up-regulated in varying degrees. AcCOL1 and AcCOL4 were up-regulated in the stem, and AcCOL2 and AcCOL3 were up-regulated in the leaves. In addition, the AcCOL2 gene was significantly up-regulated in the three tissue sites compared with the control in each period. The results showed that the expression level of the four AcCOL homologous genes was up-regulated after ethephon treatment, of which AcCOL2 was more significant, and in three tissue sites, the expression was up-regulated more than the other three genes. It is suggested that AcCOL2 gene was more sensitive to ethylene signal and may play an important role in ethylene pathway.
Keywords: pineapple; ethephon; CONSTANS Like; expression analysis
DOI: 10.3969/j.issn.1000-2561.2021.01.002
在高等植物的生长过程中,开花是一个重要的阶段,不仅决定了产量的高低,还与人类生活密切相关。随着人们对拟南芥不断深入的研究,形成了经典的5个成花途径:光周期途径、春化途径、赤霉素途径、自发途径、年龄途径[1-2]。这些途径彼此独立而又相互联系,共同形成了复杂的成花网络[3]。
在光周期途径中GI基因响应光照长短的变化,并调节CO基因的表达。CO基因促进下游“开花整合子”SOC1、FT等基因的转录,影响下游基因的表达,从而对开花时间进行调控[4]。COL蛋白一般含有2个保守结构域:B-box(BBX)和CCT(CONSTANS,CO like及TOC1)结构域[5]。不同COL基因的CCT结构域差异不大,B-box结构域的差异比较明显,前者与核定位信号相关,后者具有蛋白互作的区域[6]。根据进化和基因结构,COL基因可以被分为四类,第Ⅰ类含有2个B-box结构域和1个CCT结构域;第Ⅱ类含有1个B-box结构域和1个序列发生变化、无正常功能的类似B-box结构域以及1个CCT结构域;第Ⅲ类含1个B-box结构域和1个CCT结构域;第Ⅳ类仅含有1个CCT结构域[7-8]。在植物的进化过程中绝大多数COL基因结构相似,都被昼夜节律和光周期调控,但也有一些COL基因产生了不同的功能[9]。AtCOL3除了在光周期中发挥负调控作用,还促进侧根的发育[10];AtCOL7在高的红光/远红光比例的环境中能促进茎的分枝[11]。香蕉COL1基因响应冷、真菌等胁迫并与果实成熟过程有所关联[12]。葡萄COL1基因参与芽休眠过程,而COL5则与胚珠的发育相关[13-14]。梨COL8基因通过抑制下游SOC1、FT等基因的表达来抑制成花,超表达该基因造成拟南芥晚花[15]。由此可见,结构相似的COL基因可能发挥着不同的功能。
菠萝(Ananas comosus L.)是多年生草本植物,著名的热带水果。我国是世界十大菠萝主生产国之一,产区主要集中于华南地区,目前菠萝已成为我国重要的热带经济作物[16]。菠萝自然成花的经济价值较低,常会出现开花整齐度不高的现象,严重影响了菠萝的上市;因此实际生产中常常采用外施乙烯利或者乙炔来提高开花整齐度与开花率,从而提高种植效益[17]。目前对乙烯利诱导菠萝成花的分子机制尚不清楚,已研究的成花基因主要包括FT[18]、PI[19]、MADS1[20]、LFY[21]等,未见菠萝COL基因的相关报道,乙烯利与AcCOL基因的关系也不清楚。本研究以菠萝‘台农4号为材料,成功克隆了4个COL同源基因,同时利用qRT-PCR技术研究COL基因在不同组织、不同时期乙烯利处理前后的表达情况,为进一步研究COL基因在乙烯利诱导菠萝成花过程中的作用奠定基础。
1 材料与方法
1.1 材料
以菠萝‘台农4号品种为试材,种植于海南省澄迈县美亭村菠萝基地。300倍液40%乙烯利(1600 mg/L)灌心处理诱导菠萝成花[22],处理后2 h、4 h、6 h、8 h、1 d、2 d分别采样,包括茎、叶、茎尖等部位或组织,同样时间段以相同体积的清水灌心处理为对照,液氮速冻后于–70 ℃冰箱保存备用。
1.2 方法
1.2.1 RNA的提取和cDNA的合成 采用植物总RNA提取试剂盒(福际生物)提取叶片总RNA,Thermo反转录试剂盒反转录cDNA。
1.2.2 引物设计与PCR反应体系 通过拟南芥CO基因在菠萝基因组数据库中进行比对,获得4个COL同源基因的序列,以此为基础利用Primer 5.0软件设计引物(表1)对菠萝COL基因的ORF区进行扩增。以反转录的cDNA为模板,反应体系为25 μL。95 ℃预变性3 min;95 ℃变性15 s,56 ℃退火30 s,72 ℃延伸1 min,32个循环;72 ℃延伸5 min。凝胶分析扩增结果。引物合成和测序由天一辉远公司完成。
1.2.3 序列分析、蛋白结构预测及系统进化树的构建 利用BioEidt 7.2.5软件,对克隆得到的cDNA序列进行翻译,然后利用NCBI的BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线软件对测序结果进行检索,并下载相似性>50%的蛋白序列。用NCBI中的ORF Finder (https://www. ncbi.nlm.nih.gov/orffinder/)分析AcCOL基因编码区;用在线软件ProtParam (http://web.expasy. org/protparam/)對蛋白分子量、等电点等进行预测分析;用GOV IV(http://npsa-prabi.ibcp.fr)分析蛋白二级结构;用PLACE(https://www. dna.affrc.go.jp)预测启动子顺式作用元件;应用DNAMAN 6.06进行多序列同源性对比分析,利用MEGA 6.0采用邻接法(neighbor-joining method)[23]构建系统进化树。
1.2.4 实时定量PCR反应 以总RNA反转录后的cDNA为模板,EF1为内参基因[24],每个样品3次重复,进行实时荧光定量PCR分析。该反应在LightCycler 480实时荧光定量PCR仪上进行。实时定量PCR的反应体系为10 μL,包括1 μL cDNA,5 μL SYBR Green I Master,10 μmol/L的正反向引物各1 μL,2 μL ddH2O。数据采用2-ΔΔCT法[25]进行相对定量分析,利用Excel、GraphPad Prism 5.0等软件进行统计学分析。
2 结果与分析
2.1 菠萝AcCOL基因的克隆与序列分析
以菠萝叶片总RNA反转录的cDNA为模板,成功克隆得到了4个AcCOL同源基因,分别命名为AcCOL1、AcCOL2、AcCOL3、AcCOL4。序列分析结果显示,AcCOL1基因的开放阅读框为1164 bp,编码387个氨基酸;AcCOL2基因的开放阅读框为732 bp,编码243个氨基酸;AcCOL3基因的开放阅读框为1185 bp,编码394个氨基酸;AcCOL4基因的开放阅读框为1236 bp,编码411个氨基酸。
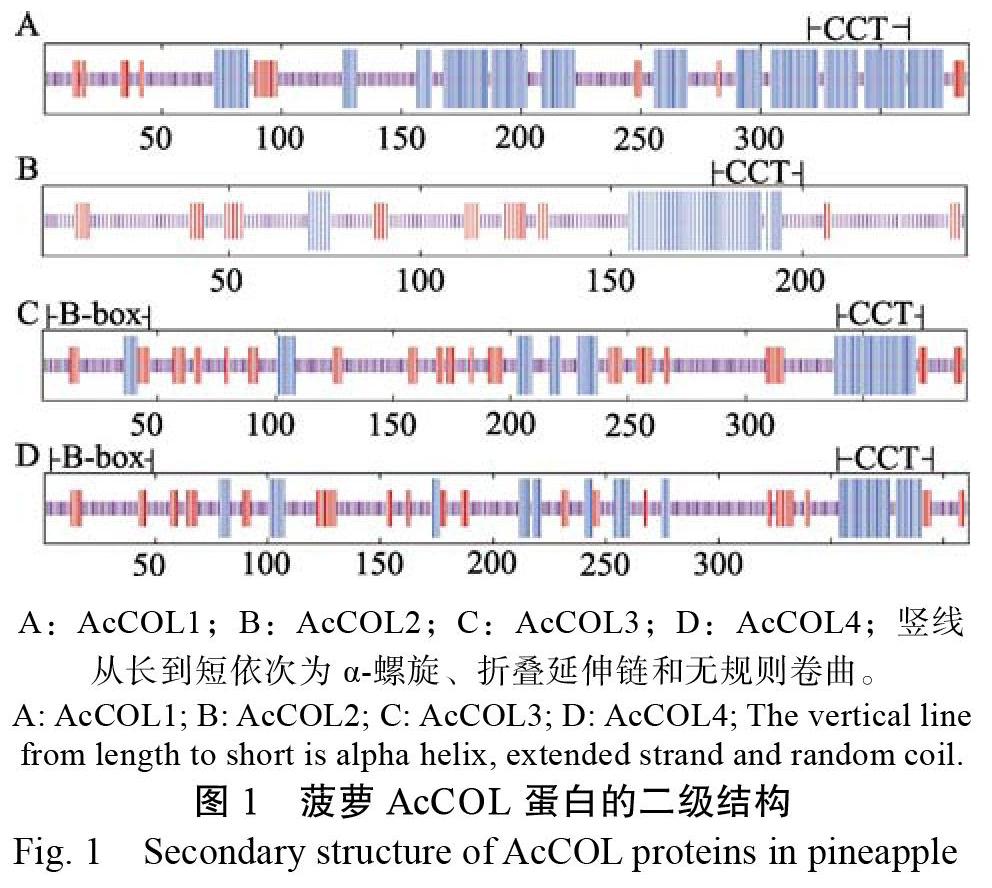
生物信息学分析显示(图1),4个AcCOL蛋白在靠近C端处都有CCT保守结构域,并且都含有折叠延伸链、无规则卷曲和α螺旋结构等结构。GOR IV预测发现(表2),上述3种结构在AcCOL1蛋白中的占比分别为8.01%、49.10%、42.89%,在AcCOL2蛋白中的占比分别为14.40%、67.08%、18.52%,在AcCOL3蛋白中的占比分别为19.54%、62.69%、17.77%,在AcCOL4蛋白中的占比分别为17.03%、64.72%、18.25%。
利用Protparam軟件,对AcCOL蛋白质序列的理化性质进行了预测。结果显示,AcCOL1、AcCOL2、AcCOL3、AcCOL4蛋白理论等电点(pI)分别为5.60、8.36、5.61、5.28,脂溶指数分别为62.02、46.71、63.40、62.75,推测AcCOL1、AcCOL3、AcCOL4可能为亲脂性蛋白,AcCOL2可能为亲水性蛋白(表2)。
2.2 菠萝AcCOL基因编码氨基酸的同源性分析
氨基酸序列比对发现,AcCOL3与AcCOL4均含有1个B-box和1个CCT结构域,属于第Ⅲ类COL基因;AcCOL1和AcCOL2均只含有CCT结构域,属于第Ⅳ类COL基因(图2)。同时我们发现不同植物种类的B-box结构域中有一些序列是相对保守的,含有数个相同的氨基酸序列。二级结构预测结果显示,4个AcCOL同源基因靠近N端的二级结构是相似的,都形成中间是折叠延伸链,两端是α-螺旋的构造(图1)。说明AcCOL1和AcCOL2基因与AcCOL3与AcCOL4基因同属于COL家族。
2.3 菠萝AcCOLs系统进化分析
通过搜索NCBI数据库,将4个AcCOL蛋白与其他物种约31个CO或COL蛋白进行系统进化分析(图3)。结果表明,这些蛋白整体被分为4组,4个AcCOL蛋白被分为两组。AcCOL1和AcCOL2属于Ⅳ组,AcCOL3和AcCOL4属于Ⅲ组。此外,从图3也可看出,AcCOL1和AcCOL2与高羊茅FaCO及拟南芥AtCOL8的遗传距离较近,AcCOL3与芦笋的AoCOL9遗传距离较近,AcCOL4与铁皮石斛DcCOL9、春兰CgCOL的遗传距离较近,这些基因均与植物成花密切相关。
2.4 AcCOL启动子顺式作用元件分析
通过对4个AcCOL基因启动子顺式作用元件进行分析,其作为CO基因家族成员,启动子区域均含有光响应元件INRNTPSADB、昼夜节律表达相关元件CIACADIANLELHC。另外,还发现了不同激素响应元件。AcCOL1和AcCOL2基因的启动子区域均含有生长素响应元件AUXRETGA2GMGH3和乙烯响应元件ERELEE4;AcCOL3和AcCOL4基因均含有细胞分裂素响应元件CPBCSPOR(表3)。
2.5 乙烯利处理下AcCOL基因的表达分析
乙烯利处理后,AcCOL1基因的表达在茎尖与各自时期的对照相比基本均有所上调。处理后2 d,相对表达量最高,约为对照(0 h)的1.8倍;在茎中,AcCOL1基因的表达与各自时期的对照相比基本均有显著的上调,在处理后2 h达到最高,约为对照(0 h)的6倍;而在叶中AcCOL1基因的表达与各自时期的对照相比基本呈下调趋势(图4A~图4C)。
AcCOL2基因的表达在茎尖中与对照(0 h)相比明显下调,但与各自时期的对照相比都有显著的上调;在茎中,AcCOL2基因的表达与各自时期的对照相比均有显著的上调;AcCOL2基因的表达在叶中呈现先升高后降低再升高的趋势,并且与各自时期的对照相比均有显著的上调,处理后2 d达到最大值,约为对照(0 h)的35倍(图4D~图4F)。
AcCOL3基因的表达水平在茎尖中与各自时期的对照相比均有显著的上调,在处理后8 h达到最大值,约为对照(0 h)的4.5倍;在茎中,AcCOL3基因的表达与对照(0 h)相比明显下调,但其表达趋势在处理后8 h内逐渐升高;AcCOL3基因的表达在叶中呈现先升高后降低的趋势,除处理后1、2 d外,与各自时期的对照相比均有显著的上调(图4G~图4I)。
EgCOL3:油棕(XP_010914103.1);PdCOL4:海枣(XP_008789696.1);PhCOL3:哈氏黍(XP_025825843.1);ZmCOL3:玉米(XP_008663359.1);SiCOL3:小米(XP_004976103.1);SbCOL4:高梁(XP_002446734.2);EgCOL10:油棕(XP_010942895.1);PdCOL10:海枣(XP_008803173.1);DcCOL9:铁皮石斛(XP_020681736.1);PhCOL9:哈氏黍(XP_025827948.1);EgCOL9:油棕(XP_010942554.1);PdCOL9:海枣(XP_008801879.1);AoCOL9:芦笋(XP_020264346.1);CgCOL:春兰(AXY87623.1);PsCO:牡丹(AHM25240.1);MiCO:芒果(ADX97322.1);StCO:土豆(NP_001274795.1);NtCO:烟草(AFY06686.1);GhCOL4:棉花(NP_001313742.1);FaCO:高羊茅(ADA67904.1);SlCO1:番茄(NP_001233839.1);TsCO:乌桕(ARS25033.1);PvCO:菜豆(AGZ15419.1);FaCO:草莓(ACJ06578.1);拟南芥:AtCO (NP_197088.1), AtCOL4 (NP_197875.1), AtCOL5 (AAM45054.1), AtCOL6 (AAM10103.1), AtCOL8 (NP_15339.2.1), AtCOL10 (NP_199636.1), AtCOL11 (NP_193260.2)。
EgCOL3: Elaeis guineensis (XP_010914103.1); PdCOL4: Phoenix dactylifera (XP_008789696.1); PhCOL3: Panicum hallii (XP_025825843.1); ZmCOL3: Zea mays (XP_008663359.1); SiCOL3: Setaria italica (XP_004976103.1); SbCOL4: Sorghum bicolor (XP_002446734.2); EgCOL10: Elaeis guineensis (XP_010942895.1); PdCOL10: Phoenix dactylifera (XP_008803173.1); DcCOL9: Dendrobium catenatum (XP_020681736.1); PhCOL9: Panicum hallii (XP_025827948.1); EgCOL9: Elaeis guineensis (XP_010942554.1); PdCOL9: Phoenix dactylifera (XP_008801879.1); AoCOL9: Asparagus officinalis (XP_020264346.1); CgCOL: Cymbidium goeringii (AXY87623.1); PsCO: Paeonia suffruticosa (AHM25240.1); MiCO: Mangifera indica (ADX97322.1); StCO: Solanum tuberosum (NP_001274795.1); NtCO: Nicotiana tabacum (AFY06686.1); GhCOL4: Gossypium hirsutum (NP_001313742.1); FaCO: Festuca arundinacea (ADA67904.1); SlCO1: Solanum lycopersicum (NP_001233839.1); TsCO: Triadica sebifera (ARS25033.1); PvCO: Phaseolus vulgaris (AGZ15419.1); FaCO: Fragaria x ananassa (ACJ06578.1). Arabidopsis thaliana: AtCO (NP_197088.1), AtCOL4 (NP_197875.1), AtCOL5 (AAM45054.1), AtCOL6 (AAM10103.1), AtCOL8 (NP_15339.2.1), AtCOL10 (NP_199636.1), AtCOL11 (NP_193260.2).
AcCOL4基因的表達在茎尖中与对照(0 h)相比明显下调。在茎中,AcCOL4基因的表达仅在处理后2、4 h有明显的上调,分别约为对照(0 h)的18、11倍,其他时期与对照相比基本无显著变化;AcCOL4基因的表达在叶中呈现先升高后降低的趋势,在处理后4 h达到最大值,约为对照(0 h)的520倍(图4J~图4L)。
4个AcCOL基因的表达水平在乙烯利处理后与各自时期的对照相比均有不同程度的上调,其中AcCOL2的表达最为显著。因此,4个AcCOL基因对乙烯信号具有一定的响应,其中AcCOL2基因对其更加敏感。
3 讨论
20世纪初,人们对成花生理进行了大量的探索,随后出现了成花研究史上2个重要的学说——“开花素”学说和“光敏素”学说,但这也仅仅是假说;直到后来成花相关基因的克隆,才令成花研究进入高速发展阶段[26]。成花相关基因在拟南芥、水稻等模式生物中已经进行了深入的研究,大量的基因被鉴定了出来[27-29]。COL(CONSTANS Like)基因是重要的成花相关基因,响应日长、昼夜节奏等环境因素,COL基因家族在各种植物中广泛存在,COL基因家族在拟南芥、水稻、大麦、大豆、甘菊中分别有17、16、9、26、11个成员[30-33]。通过与菠萝基因组[34]比对分析,共发现菠萝中有21个COL基因,本研究克隆获得4个AcCOL基因,因此对该基因家族的研究仍需完善。拟南芥COL基因大致被分为3类,研究表明几乎所有的第一类COL基因都与成花相关[35-37]。而第二类和第三类COL基因几乎不参与光周期途径调控的成花机制,如AtCOL9能够抑制CO、FT的表达从而推迟成花转变[38]。本实验中,通过AtCO基因在菠萝数据库中进行比对,发现4个与其他物种的COL基因遗传距离相近的4个基因,从而确定命名为COL同源基因。通过序列和进化树分析,AcCOL1和AcCOL2属于第四类基因,AcCOL3和AcCOL4属于第三类基因,这4个基因可能通过光周期途径以外的方式实现成花调控。水稻中的COL基因被分为2个亚组:一类含有2个不完整的B-box结构,另一类含有1个CCT结构域但没有典型的B-box结构[39]。大麦HvCO9基因只含有CCT结构域,该基因在长日照下抑制成花但在短日照条件下促进成花[40]。有着相似结构的AcCOL1和AcCOL2也可能发挥着类似的功能。
在植物的叶中,光受体和光敏色素能够影响CO蛋白的稳定性,CO蛋白主要在叶片的韧皮部激活FT的表达,FT蛋白通过筛管进入茎尖分生组织最终调控植物成花[41-43]。本研究中,4个AcCOL基因在叶中的表达水平除AcCOL1外,与茎尖和茎中的表达水平相比随着时间的推移均有较为显著的变化,这表明这3个AcCOL基因在叶中有较多的富集。在水稻中水杨酸和乙烯信号途径与水稻稻瘟病息息相关,而超表达OsCOL9基因能明显增加这2种物质的合成[44]。在葡萄中,外施乙烯利能够使某些COL基因显著上调[45]。本文中4个AcCOL基因在乙烯利处理后均有不同程度的上调,而AcCOL2基因的表达更为显著并且该基因的启动子包含乙烯顺式作用元件。这些表明,AcCOL2可能在乙烯调控途径中发挥重要作用。只含有1个CCT结构域的芒果COL6基因在成花诱导期和花芽分化期的临界点有较高的表达,暗示该基因可能与花芽的发育相关[8]。本研究中拥有相似结构的AcCOL1和AcCOL2也可能发挥类似的功能。植物在逆境环境中,生长周期会缩短,成花速度也大大加快。在拟南芥中,脱落酸通过调控GI和CO基因来激活FT的表达从而提早成花[46]。脱落酸和乙烯是具有密切联系的两大植物激素,脱落酸能促进乙烯的生成,从而携手在逆境条件下发挥作用[47]。乙烯利能够促进菠萝成花,是因为乙烯利作为一种胁迫处理,可能存在一种类似脱落酸的方式,通过调控AcCOL基因来实现成花诱导。
本研究结果表明菠萝在乙烯利处理后,AcCOL基因的表达均有上调,其中含有乙烯順式作用元件的AcCOL2基因的表达上调更显著,说明AcCOL2基因在乙烯调控途径中发挥了重要的作用。而AcCOL2基因是否在乙烯利诱导菠萝成花过程中发挥作用,尚需进行实验加以验证。
参考文献
Jack T. Molecular and genetic mechanisms of floral control[J]. Plant Cell, 2004, 16: S1-S17.
Yant L, Mathieu J, Dinh T T, et al. Orchestration of the floral transition and floral development in Arabidopsis by the bifunctional transcription factor APETALA2[J]. Plant Cell, 2010, 22(7): 2156-2170.
刘永平, 杨 静, 杨明峰. 植物开花调控途径[J]. 生物工程学报, 2015, 31(11): 1553-1566.
杨修勤, 汤青林, 宋 明, 等. 光周期途径核心因子CO的开花调控机制[J]. 植物生理学报, 2013, 49(9): 861-868.
Hu T, Wei Q, Wang W, et al. Genome-wide identification and characterization of CONSTANS-like gene family in radish (Raphanus sativus)[J]. PLoS One, 2018, 13(9): e0204137.
Wu W, Zhang Y, Zhang M, et al. The rice CONSTANS-like protein OsCOL15 suppresses flowering by promoting Ghd7 and repressing RID1[J]. Biochemical and Biophysical Research Communications, 2018, 495(1): 1349-1355.
Robson F, Costa M M R, Hepworth S R, et al. Functional importance of conserved domains in the flowering-time gene CONSTANS demonstrated by analysis of mutant alleles and transgenic plants[J]. The Plant Journal, 2002, 28(6): 619-631.
[8]卢新喜, 罗 聪, 张秀娟, 等. 芒果MiCOL6基因的克隆及其生物信息学和表达分析[J]. 热带作物学报, 2020, 41(4): 715-721.
Valverde F. CONSTANS and the evolutionary origin of photoperiodic timing of flowering[J]. Journal of Experimental Botany, 2011, 62(8): 2453-2463.
Datta S, Hettiarachchi G H C M, Deng X W, et al. Arabidopsis CONSTANS-LIKE3 is a positive regulator of red light signaling and root growth[J]. Plant Cell, 2006, 18(1): 70-84.
Wang H G, Zhang Z L, Li H Y, et al. CONSTANS-LIKE 7 regulates branching and shade avoidance response in Arabidopsis[J]. Journal of Experimental Botany, 2013, 64(4): 1017-1024.
Chen J, Chen J Y, Wang J N, et al. Molecular characterization and expression profiles of MaCOL1, a CONSTANS-like gene in banana fruit[J]. Gene, 2012, 496(2): 110-117.
刘炳臣, 唐玉瑾, 魏 蓉, 等. 葡萄VvCOL5基因克隆及在胚珠发育过程中的表达分析[J]. 西北林学院学报, 2017, 32(1): 114-120.
Almada R, Cabrera N, Casaretto J A, et al. VvCO and VvCOL1, two CONSTANS homologous genes, are regulated during flower induction and dormancy in grapevine buds[J]. Plant Cell Report, 2009, 28(8): 1193-1203.
Wang P, Liu Z, Cao P, et al. PbCOL8 is a clock-regulated flowering time repressor in pear[J]. Tree Genetics & Genomes, 2017, 13(5): 107.
杨 眉, 迟晓君. 我国菠萝皮渣综合利用的研究进展[J].中国果菜, 2019, 39(8): 48-51.
張治礼, 范鸿雁, 华 敏, 等. 菠萝开花诱导及其生理与分子基础[J]. 热带作物学报, 2012, 33(5): 950-955.
Lv L L, Duan J, Xie J H, et al. Isolation and characterization of a FLOWERING LOCUS T homolog from pineapple (Ananas comosus (L.)Merr)[J]. Gene, 2012, 505(2): 368-373.
Lv L L, Duan J, Xie J H, et al. Cloning and expression analysis of a PISTILLATA homologous gene from pineapple (Ananas comosus L. Merr)[J]. International Journal of Molecular Sciences, 2012, 13(1): 1039-1053.
Moyler R L, Koia J H, Vrebalov J, et al. The pineapple AcMADS1 promoter confers high level expression in tomato and Arabidopsis flowering and fruiting tissues, but AcMADS1 does not complement the tomato LeMADS-RIN (rin) mutant[J]. Plant Molecular Biology, 2014, 86(4/5): 395-407.
年宇薇, 陈 哲, 胡福初, 等. 菠萝LEAFY基因克隆与表达模式研究[J]. 分子植物育种, 2018, 16(7): 2107-2115.
华 敏, 王祥和, 何 凡, 等. 台农16号菠萝催花试验[J]. 中国南方果树, 2009, 38(4): 49-51.
Wang S, Li XH, Wang K, et al. Phylogenetic analysis of C, M, N, and U genomes and their relationships with, Triticum, and other related genomes as revealed by LMW-GS genes at Glu-3loci[J]. Genome, 2011, 54(4): 273-284.
李瑞雪, 余三淼, 李 夏, 等. 红苞凤梨实时荧光定量PCR分析中内参基因的筛选[J]. 热带亚热带植物学报, 2017, 25(3): 250-256.
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-timequantitative PCR and the 2–ΔΔCT method[J]. Methods, 2001, 25(4): 402-408.
李宪利, 袁志友, 高东升. 高等植物成花分子机理研究现状及展望[J]. 西北植物学报, 2002, 22(1): 173-183.
Liu T M, Zhang Y S, Zhang H, et al. Quantitative trait loci for the number of grains per panicle dependent on or independent of heading date in rice (Oryza sativa L.)[J]. Breeding Science, 2011, 61(2): 142-150.
Liu T M, Liu H Y, Zhang H Y, et al. Validation and characterization of Ghd7.1, a major quantitative trait locus with pleiotropic effects on spikelets per panicle, plant height, and heading date in rice (Oryza sativa L.)[J]. Journal of Integrative Plant Biology, 2013, 55(10): 917-927.
Komeda Y. Genetic regulation of time to flower in Arabidopsis thaliana[J]. Annual Review of Plant Biology, 2004, 55: 521-535.
Fu J X, Yang L W, Dai S L. Identification and characterization of the CONSTANS-like gene family in the short-day plant Chrysanthemum lavandulifolium[J]. Molecular Genetics and Genomics, 2015, 290(3): 1039-1054.
Wu F Q, Price B W, Haider W, et al. Functional and evolutionary characterization of the CONSTANS gene family in short-day photoperiodic flowering in soybean[J]. PLoS One, 2014, 9(1): e85754.
Griffiths S, Dunford R P, Coupland G, et al. The evolution of CONSTANS-like gene families in barley, rice, and Arabidopsis[J]. Plant Physiology, 2003, 131(4): 1855-1867.
Li Y F, Zhao Y Q, Zhang M, et al. Functional and evolutionary characterization of the CONSTANS-like family in Lilium × formolongi[J]. Plant and Cell Physiology, 2018, 59(9): 1874-1888.
Ming R, VanBuren R, Wai C M, et al. The pineapple genome and the evolution of CAM photosynthesis[J]. Nature Genetics, 2015, 47(12): 1435-1442.
Chaurasia A K, Patil H B, Azeez A, et al. Molecular characterization of CONSTANS-Like (COL) genes in banana (Musa acuminataL. AAA Group, cv. Grand Nain)[J]. Physiology and Molecular Biology of Plants, 2016, 22(1): 1-15.
Zhang R, Ding J, Liu C X, et al. Molecular evolution and phylogenetic analysis of eight COL superfamily genes in group I related to photoperiodic regulation of flowering time in wild and domesticated cotton (Gossypium) species[J]. PLoS One, 2015, 10(2): e0118669.
Gangappa S N, Botto J F. The BBX family of plant transcription factors[J]. Trends in Plant Science, 2014, 19(7): 460-470.
Cheng X F, Wang Z Y. Overexpression of COL9, a CONSTANS-LIKE gene, delays flowering by reducing expression of CO and FT in Arabidopsis thaliana[J]. Plant Journal, 2005, 43(5): 758-768.
劉莉洁. 胡萝卜CONSTANS-like基因的克隆及功能研究[D]. 北京: 中国农业科学院, 2016.
Kikuchi R, Kawahigashi H, Oshima M, et al. The differential expression of HvCO9, a member of the CONSTANS-like gene family, contributes to the control of flowering under short-day conditions in barley[J]. Journal of Experimental Botany, 2012, 63(2): 773-784.
Valverde F, Mouradov A, Soppe W, et al, Coupland G. Photoreceptor regulation of CONSTANS protein in photoperiodic flowering[J]. Science, 2004, 303(5660): 1003-1006.
Mockler T, Yang HY, Yu XH, et al. Regulation of photoperiodic flowering by Arabidopsis photoreceptors[J]. Proceedings of the National Academy of Sciences, 2003, 100(4): 2140-2145.
Jaeger K E, Graf A, Wigge P A. The control of flowering in time and space[J]. Journal of Experimental Botany, 2006, 57(13): 3415-3418.
Liu H, Dong S Y, Sun D Y, et al. CONSTANS-like 9 (OsCOL9) interacts with receptor for activated C-kinase 1 (OsRACK1) to regulate blast resistance through salicylic acid and ethylene signaling pathways[J]. PLoS One, 2016, 11(11): e0166249.
Wang L, Xue J Y, Dai W N, et al. Genome-wide identification, phylogenetic analysis, and expression profiling of CONSTANS-like (COL) genes in Vitis vinifera[J]. Journal of Plant Growth Regulation, 2019, 38(2): 631-643.
Riboni M, Test A R, Galbiati M, et al. ABA-dependent control of GIGANTEA signalling enables drought escape via up-regulation of FLOWERING LOCUS T in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2016, 67(22): 6309-6322.
唐海明, 徐一兰, 陈金湘, 等. 植物脱落酸、多胺和乙烯与逆境的关系[J]. 作物研究, 2007(S1): 501-505.
责任编辑:黄东杰

