IL⁃37对变应性鼻炎患者相关细胞因子免疫调控研究
王亚茹
变应性鼻炎(allergic rhinitis,AR)是患者接触过敏原后由免疫球蛋白E(immunoglobulin E,IgE)介导的多种免疫活性细胞和相关细胞因子参与的、大量炎症递质释放的鼻粘膜慢性炎症反应疾病[1]。研究认为[2],辅助性T 细胞1(helper T cell 1,Th1)/Th2 细胞免疫失衡、调节性T 细胞(regulatory T cells)水平异常的自身免疫耐受和气道变应性反应发挥了重要作用。这些细胞可分泌白介素6(In⁃terleukin 6,IL⁃6)、IL⁃17、IFN⁃γ 等多种免疫和炎症调控因子,在变应性疾病的发生和发展中存在重要作用。但是,目前对于AR 具体的免疫调控机制尚未十分明确。IL⁃37 为新发现的炎症抑制因子,可广泛下调机体固有免疫及获得性免疫应答,其在健康个体中几乎不表达,但在炎症组织中存在明显高表达[3]。前期研究显示[4],在支气管哮喘疾病患者中血清IL⁃37 水平明显降低,并参与了支气管哮喘的免疫炎症过程,但对于AR 患者IL⁃37 是否存在类似的免疫调控机制尚不清楚。因此,本研究对AR 患者IL⁃37 表达情况及重组人IL⁃37 蛋白(rIL⁃37)对相关免疫细胞因子的影响进行了研究,以期为阐明AR 的发病机制提供依据,具体如下。
1 资料与方法
1.1 一般资料
2017年8月至2019年12月120 例AR 患者作为研究组,其中男71 例,女49 例,平均年龄(28.9±3.6)岁。纳入标准:①根据患者症状体征,结合鼻内镜、CT 影像学资料等检查确诊,符合AR 的诊断标准[5];②均自愿参与本研究并签署知情同意书;③均临床资料完整,能够配合完成研究。排除标准:①合并呼吸道和变应性疾病史者;②近期接受局部或全身糖皮质激素、抗组胺或免疫治疗者;③合并免疫缺陷疾病、恶性肿瘤、心血管疾病、精神疾病及重要脏器功能障碍者。另选择同期健康志愿者120 例作为对照组,平均年龄(29.2±3.7)岁,均吸入性变应原皮肤点刺阴性,无变应性鼻炎症状,无其他疾病史,自愿参与本研究并签署知情同意书。本研究获得本院医学伦理委员会通过。
1.2 方法
1.2.1 标本采集
所有研究对象均于清晨抽取6 mL 空腹静脉血,肝素抗凝。2 mL 经3 000 r/min 离心15 min 分离血清,-20℃保存待测,取2 mL 检测IL⁃37 mRNA表达,另外2 mL 检测免疫细胞百分比。
1.2.2 实时荧光定量反转录聚合酶连反应(Real⁃time fluorescence quantitative reverse transcription polymerase reaction,RT⁃PCR)检测IL⁃37 mRNA表达
取2 mL 静脉血,提取外周血单核细胞(Periph⁃eral blood mononuclear cells,PBMCs)并分离培养。取细胞依照Trizol 和逆转录试剂盒(购自Invi⁃trogen 公司)及SYBR Green 试剂盒(购自TAKA⁃RA 公司)抽提总RNA,并取1ng 反转录合成cD⁃NA。IL⁃37 及内参β⁃actin 引物由上海生工生物工程有限公司合成。引物序列:IL⁃37:上游:5′⁃TTCTTTGCATTAGCCTCATCCTT⁃3′,下游:5′⁃CGTGCTGATTCCTTTTGGGC⁃3′;β⁃actin:上游:5′⁃CACTGTGTTGGCGTACAGGT⁃3′,下游:5′⁃TCATCACCATTGGCAATGAG⁃3′。反应条件:95℃1 min,95℃15 s,60℃15 s,72℃45 s,40 个循环,95℃15 s,60℃15 s。根据每孔CT值进行统计学分析。
1.2.3 流式细胞术(Flow Cytometry,FCM)检测免疫细胞百分比
Th1 细胞、Th2 细胞、Th17 细胞百分比检测,取200 μL 外周血,加入等体积1640 细胞培养液(购自美国Gibcol brl 公司),加入19 μL 浓度为1 μg/mL 的PMA(佛波酯,购自MultiSciences 公司),6 μL 浓度为1 μg/mL 的莫能霉素工作液和6 μL浓度为0.1 mg/mL 的离子霉素工作液(均购自美国Invitrogen 公司),37℃5% CO2培养箱培养5 h。分别加入CD4⁃FITC、CD8⁃APC 和CD3⁃PE⁃CY7 单克隆抗体(购自美国BD 公司),室温避光孵育15 min。PBS 冲洗,加入100 μL 破膜剂,室温避光孵育15 min,PBS 冲洗2 次。加入IL⁃4⁃PE 和IFN⁃γ⁃PE⁃CY5 单克隆抗体(购自美国BD 公司)混匀,室温避光孵育20 min。PBS 洗涤重悬细胞,FACSCalibur 流式细胞仪(美国BD 公司)检测。
CD4+CD25+Treg 细胞、Foxp3+CD4+CD25+Treg 细胞百分比检测,取50 μL 外周血,加入CD4⁃FITC、CD25⁃PE(购自美国BD 公司)充分混匀,室温避光孵育15min,固定剂固定15 min,PBS 冲洗,1 500 r/min 离心15 min 取沉淀,加 入5 μL 的Foxp3⁃PE⁃CY5,15 min,PBS 200 μL 重悬,FACS⁃Calibur 流式细胞仪(美国BD 公司)检测。
1.2.4 酶联免疫吸附法(Enzyme⁃linked immuno⁃sorbent assay,ELISA)检测血清指标
取预先分离的血清,采用ELISA 法检测IL⁃1β、IL⁃4、IL⁃6、IL⁃10、IL⁃17、IL⁃27、IL⁃37、干扰素γ(IFN⁃γ)、转化生长因子β1(TGF⁃β1)水平,试剂盒均购自武汉博士德生物工程有限公司,严格依照试剂盒说明书执行各项操作。
1.2.5 rIL⁃37 干预
取适量PBMCs,分别加入浓度为100 ng/mL和200 ng/mL 的rIL⁃37 干预,ELISA 法检测干预前后免疫相关细胞因子水平。
1.3 统计学分析
采用SPSS 20.0 统计学软件进行数据分析,计量资料以()表示,两两比较采用t检验,多组间比较采用F检验;血清IL⁃37 与相关细胞因子的相关性分析采用Pearson 检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 IL⁃37 水平比较
研究组血清IL⁃37 蛋白水平及mRNA 表达均显著低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 IL⁃37 蛋白及mRNA 表达水平比较(±s)Table 1 Comparison of serum IL⁃37 levels and IL⁃37 mRNA expression levels in the two groups(±s)
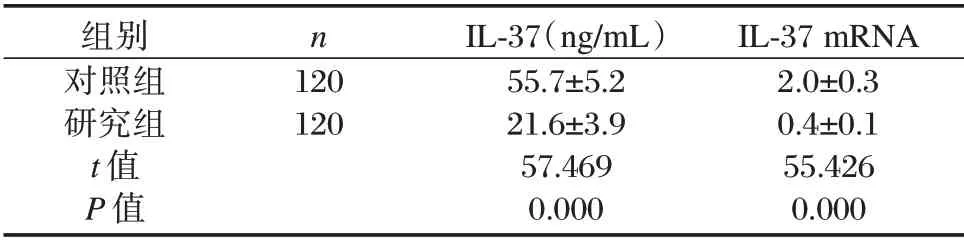
表1 IL⁃37 蛋白及mRNA 表达水平比较(±s)Table 1 Comparison of serum IL⁃37 levels and IL⁃37 mRNA expression levels in the two groups(±s)
组别对照组研究组t 值P 值n 120 120 IL⁃37(ng/mL)55.7±5.2 21.6±3.9 57.469 0.000 IL⁃37 mRNA 2.0±0.3 0.4±0.1 55.426 0.000
2.2 研究组及对照组免疫细胞及相关细胞因子水平比较
研究组Th1 细胞、Th17 细胞百分比及Th1/Th2比例显著高于对照组,Th2 细胞、CD4+CD25+Treg细胞、Foxp3+CD4+CD25+Treg 细胞百分比显著低于对照组,差异有统计学意义(P<0.05)。研究组IL⁃1β、IL⁃6、IL⁃17水平显著高于对照组,IL⁃4、IL⁃10、IL⁃27、IFN⁃γ、TGF⁃β1 水平显著低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组免疫细胞及相关细胞因子水平比较(±s)Table 2 Comparison of the levels of immune cells and related cytokines in 2 groups(±s)

表2 两组免疫细胞及相关细胞因子水平比较(±s)Table 2 Comparison of the levels of immune cells and related cytokines in 2 groups(±s)
指标Th1(%)Th2(%)Th1/Th2(%)Th17(%)CD4+CD25+Treg(%)Foxp3+CD4+CD25+Treg(%)IL-1β(ng/mL)IL-4(ng/mL)IL-6(pg/mL)IL-10(pg/mL)IL-17(pg/mL)IL-27(pg/mL)IFN-γ(ng/mL)TGF-β1(pg/mL)对照组(n=120)7.6±1.4 5.1±1.2 4.0±0.5 0.9±0.3 8.2±1.5 7.8±1.7 192.8±20.6 67.2±8.1 155.1±13.2 221.7±19.8 584.1±48.1 526.2±50.3 64.6±6.9 0.5±0.1研究组(n=120)14.7±2.5 2.0±0.7 11.6±1.9 4.1±1.1 2.8±0.5 2.6±0.5 243.8±20.8 12.7±1.4 198.7±16.3 186.5±19.2 667.9±63.3 451.8±55.9 24.5±2.8 0.3±0.1 t 值27.144 24.444 42.375 30.745 37.412 32.146 19.084 72.629 22.771 13.981 11.547 10.838 58.991 15.492 P 值0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000 0.000
2.3 血清IL⁃37 与免疫相关细胞因子水平相关性分析
Pearson相关性分析结果显示,血清IL⁃37与IL⁃1β、IL⁃6、IL⁃17 存在负相关性,与IL⁃4、IL⁃10、IL⁃27、IFN⁃γ、TGF⁃β1 存在正相关性(P<0.05)。见表3。
2.4 rIL⁃37 干预前后研究组和对照组相关细胞因子水平比较
将研究组和对照组提取PBMCs 采用100 ng/mL 和200 ng/mL rIL⁃37 干预后,2 组PBMCs 细胞IL⁃1β、IL⁃6、IL⁃17 分泌水平较干预前明显降低,而IL⁃4、IL⁃10、IL⁃27、IFN⁃γ、TGF⁃β1 均较干预前出现明显升高,差异有统计学意义(P<0.05)。200 ng/mL组干预PBMCs 细胞各细胞因子变化水平相较于100 ng/mL 组各指标变化更显著,差异有统计学意义(P<0.05)。见表4。

表3 血清IL⁃37 与免疫相关细胞因子水平相关性分析Table 3 Correlation analysis between serum IL⁃37 and immune⁃related cytokine levels
3 讨论
AR 主要为特异性IgE 介导,并由树突状细胞、淋巴细胞、嗜酸性粒细胞等多种炎性介质和免疫细胞参与的慢性气道炎症疾病[6]。AR 不仅严重影响了患者的生活质量,甚至有可能威胁患者的生命安全。多项研究证实[7⁃8],T 淋巴细胞于AR 的异常免疫反应相关。Th 细胞可通过增生扩散激活其他类型的能直接产生免疫反应的免疫效应细胞,Th 细胞可分为Th1、Th2、Treg 和Th17 等不同亚型。其中,Th1/Th2 细胞平衡对于维持机体正常的体液免疫和细胞免疫至关重要。Th17 细胞为CD4+Z 效应T 细胞亚群的一种,可分泌IL⁃17 及少量IL⁃22,参与介导组织炎症和自身免疫性疾病。研究证实[9⁃10],在哮喘或受过敏原刺激的AR 患者中,存在Th1/Th2 平衡被破坏及Th17 细胞比例升高的情况;本研究对于AR 患者及健康人群对比Th1、Th2 及Th17 细胞百分比结果得到了类似的结论。Treg 细胞功能与Th17 细胞相反,其为“抑炎细胞”,两者平衡有助于维持机体稳定的免疫状态。

表4 rIL⁃37 干预前后研究组和对照组相关细胞因子水平比较Table 4 Comparison of related cytokine levels in the study group and the control group before and after rIL⁃37 intervention
IL⁃37 是最新发现的IL⁃1 家族的一员,其为抑炎因子的一种,IL⁃37 在健康个体中几乎不表达,但在炎症组织中呈明显高表达。研究认为[11],IL⁃37可通过巨噬细胞有效抑制促炎细胞因子的产物合成和释放,抑制树突细胞的活性和TLR 诱导的促炎因子释放。另有研究提出[12],IL⁃37 可减少哮喘动物模型Th2 细胞介导的变应性炎性反应,因此IL⁃37 可能在变应性疾病中发挥重要作用。丁庆雄研究中明确指出[13],在变应性鼻炎患儿的鼻腔灌洗液中IL⁃37b 表达显著降低。本研究结果提示,Ril⁃37 干预可降低促炎性细胞因子水平,促进抗炎性细胞因子表达。研究证实[14],IL⁃37 可通过下调STAT3 信号和STAT6 信号通路,促使IL⁃4、IL⁃6、STAT3、STAT6 磷酸化水平降低,来抑制Th2和Th17 细胞表达。另有研究指出[15],沉默内源性IL⁃37,并用LPS 刺激可导致IL⁃1β、IL⁃6、IL⁃17 等促炎细胞因子水平增加。IL⁃37 可被多种生物触发器激活,因此在AR 患者中,受Th1/Th2、Th17/Treg 免疫细胞平衡失调及相关细胞因子异常表达的影响,其被广泛激活而作用于全身多种炎症物质,发挥抑制疾病进展的作用。
综上所述,变应性鼻炎患者IL⁃37 表达明显下降,进而影响了Th1/Th2、Th17/Treg 细胞平衡,导致抑炎因子水平降低,促炎因子水平升高,在AR发病中具有重要作用。

