基于价值定价的多适应证药品医保支付国际经验及启示
代展菁 薛天祺 向贵圆 常峰 路云


摘 要 目的:為完善我国多适应证药品基于价值定价的医保支付提供参考。方法:梳理多适应证药品价值定价的理论基础和实现流程,分析法国、德国、英国、意大利和瑞典的价值评估指标和基于价值定价的医保支付策略,为我国多适应证药品医保支付提出建议。结果与结论:价值定价的实现首先需要制定一个价值框架以定义、测量、整合价值,再通过建立模型将总价值转化为价格。各国多适应证药品根据价值定价的整体思路一致,但价值评估指标存在差异。英国和瑞典主要以药物经济学方法测得的质量调整生命年(QALYs)和增量成本-效果比(ICERs)为价值标准,法国、德国和意大利则更侧重于以药品的临床治疗价值和临床指标改善程度为标准。在多适应证药品的医保支付策略方面,法国采取的是基于预期使用量的单一加权法,德国采取的是基于价值和使用量的组合加权法,英国采取的是名义医保支付标准结合患者准入协议法,意大利采取的是名义医保支付标准结合管理准入协议法,瑞典则采用不同适应证不同商品名的独立支付法。我国可在借鉴上述多国经验的基础上,探索适应我国国情的多适应证药品的价值定价策略,综合借鉴和使用多种医保支付策略,完善患者及药品使用信息收集机制,为实施多适应证药品价值定价和医保支付策略提供信息支持。
关键词 多适应证药品;价值定价;医保支付;法国;德国;英国;意大利;瑞典;启示
ABSTRACT OBJECTIVE:To provide reference for improving medical insurance reimbursement for multi-indication drugs based on value-based pricing in China. METHODS: The theory and practice of value-based pricing for multi-indication drugs were sorted out, and the value standards and medical insurance reimbursement strategies based on value-based pricing in France, Germany, UK, Italy and Sweden were analyzed, so as to provide the suggestions for medical insurance reimbursement of multi-indication drugs in China. RESULTS & CONCLUSIONS: The realization of value-based pricing first needed to develop a value framework to define, measure and integrate value, and then established a model to convert the total value into price. The overall idea of value-based pricing for multi-indication drugs was consistent, but there were differences in the value standard. In the UK and Sweden, quality-adjusted life years (QALYs) and incremental cost-effectiveness ratios (ICERs) measured by pharmacoeconomicsare used as the value standard. France, Germany and Italy were more focused on the therapeutic value and clinical benefit improvement. As for medical insurance reimbursement strategies,France adopted single weighting method based on expected volume. Germany adopted combination weighting method based on value and volume. UK introduced the Patient Access Schemes and Italy introduced the Managed Entry Agreements, both based on the nominal reimbursement standard. Sweden adopted independent reimbursement for different indications by different brand names. It is suggested that China can explore the value-based pricing strategies of multi-indication drugs on the basis of the above international experiences, reference and use these variety of medical insurance reimbursement strategies comprehensively. Simultaneously, the information collection mechanism of patients and drug use should be improved to provide data support for the implementation of Chinas value-based pricing and reimbursement strategies for multi-indication drugs.
KEYWORD Multi-indication drugs; Value-based pricing; Reimbursement; France; Germany; UK; Italy; Sweden; Enlightment
中图分类号 R95 文献标志码 A 文章编号 1001-0408(2021)02-0139-07
DOI 10.6039/j.issn.1001-0408.2021.02.03
多适应证药品(Multi-indication drugs)是指可用于预防、治疗、诊断、缓解或者辅助治疗多种疾病(状态)或者症状的药品。近年来,多适应证新药上市数量和上市后又获批新适应证的药品数量显著增加,2015年美国艾美仕医疗保健信息研究所(IMS Institute for Healthcare Informatics)的研究报告指出,2014年全球上市的抗癌药物中有50%以上可用于多种适应证,并预计这一比例到2020年末将增至75%[1]。在我国,也有越来越多的多适应证药品被纳入《国家基本医疗保险、工伤保险和生育保险药品目录》(以下简称“医保目录”)。在2017年通过国家医保药品谈判的36种药品中,有12种为多适应证药品[2];2018年补充纳入医保目录的17种抗癌药物中,也有10种为多适应证药品[3];而现行的2019年医保目录中成功通过国家谈判的97种药品中,多适应证药品则多达31种[4]。由此可见,多适应证药品在我国医保目录中逐渐增多。然而,我国尚未建立针对多适应证药品价值的支付标准调整机制,现行的医保支付也没有充分体现同一药品用于不同适应证的价值,大多数谈判药品仍然采用按服务付费的方式,其支付标准制定主要依据药品成本,对药品治疗效果的考察仅起参考作用[5-6]。由于同一药品用于不同类型疾病、患者亚组、治疗线数以及不同的联合用药情况均会产生不同的治疗成本以及健康产出,从而体现出不同的价值,而不以价值为基础考虑药品定价和医保支付,制药企业研发高价值新药或拓展药品高价值适应证时就无法得到与之投入相匹配的回报,长此以往,将不利于激发制药企业的创新性,也不利于患者的诊治。此外,我国目前还存在适应证扩增而药品采购价格维持不变,进而以采购价格为基准制定的医保支付标准也不变的情况。药品适应证增加可造成用药人群增加,在医保支付标准不变的条件下可引起医保基金支出的绝对增加,这将对医保基金安全产生一定冲击。随着越来越多的多适应证药品进入到目录调整和药品谈判工作中,加快这一领域的探讨与研究,对完善我国医保支付机制、促进医保基金基于药品价值合理支出将具有重要意义。有研究显示,价值定价(Value-based pricing,VBP)理念在于将药品价值整合到能反映其健康产出的药品价格中[7],其已经在多个国家受到重视并被应用于药品定价和医保支付政策中[8]。基于此,笔者拟借鉴VBP的思想理念,对目前将这一理念融入医保支付机制的典型国家(法国、德国、英国、意大利和瑞典)的医保支付策略进行介绍并提出相应建议,旨在为完善我国多适应证药品基于VBP的医保支付提供参考。
1 VBP理论
1.1 理论基础
VBP是在欧洲学者Christopher[9]于1982年提出的“Value-in-use Pricing”上逐步发展起来的,最初主要用于工业市场。此后,有不少学者对VBP在药品定价中的应用进行了研究:英国学者Claxton[10]将医药行业的VBP定义为“确保新药获益大于当前治疗成本的定价方法”;以色列学者Ben-Aharon等[11]和美国学者Bach等[7]指出,根据VBP制定的药品价格反映的是药品的增量健康获益;加拿大学者Husereau等[12]则指出,VBP的目的是更广泛地定义药品给社会带来的价值。基于上述诸多研究,目前已有不少国家将VBP纳入药品定价的考虑范畴,根据药品的价值进行医疗卫生资源的合理分配,力求最大限度地为患者和社会带来健康利益[8]。
1.2 VBP的实现流程
VBP的实现首先需要制定一个价值框架以明确如何确定价值[13]。根据Sussex等[14]学者的观点,价值框架的构建一般包含三步:(1)价值的定义。价值通常包括临床治疗需求的满足程度、患者存活率的提高情况、生命质量的改善情况、患者尊严的维护情况以及其他社会价值。(2)价值的测量。可以采用自然单位计量(如患者生存年数)、等级评估(如生命质量量表、临床治疗/附加治疗水平),以及简单二元描述(如满足了高程度/低程度的临床需求)等方式。(3)价值的整合。例如,可采用药物经济学或多元决策分析方法得到增量成本-效果比(Incremental cost-effectiveness ratios,ICERs),或采用价值整合权重法(如以药品的预期使用量为单一权重,或药品价值和使用量的组合权重),对药品在各适应证中的价值进行整合。
其次,通过建立模型将总价值转化为价格。转换方法取决于价值框架中价值的关键驱动因素:若以成本-效益(Cost-effectiveness,CE)为驱动因素,价格将通过ICERs和支付意愿阈值(Willingness-to-pay,WTP)或净货币效益来计算[15];若不以CE为驱动因素,价格将由药品较对照品而言的价值增益程度来决定[14]。通过价值转换得到的价格通常是药品在其各适应证上的基础价格,多适应证药品的医保支付标准最终会在基础价格的基础上通过价格谈判形成[11]。VBP的实现流程见图1。
2 基于VBP的多适应证药品医保支付的国际经验
经济合作与发展组织(Organization for Economic Cooperation and Development,OECD)曾在2013年对一些引入VBP理念的国家的卫生政策开展研究,包括法国、德国、英国、意大利和瑞典等,其结果表明,各国VBP整体思路较为一致,但具體的价值评估指标和医保支付策略存在一定差异[8]。
2.1 法国:基于预期使用量的单一加权法
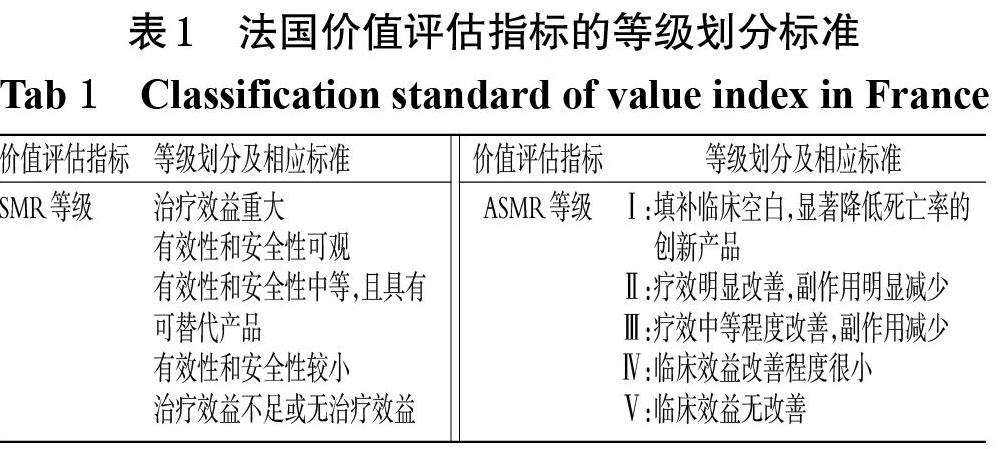
法国国家卫生局(HAS)负责对申请进入法定医保支付目录的药品开展评估,其下设的透明委员会(TC)具体负责评估药品在各适应证上的临床效益水平(Service médical rendu,SMR)和临床效益改善程度(Amélioration du service médical rendu,ASMR)[16]。其中,SMR等级侧重反映药品的有效性、安全性、所治疗疾病的严重程度、在治疗策略中的定位或替代治疗的可得性、临床表现或治疗类型(预防、治愈或缓解疾病)以及对公众健康的影响;ASMR等级则反映药品在各适应证上与现有治疗方案相比的临床改善程度[17]。法国价值评估指标的等级划分标准见表1。
一旦药品的SMR和ASMR等级得到确定,法国卫生服务产品经济学委员会(CEPS)将以此为价值基础与制药企業进行价格谈判,医保部门的支付比例也由此决定[主要划分为0(不报销)、35%、65%和100%(全部报销)4个等级[16]]。CEPS在价格谈判时会考虑如下几个因素:
(1)ASMR等级。TC负责筛选和指定谈判药品各适应证的对照药品和目标患者,并评估药品在各个适应证上的ASMR等级;然后,CEPS基于目标患者规模,以药品各适应证的预期使用量(Expected volumes)为权重计算加权平均价格作为医保支付标准;同时,CEPS还要求制药企业开展真实世界研究来记录一段时期内该药品的实际使用量,若实际使用量与价格谈判所用的预期使用量差异较大,支付标准将参考实际使用量重新计算权重[18]。
(2)欧盟参考国市场价格。法国CEPS规定,高ASMR等级(Ⅰ~Ⅲ)的药品价格需要与该药在德国、意大利、西班牙和英国市场中的价格进行比较。制药企业有权自主定价,但需提供价格不高于上述四国参考价均值的担保。担保价格为最高医保支付额[19],该价格的有效期为药品上市之日起的5年。若之后该药品获批具有高ASMR等级的新适应证,其有效期可延长1年。在这一机制下,ASMR等级高的多适应证药品在法国可以获得更长时间的最高医保支付标准。
(3)卫生经济学评估意见。从2013年开始,法国HAS对显著影响医保基金预算(年费用超过2 000万欧元)的药品开展卫生经济学评价,由HAS下设的经济评估和公共卫生评估委员会(CEESP)负责。CEESP提供被评估药品在不同价格下的ICERs,阈值设定为50 000~ 250 000欧元。然而目前尚无证据表明法国在进行卫生经济学评估时是否真的采纳了这一阈值,也无法明确CEESP评估结果对价格谈判的影响程度[20]。
2.2 德国:基于价值和使用量的组合加权法
德国卫生部(BMG)规定,2011年后进入德国市场的新药或药品新适应证受德国《医药行业改革法案》(AMNOG)监管,并需强制进行价格谈判[18]。制药企业首先需向联邦委员会(G-BA)提交药品价值评估申请,由G-BA指定药品各适应证的评估对照药品,并要求医疗质量和效率研究所(IQWiG)在收到申请的3个月内审查该药品各适应证的疗效证据,以评估其相较于对照药品的附加治疗效益,并发布评估报告。附加治疗效益一般根据全因死亡率、发病率、健康相关生活质量和不良反应等4个指标为主要判断标准划分为6个等级(具体见表2)[21]。之后,G-BA在评估报告公布的3个月内给出决议,明确该药品的附加治疗效益范围、符合治疗条件的患者群体、以及是否在国家级层面进行药品医保支付全覆盖。
德国药品的医保支付标准一般在药品上市后的第1年内确定。如果药品具有附加治疗价值,德国制药企业和联邦医疗保险基金协会(GKV-SV)将在6个月内进行价格谈判以确定支付标准;GKV-SV在进行价格谈判时会参考其对照药品的价格以及欧盟参考国的支付标准[21]。对于没有附加治疗价值且无法采用参考定价法(G-BA将药品划分为不同的参考价格组,并根据药品剂量、包装大小和市场占有率等确定各参考价格组的代表药品;代表药品的价格依据市场交易价等因素确定,同组其它药品的价格以代表药品价格为基础根据一定方法计算得到[22])定价的药品,则该药品的谈判目标为其年治疗费用不得超过对照药品的年治疗费用。
在德国,多适应证药品在各个适应证上的价值评估都将重复上述过程,最后由医保支付方综合考虑该药各适应证的附加治疗价值等级和使用量,采用组合加权法计算该药的医保支付标准[23]。2017年,Lauenroth等[24]分析了2011-2016年德国G-BA所评估的药品,结果显示,在通过价格谈判确定的支付标准中,除药品成本外,还包含反映药品各适应证附加治疗价值的溢价——当药品在降低病死率、发病率和不良事件发生率等方面具有附加价值时能获得较高溢价;没有附加治疗价值的适应证通常不会给药品带来溢价,制药企业也会因此减少或拒绝开发、注册这类适应证以避免药品价格下降。
2.3 英国:名义医保支付标准结合患者准入协议(PAS)法
英国药品价格受英国卫生部(DH)与英国制药工业协会(ABPI)签订的《药品价格规管计划》(Pharmaceutical Price Regulation Scheme,PPRS)管制。2007年,英国公平交易办公室(OFT)建议,根据VBP理念,药品价格应该根据其提供给患者的治疗价值进行定价[10]。PPRS 2014明确了广义药物经济学是该国VBP的基础,应从医患双重视角出发测算药品带来的质量调整生命年(Quality-adjusted life years,QALYs)和ICERs[25]。然而随着卫生技术评估的不断发展,PPRS 2014已被《品牌药品定价和获取自愿计划》(Voluntary Scheme for Branded Medicines Pricing and Access,VPAS)取代,英国对药品价值的定义也有了新的倾向性——QALYs不再是价值的唯一驱动因素,其他社会价值如提高社会生产力、鼓励医药创新等因素也应在药品定价过程中予以考虑[26]。
药品在英国(此处主要指苏格兰以外地区)获得上市许可后,其在各适应证治疗中的有效性、安全性和经济性将由国立临床规范研究所(NICE)进行评估,得出药品在各适应证上与对照药品相比的ICERs,若ICERs满足阈值(20 000~30 000英镑/QALY[26]),NICE则给出积极推荐建议,之后由国民卫生服务系统(NHS)同意支付药品的该项适应证,并为其设定一个NHS清单价格(NHS list price),该价格即为该药品的名义支付标准。对于NICE首次评估认为不具有CE的药品,制药企业可与NHS达成PAS以帮助患者尽早使用该药物治疗[27]。在苏格兰地区,上述事宜由苏格兰药品联盟负责[27-28]。
PAS包含基于财务(Financial based)的PAS和基于结局(Performance based)的PAS两种。在基于财务的PAS中,药品名義支付标准不变,但通过PAS给予折扣或退款后实际上会产生不同的净支付标准;而基于结局的PAS,其药品支付标准会根据证据的更新进行调整。最新版的VPAS 2019将PAS划分为简单机密折扣协议(Simple confidential discount PAS)和复杂协议(Complex PAS)两种,简单机密折扣协议主要指在名义支付标准基础上直接协定折扣标准;复杂协议则涉及退款协议、剂量上限协议(对药品使用剂量进行限制)和基于结局的协议(以药品治疗效果为准进行支付)等多种协议[26]。英国近年来的实践表明,简单折扣协议的使用逐渐呈主流趋势[29];VPAS 2019中也指出,简单折扣协议是制药企业向NHS提供具有CE价格的首选方式[26]。例如,2018年5月-2020年7月NICE在评估了阿特珠单抗(Atezolizumab)的6个适应证后,在其中4个适应证上与制药企业签订了简单折扣PAS[30-35]。
2.4 意大利:名义医保支付标准结合管理准入协议(MEA)法
意大利药品定价和医保支付由意大利药品管理局(AIFA)负责决策和管理,其下设的科学技术委员会(CTS)对制药企业申请医保支付的药品进行综合评估,评估内容涉及治疗价值、创新程度、对医保基金的影响、药物警戒数据、欧洲参考国价格、潜在患者数量以及预期销售量等多个方面。综合评估之后,AIFA会将药品划入无条件支付、预算影响管理、临床效益不确定性管理、效果优化管理和拒绝支付等5个医保支付层级。其中,处于预算影响管理、临床效益不确定性管理、效果优化管理层级的药品,AIFA将与制药企业进行价格谈判以确定支付标准,该支付标准的有效期通常为2年[36]。若已上市药品扩增了新的适应证且适用患者数量显著增加时,AIFA会要求制药企业进一步降价。此时,无论药品是否具有多个适应证,均有一个固定的名义价格,AIFA在名义价格的基础上考察该药品在各适应证上的治疗价值及其对医保基金预算的影响,进而与制药企业签订不同的MEA,以区分药品适应证间的净支付标准(名义价格减去各项折扣)。
与英国一样,意大利MEA主要划分为基于财务的MEA和基于结局的MEA,但执行过程不同。其中,基于财务的MEA的目的在于监测药品对医保基金预算的影响,适用于临床数据充分、CE明确,但对医保基金冲击较大的药品或适应证。该MEA包括患者个体水平的限量支付(Quantity cap)协议和限额支付(Budget cap)协议,患者群体水平的量价(Quantity-price agreement)协议和费用分担(Cost sharing)协议。基于结局的MEA的设立初衷在于应对临床效益和CE评估存在不确定性、贸然支付可能造成医保基金浪费的药品或适应证,包括风险分担(Risk sharing)协议——患者特定疗程无响应时执行折扣价格;成功后付费(Success fee)——先免费发放药品,治疗成功后向企业回顾性支付药品费用;按结果付费(Payment by results)——向治疗不响应者全额退还药品费用。相关学者的研究显示,当前意大利基于结局的MEA多用于抗癌药物领域[37]。药品获批多个适应证时,可以根据适应证实际情况签订多个协议,如贝伐珠单抗治疗结直肠肿瘤时使用风险分担协议,在治疗其他肿瘤适应证时则按结果付费[37]。
2.5 瑞典:不同适应证不同商品名的独立支付法
瑞典从2002年开始实行VBP,在全社会视角下采用药物经济学方法评估药品价值:药品价值=(WTP×QALYs的改善)+标准治疗方案的治疗成本-新药治疗成本或药品治疗新适应证的成本。瑞典并没有明文规定WTP,但是在肿瘤等严重疾病领域普遍接受的WTP为100万克朗/QALY[38]。
瑞典医保支付系统由瑞典牙科与药品福利局(TLV)执行。瑞典要求制药企业将多适应证药品分别以多个商品名上市,特定商品名对应特定适应证。例如,瑞士Novartis公司的依维莫司片(Everolimus)[39],商品名为“Certican”时用于预防器官移植后的排异反应,商品名为“Afinitor”时用于治疗胰腺源性神经内分泌癌、激素受体阳性晚期乳腺癌和进行性肾细胞癌,商品名为“Votubia”时则用于治疗结节性硬化症相关肿瘤;同时,不同商品名的依维莫司片规格不同,支付标准也不同,详见表3。
对于获得上市许可的药品,制药企业需要向TLV提供药品在某项适应证上的报价、价格合理性说明以及药物经济学证据,由TLV评估其是否符合瑞典道德平台(Ethical platform)规定的3项伦理原则,即人类价值原则(人人享有医疗保健)、需求与团结原则(医疗需求更迫切者有权获得更多的医疗资源)、CE原则(从医疗系统、人道主义和社会经济角度来看,成本必须是合理的)[40]。当TLV接受药品在该项适应证上的价格时,该适应证可被纳入瑞典药物福利计划予以支付;且一旦被纳入计划,则药品该适应证的终端价格不能随意更改,如果制药企业希望涨价或降价,需要再次向TLV申请并说明理由,获得TLV批准后才可变更。若被拒绝纳入药物福利计划,制药企业可以以更低的价格再次向TLV提出申请,或提出能够影响TLV决策的新证据。
2.6 英、法、德、意、瑞五国多适应证药品的医保支付策略比较
由上文分析可见,英、法、德、意、瑞五国多适应证药品的医保支付策略大体可以分为3类:(1)以各适应证的加权平均价为支付标准,代表国家为法国和德国。但不同的是,法国以药品各适应证的预期使用量为单一权重,而德国则综合考虑各适应证的附加治疗价值和使用量,采用组合权重的方式。(2)名义支付标准结合风险分担协议:医保支付方为多适应证药品制定一个名义支付标准,再结合药品在各适应证上的价值与制药企业签订协议以具体商议支付标准,代表国家为英国和意大利。但各国对风险分担协议具体命名不同,如英国为PAS、意大利为MEA,都主要分为基于财务的协议和基于结局的协议。(3)不同适应证不同商品名的独立支付法,代表国家为瑞典。瑞典允许制药企业将多适应证药品以多个商品名上市,特定商品名对应特定适应证,进而独立制定支付标准。此外,英国和瑞典主要以药物经济学方法测得的QALYs和ICERs为价值评估指标,法国、德国和意大利则更侧重于以药品的临床治疗价值和临床指标改善程度为评估指标。英、法、德、意、瑞五国多适应证药品的医保支付策略见表4。
3 国际多适应证药品医保支付策略对我国的启示
3.1 探索实行多适应证药品的价值定价方法
近年来,我国也在积极探索基于价值的医保支付,但更多关注的仍然是药品的量价关系。由上文分析可见,英、法、德、意、瑞五国更关注药品的临床效益和CE,并基于VBP理念,设置独立机构进行药品价值的评估测算,以保障医保基金用于购买药品的价格更能反映出药品的实际价值且更为科学合理。因此,建议我国重视VBP理念,明确定义药品的价值评估标准,构建相应的多适应证药品价值定价框架,设立专门的评估主体或评估机构负责评估药品在各适应证上的价值;同时,可通过法律法规等手段明确药品价值评估证据在国家医保目录调整和药品价格谈判中的作用,以保证药品价格的形成真正基于其临床治疗价值和社会经济价值,进而确定医保支付标准,以提高医保基金的使用效率,尽力做到有限医保基金资源的合理配置。
3.2 综合借鉴和使用多种医保支付策略
由上文分析可见,世界各国对药品价值评估指标的侧重不同,基于VBP的多适应证药品的医保支付策略也呈现出多元化的特点。我国可以根据多适应证药品进入医保目录的具体情形以及价值评估结果的确定性程度,综合借鉴和组合使用多种基于VBP的医保支付策略。例如,对于新纳入的多适应证药品支付标准的制定,以及目录内药品适应证扩增后支付标准的调整,可以借鉴法国和德国的支付策略,在明晰药品各适应证价值的基础上,根据目标患者规模来预测各适应证药品的相应用量,采用药品预期使用量单一加权或价值与使用量组合加权的方法来确定医保支付标准。药品投入使用后,要及时跟踪记录实际用量和疗效数据,若实际用量和疗效与支付标准制定时所用数据差异较大,也要及时基于实际数据进行调整。对于药品价值评估存在较大不确定性的,或ICERs超过WTP的药品适应证,则可以借鉴英国和意大利的支付策略,与制药企业签订基于财务或基于结局的相关协议,减少对医保基金预算的冲击,保障医保基金安全。因我国尚未出现制药企业以不同商品名上市同一药品不同适应证的情况,基于现行政策可以暂不考虑参考瑞典的支付策略。
3.3 完善患者及药品使用信息收集机制
充足的疾病信息、患者信息、药品用量以及真实疗效数据是实施上述多种医保支付策略的基础。如意大利自2006年就建立了可用于追溯的患者处方和账单信息,收集药品供应配送、患者疾病及健康随访等数据信息的全国患者在线注册系统。截至2016年,意大利已建成了127个基于适应证或治疗方案的患者注册中心,覆盖肿瘤、罕见病等多个领域[18]。AIFA拥有注册患者中心并追溯查阅相关信息的权力,被纳入医保支付药品的制药企业每年须向每个患者注册中心支付30 000美元的费用[41]。意大利全面的患者注册系统为MEA的实施提供了完善的信息基础,进而保障AIFA在实操层面针对不同适应证设定不同支付标准。然而,MEA的管理成本很高,2012年开始AIFA已将MEA管理业务外包给一家国际咨询公司,有报道显示,外包期3年费用约为870万欧元[42]。此外,英国NHS也强制实施了系统抗癌治疗数据集(Systemic anti-cancer therapy dataset),用于采集其所资助的所有实体肿瘤和血液恶性肿瘤患者的治疗信息[27]。我国也应大力发展和完善患者及药品使用信息收集机制,立足国家药品追溯制度收集药品流通、配送和销售情况,配合电子病历监测患者用药、实际治疗效果等数据,为实施多适应证药品VBP和医保支付策略提供信息支持。
4 結语
鉴于我国尚未建立针对多适应证药品价值的支付理念和支付标准调整机制,本研究基于VBP的理论基础和实现流程,分析和总结了法国、德国、英国、意大利和瑞典的药品价值评估指标和基于VBP的医保支付策略。建议未来我国应该重视VBP的思想理念,探索实行多适应证药品的VBP,借鉴各国基于VBP的多元化医保支付策略;同时,加快完善患者及药品使用信息的收集机制,为实现基于VBP的多适应证药品医保支付扫清数据障碍。
参考文献
[ 1 ] AITKEN M,BLANSETT L,MAWRIE R. Developments in cancer treatments,market dynamics,patient access and value[R]. New Jersey:IMS Institute for Healthcare Informatics,2015.
[ 2 ] 人力资源和社会保障部门.人力资源社会保障部关于将36种药品纳入国家基本医疗保险、工伤保险和生育保险药品目录乙类范围的通知:人社部发〔2017〕54号[Z]. 2017-07-13.
[ 3 ] 國家医疗保障局.国家医疗保障局关于将17种抗癌药纳入国家基本医疗保险、工伤保险和生育保险药品目录乙类范围的通知:医保发〔2018〕17号[Z]. 2018-10-10.
[ 4 ] 国家医疗保障局.国家医保局人力资源社会保障部关于将2019年谈判药品纳入《国家基本医疗保险、工伤保险和生育保险药品目录》乙类范围的通知:医保发〔2019〕65号[Z].2019-11-28.
[ 5 ] 艾丹丹,陈辰,吴婷婷,等.价值医疗背景下创新药品的定价和支付模式综述[J].中国卫生经济,2020,39(3):77-79.
[ 6 ] 申静静.药品价格形成机制与医保支付标准的研究[D].北京:首都经济贸易大学,2017.
[ 7 ] BACH PB,PERSON SD. Payer and policy maker steps to support value-based pricing for drugs[J]. JAMA,2015,314(23):2503-2504.
[ 8 ] PARIS V,BELLONI A. Value in pharmaceutical pricing[R]. Paris:OECD Health Working Papers,2013.
[ 9 ] CHRISTOPHER M. Value-in-use pricing[J]. Eur J Mark,1982,16(5):35-46.
[10] CLAXTON K. OFT,VBP:QED? [J]. Health Econ,2007,16(6):545-558.
[11] BEN-AHARON O,SHAVIT O,MAGNEZI R. Does drug price-regulation affect healthcare expenditures? [J]. Eur J Health Econ,2017,18(7):859-867.
[12] HUSEREAU DR,CAMERON CG. Value-based pricing of pharmaceuticals in Canada:opportunities to expand the role of health technology assessment[M].Ottawa:Canadian Health Services Research Foundation,2011:15-21.
[13] JOMMI C,ARMENI P,COSTA F,et al. Implementation of value-based pricing for medicines[J]. Clin Ther,2020,42(1):15-24.
[14] SUSSEX J,TOWSE A,DEVLIN N. Operationalizing value-based pricing of medicines[J]. Pharmacoeconomics,2013,31(1):1-10.
[15] MASON H,JONES-LEE M,DONALDSON C. Modelling the monetary value of a QALY:a new approach based on UK data[J]. Health Econ,2009,18(8):933-950.
[16] REMUZAT C,TOUMI M,FALISSARD B. New drug regulations in France:what are the impacts on market access:Part 1:overview of new drug regulations in France[J]. J Mark Access Health Policy,2013. DOI:10.3402/jmahp.v1i0.20891.
[17] SORENSON C,DRUMMOND M,KANAVOS P. Ensuring value for money in healthcare:the role of health technology assessment in the European Union[M]. Cornwall:MPG Books Ltd.,2008:85-100.
[18] FLUME M,BARDOU M,CAPSI S,et al. Feasibility and attractiveness of indication value-based pricing in key EU countries[J]. J Mark Access Health Policy,2016. DOI:10.3402/jmahp.v4.30970.
[19] GRANDFILS N. Working paper:drug price setting and regulation in France[EB/OL].(2008-09)[2020-12-17]. https://www.irdes.fr/EspaceAnglais/Publications/WorkingPapers/DT16DrugPriceSettingRegulationFrance.pdf.
[20] TOUMI M,MORTRUNICH A,MILLIER A,et al. Analysis of health economics assessment reports for pharmaceuticals in France:understanding the underlying philosophy of CEESP assessment[J]. J Mark Access Health Policy,2017. DOI:10.1080/20016689.2017.1344088.
[21] WENZL M,PARIS V. Pharmaceutical reimbursement and pricing in Germany[EB/OL].(2018-06)[2020-09-20].https://www.oecd.org/health/health-systems/Pharmaceutical-Reimbursement-and-Pricing-in-Germany.pdf.
[22] 常峰,崔鵬磊,夏强,等.德国药品参考价格体系对构建我国医保支付标准的启示[J].中国卫生政策研究,2015,8(7):55-60.
[23] NERI M,TOWSE A,GARAU M. Multi-indication pricing(MIP):practical solutions and steps to move forward[R]. London:Office of Health Economics,2018.
[24] LAUENROTH VD,STARGARDT T. Pharmaceutical pricing in Germany:how is value determined within the scope of AMNOG? [J]. Value Health,2017,20(7):927-935.
[25] Department of Health & Social Care. Pharmaceutical price regulation scheme 2014[EB/OL].(2013-12-03)[2020-09-20]. https://www.gov.uk/government/publications/pharmaceutical-price-regulation-scheme-2014.
[26] Department of Health & Social Care. The 2019 voluntary scheme for branded medicines pricing and access[EB/OL].(2018-12-05)[2020-12-06]. https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/761834/voluntary-scheme-for-brandedmedicines-pricing-and-access-chapters-and-glossary.pdf.
[27] TOWSE A,COLE A,ZAMORA B. The debate on indication-based pricing in the US and five major European countries[R]. London:Office of Health Economics,2018.
[28] PANTELI D,ARICKX F,CLEEMPUT I,et al. Pharmaceutical regulation in 15 European countries review[J].Health Syst Transit,2016,18(5):1-122.
[29] LEELA B. Patient access schemes:a look behind the scenes[EB/OL].(2015)[2020-09-20]. https://pharmaphorum.com/views-and-analysis/patient-accessschemes-a-look-behind-the-scenes/.
[30] National Institute for Health and Care Excellence. Technology appraisal guidance:atezolizumab for untreated PDL1-positive locally advanced or metastaticurothelial cancer when cisplatin is unsuitable[EB/OL].(2017-12-06)[2020-12-06]. https://www.nice.org.uk/guidance/ta492.
[31] National Institute for Health and Care Excellence. Technology appraisal guidance:atezolizumab for treating locally advanced or metastatic non-small-cell lung cancer after chemotherapy[EB/OL].(2018-05-16)[2020-12-06]. https:// www.nice.org.uk/guidance/ta520.
[32] National Institute for Health and Care Excellence. Technology appraisal guidance:atezolizumab for treating locally advanced or metastatic urothelial carcinoma after platinum-containing chemotherapy[EB/OL].(2018-06-13)[2020-12-06]. https://www.nice.org.uk/guidance/ta525.
[33] National Institute for Health and Care Excellence. Technology appraisal guidance:atezolizumab in combination for treating metastatic non-squamous non-small-cell lung cancer[EB/OL].(2019-06-05)[2020-12-06]. https://www.nice.org.uk/guidance/ta584.
[34] National Institute for Health and Care Excellence. Technology appraisal guidance:atezolizumab with nabpaclitaxel for untreated PDL1-positive,locally advanced or metastatic,triple-negative breast cancer[EB/OL].(2020-07-01)[2020-12-06]. https://www.nice.org.uk/guidance/ta639.
[35] National Institute for Health and Care Excellence. Technology appraisal guidance:atezolizumab with carboplatin and etoposide for untreated extensive-stage small-cell lung cancer[EB/OL].(2020-07-01)[2020-12-06]. https://www.nice.org.uk/guidance/ta638.
[36] JOMMI C,MINHRTTI P. Pharmaceutical pricing policies in Italy[M].Cham:Adis,2015:131-150.
[37] NAVARRIA A,DRAGO V,GOZZO L,et al. Do the current performance-based schemes in Italy really work:“Success fee”:a novel measure for cost-containment of drug expenditure[J]. Value Health,2015,18(1):131-136.
[38] SVENSSON M,NILSSON FOL,ARNBERG K. Reimbursement decisions for pharmaceuticals in Sweden:the impact of disease severity and cost effectiveness[J]. Pharmacoeconomics,2015,33(11):1229-1236.
[39] PERSSON U,NORLIN JM. Multi-indication and combination pricing and reimbursement of pharmaceuticals:opportunities for improved health care through faster uptake of new innovations[J]. Appl Health Econ Health Policy,2018,16(2):157-165.
[40] Tandv?rds-och L?kemedelsf?rm?ns Verket. PPRI pharma profile Sweden 2017[EB/OL].(2017-04)[2020-12-22].https://www.tlv.se/download/18.1d85645215ec7de284611-ebd/1510316381520/ppri_pharma_profile_sweden_2017.pdf.
[41] MESRRE-FERRANDIZ J,TOWSE A,DELLAMANO R,et al. Multi-indication pricing:pros,cons and applicability to the UK[R]. London:Office of Health Economics,2015.
[42] GARTTINI L,CURTO A,VANDEVOORENK. Italian risk- sharing agreements on drugs:are they worthwhile?[J].Eur J Health Econ,2015,16(1):1-3.
(收稿日期:2020-10-27 修回日期:2020-12-18)
(編辑:孙 冰)

