美国儿童药品上市审批情况分析及其对我国儿童用药保障工作的启示
王雅君 韩容 岳志华 许馨文 赵志刚
摘 要 目的:為完善我国儿童药品品种、保障儿童用药安全提供借鉴。方法:总结美国在儿童药品上市审批方面的政策法规历史沿革及相关政策实施效果;结合我国儿童药品发展现状,提出保障我国儿童用药可及性和安全性的相关建议。结果与结论:美国自1994年起就出台了一系列的政策法规以鼓励发展儿童药品,目前其儿童药品上市审批主要依据《最佳儿童药品法》(BPCA)和《儿科研究平等法》(PREA)两部法律。1998-2019年,美国药品说明书儿童用药信息的补充数量总体呈现波动性增长;截至2020年4月,已经有854种药品进行了儿科说明书的修改,其中792种药品进行了上市后儿科临床研究,其儿科说明书信息不全等问题得到了很大改善。目前,我国对儿童药品制定的政策主要包括鼓励研发创新、优先审评审批,以及加强研发技术指导等,虽取得了一定的成绩,但仍存在相关政策法规不完善、开展儿童药品临床试验困难较大等问题。建议我国借鉴美国儿童药品相关政策法规、儿科研究及儿童药品目录,建立和完善适合我国国情的儿童药品制度和目录,提高儿童药品的安全性、有效性和可及性。
关键词 儿童药品;上市审批;政策法规;美国;启示
ABSTRACT OBJECTIVE: To provide suggestions for improving the variety of pediatric drugs and ensuring the safety of pediatric drug use in China. METHODS: The historical evolution of laws and regulations on the marketing approval of pediatric drugs in the United States and the implementation results of relevant policies were summarized. Combined with the current situation of the development of pediatric drugs in China, some suggestions were put forward to ensure the accessibility and safety of pediatric drug use in China. RESULTS & CONCLUSIONS: Since 1994, the United States had issued a series of laws and regulations to encourage the development of pediatric drugs. At present, the marketing approval of pediatric drugs were mainly based on the two laws of Best Pediatric Drug Act (BPCA) and Pediatric Research Equality Act (PREA). From 1998 to 2019, the amount of supplements of pediatric drug information in drug instructions of the United States showed a fluctuating growth. As of April 2020, 854 kinds of drugs had been modified in pediatric instructions, 792 of which had been carried out post marketing pediatric clinical research, and the problem of incomplete pediatric instructions had also been greatly improved. At present, Chinas policies on pediatric drugs mainly included encouraging R&D innovation, giving priority to review and approval, and strengthening R&D technical guidance. Although certain achievements had been made, there were still some problems, such as imperfect policies and regulations, and great difficulties carrying out pediatric drug clinical trials. It is suggested that our country should draw lessons from the American regulations on pediatric drugs, pediatric research and the catalogue of pediatric drugs, and establish a system and catalogue of pediatric drug use suitable for Chinas national conditions, so as to improve the effectiveness, safety and accessibilityof pediatric drugs.
KEYWORDS Pediatric drugs; Marketing approval; Policy and regulation; the United States; Enlightenment
中图分类号 R95;R985 文献标志码 A 文章编号 1001-0408(2021)02-0133-06
DOI 10.6039/j.issn.1001-0408.2021.02.02
医学上,儿童是指0~14周岁的人群。目前,市场上儿童专用或者有比较详细的儿童用药安全信息的药品数量较少。儿童使用成人药品的现象较为普遍[1]。由于儿童正处于生长发育阶段,器官尚未发育完全,其肝脏代谢酶活性、肾脏清除率、血脑屏障情况、神经系统功能、脂肪含量、血容量等均与成人存在较大差异,且不同生长阶段的儿童对药物的代谢和清除能力也具有非线性的差异,不能简单地使用体质量来进行儿童剂量的等比例换算[2]。因此,儿童患者在使用成人药物进行治疗的过程中极有可能出现用药不适宜的情况,从而诱发药物不良事件。根据国内相关机构发布的《2016年儿童用药安全调查报告》数据显示,我国每年约有3万名儿童因用药不当而导致耳聋,给患者及其家庭造成了严重的伤害和负担[3]。
儿童作为一个特殊群體,其用药研究在伦理和技术方面都面临着巨大的困难,因此世界各国在进行临床试验时都避免纳入儿童患者,也由此造成了儿童药品安全性、有效性信息不全的局面。面对这一问题,欧美国家率先转变观念,由“避免临床试验来保护儿童”转变为“通过临床试验来保护儿童”[4],通过制定相应的政策法规,鼓励进行儿科研究,以完善儿童用药信息,保障其药物治疗的安全性和有效性,并根据相关研究成果进行药品的审评审批;而我国在儿科研究方面尚未建立相关制度。为此,本研究总结美国在儿童药品审批上市方面的政策法规历史沿革及相关政策实施效果,并结合我国国情和儿童药品的发展现状提出相关建议,以期为完善我国儿童药品品种、保障儿童用药安全提供借鉴。
1 美国儿童药品审批上市的政策与法规
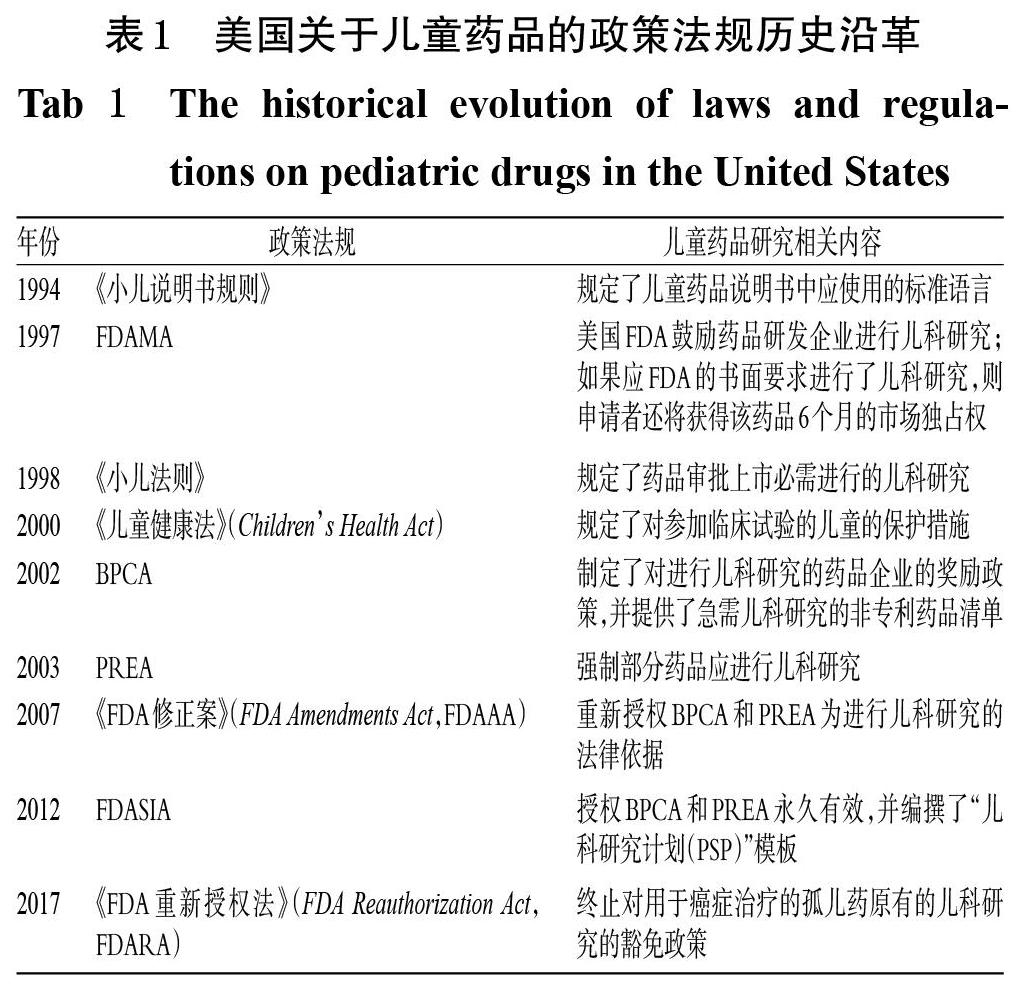
针对儿童药品品种不足的情况,美国率先采取立法的形式从根本上着力改善儿童药品的可及性和安全性问题。早在20世纪90年代,美国便陆续出台了一系列政策法规,如《小儿说明书规则》(The Pediatric Labeling Rule)、《FDA现代化法案》(FDA Modernization Act,FDAMA)、《小儿法则》(The Pediatric Rule)等。其中,FDAMA中明确提出了多项鼓励发展儿童药品的举措,更是首次提出了国家为制药企业开发儿童药品提供经济鼓励。为了促使更多的企业进行儿科研究,获取更多儿童用药的相关数据,美国又于2002年和2003年相继制定了《最佳儿童药品法》(Best Pharmaceuticals for Children Act,BPCA)和《儿科研究公平法》(Pediatric Research Equity Act,PREA)[5],且《FDA安全与创新法》(Food and Drug Administration Safety and Innovation Act,FDASIA)授权上述两法案长期有效[6]。此外,FDASIA还规定,研究者应当在新药研制的早期阶段就递交药品的初期研究计划,目的是在研制新药期间,尽早考虑未来能否适用于儿童,并根据计划开展同步的儿科研究。美国关于儿童药品的政策法规历史沿革[4]见表1。
目前,美国儿童药品审批上市的主要依据为BPCA与PREA。BPCA规定,对已向FDA提交有关儿童用药信息的药品,可额外授予其6个月的市场独占权[7],前提是满足以下条件:(1)该药品经美国FDA批准上市且保护期尚未结束,即6个月的市场独占权必须续加在该药品现有的专利保护期或其他独占保护期后面才能生效,相当于是对原有专利的保护或独占保护的延续;(2)药品生产企业依据PSP完成儿科研究并将研究报告提交给美国FDA,只要研究报告符合FDA的规定,无论最终的研究结果是否支持该药品应用于儿童;(3)研究报告的内容应包含不同种族儿童的使用效果;(4)药品生产企业对药品说明书的修改应在法定时间内获得美国FDA的批准。
另一方面,PREA要求,除特殊情况外[例如用于治疗仅在成年人中发生的疾病的药物或用于治疗罕见病的药物(孤儿药)等],具有新的有效成分、适应证、剂型、给药方案或给药途径的药物均必须在儿科人群中进行相关研究,批准的药品说明书中也必须包括适用于儿童的用法用量、安全性等内容。药品生产企业在Ⅱ期临床试验完成之后、Ⅲ期临床试验开始之前,需向FDA提交概述其PSP,FDA审查部门在与儿科审查委员会(PeRC)协商后,给出儿科研究的建议或要求。 PSP可以在药品上市许可之前开始,但实际上申请人通常会要求将儿科试验推迟到药品上市许可之后,以免影响或延误用于成人疾病治疗药物的批准。在儿科研究完成后,无论其是否在儿科人群中有效,药品说明书中均应添加儿科研究的结果。对于主要供儿童使用的药物,儿童以及青少年试验的相关数据可作为新药申请或生物制品许可申请的一部分进行提交;如果成人和儿童的病程和药物作用足够相似,则可以考虑从成人的临床试验中推论功效,但需在儿科人群中补充安全性数据和药动学数据;对于旨在治疗威胁生命或有严重伤害的疾病的药物,应在药物开发阶段尽早同FDA商讨PSP。总之,PREA规定,制药企业应尽早考虑儿童药品发展和评估计划。
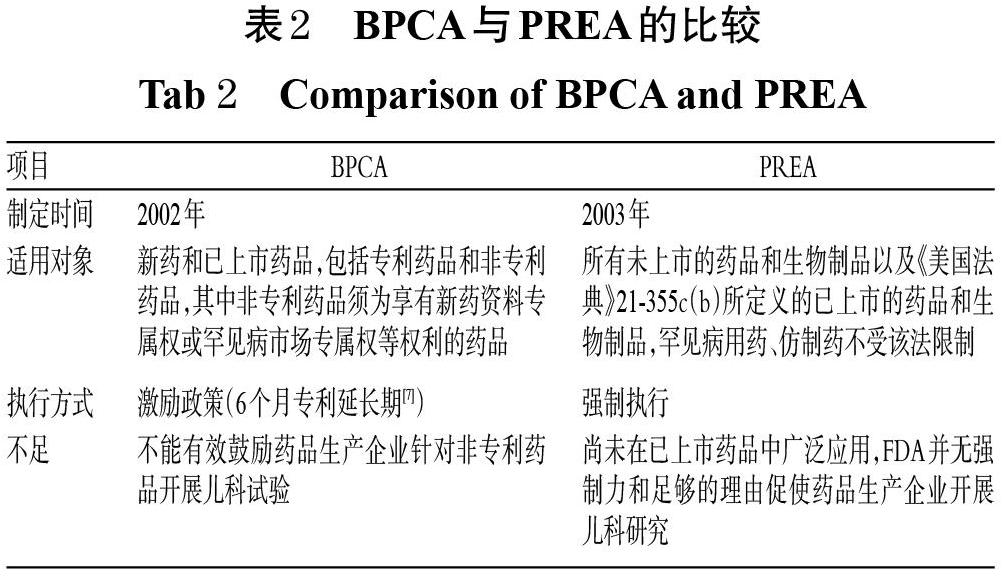
BPCA和PREA两部法规的目标都是促使药品生产企业研发儿童药品,提供新的儿童用药信息,完善药品说明书,为儿童患者选择合适的治疗药物提供参考和依据,但其适用对象和执行方式有所不同[4],详见表2。
由上述分析可见,BPCA和PREA两部法规使政府激励机制和企业义务实现了有机结合[8-9]。上述两部法规出台后,美国FDA又对其进行了更新和授权;除此之外,美国参加了国际人用药品注册技术要求协调委员会(ICH),并遵守其发布的《ICH E11儿科人群药物临床试验》指导原则,以加强国际间关于儿童用药的交流,共同促进儿童药品的研究和发展。
2 美国儿童药品相关政策实施的效果
美国一系列儿童药品相关政策的实施很大程度上促进了其儿童药品临床试验的开展和儿童药品说明书的修改和完善,增加了通过审批上市的儿童药品品种,为临床上儿童患者的治疗提供了更多的选择。
2.1 美国药品说明书中儿童药品信息补充数量显著上涨
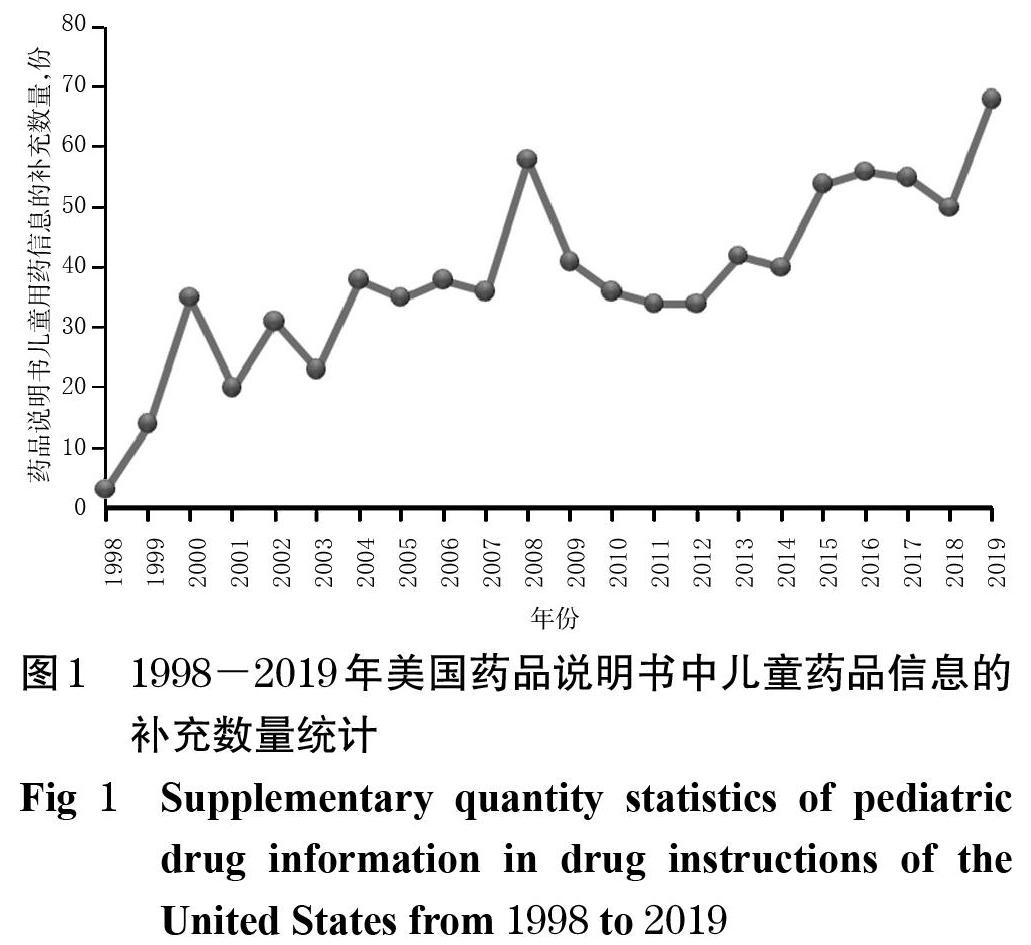
美国FDA官网显示,其药品说明书儿童用药信息的修改首次出现于1998年,其后总体呈现出波动上升的趋势,其中在2007年和2012年美国FDA对BPCA和PREA进行授权和更新之后,药品说明书儿童用药信息的补充数量呈现不同幅度的增长,极大地改善了儿童用药信息不全的局面。 1998-2019年美国药品说明书中儿童用药信息的补充数量统计见图1(因2020年尚无全年数据,故暂未统计)。
2.2 促进儿科研究的开展
据美国FDA发布的数据显示,2007-2012年,药品生产企业按照BPCA的要求开展的儿科研究总数为28项,按照PREA要求开展的儿科研究总数为105项,另有31项儿科研究同时按照BPCA和PREA的要求开展[10];2012年之后,相关研究快速發展,据美国FDA的统计显示,2012年1月-2020年4月,按照BPCA要求开展的儿科研究总数为55项,按照PREA要求开展的儿科研究总数为289项,同时按照BPCA和PREA要求开展的儿科研究总数为9项[11]。1998年1月-2020年4月,已经有854种药品说明书中的儿童用药部分被修改,其中多达792种(92.7%)药品在原有临床试验的基础上重新进行了新的儿科研究。在854种修改了说明书的药品中,各有199、475种药品分别按照BPCA和PREA的要求开展了相关临床研究,有131种药品同时按照BPCA和 PREA的要求开展了儿科研究,另有49种药品的说明书参照1998年出台的《小儿法则》进行了修改[12]。笔者发现,美国进行儿科研究并进行说明书补充的品种较多、覆盖范围较广,包括呼吸、消化、循环、免疫、泌尿系统用药以及诊断试剂等多种药品,其中排名前3位的是抗感染药、神经精神疾病用药和免疫系统用药,在抗感染药中又以抗病毒药最多(高达105种)。
美国出台的一系列举措促使药品生产企业和相关机构大力开展儿童用药的研究,进而使得大量药品说明书中的儿童用药信息得到补充和完善。这不仅有利于不同年龄儿童患者的精准用药,而且也有利于更新儿童给药方案、发现药品的新适应证等,进一步提高了儿童用药的安全性及有效性。例如,英国GlaxoSmithKline公司在阿昔洛韦注射剂(冻干粉)治疗疱疹病毒感染的新生儿患者的临床试验中发现,将治疗剂量由“每8小时10 mg/kg”更新为“每8小 时20 mg/kg”,其有效率更高、病死率更低。因此,美国FDA于2019年1月批准了该药说明书的更新;瑞士Roche公司在上市后发现,其生产的用于治疗儿童注意缺陷多动障碍的盐酸哌甲酯有造成4~6岁儿童体质量显著减轻的风险,且治疗收益并未高于安全风险,因此该公司于2019年6月将上述内容写入该药说明书[13]。
2.3 其他
美国FDA要求,药品生产企业开展儿科临床试验不仅要报告儿童用药的有效性和安全性信息,也要报告儿科临床试验中的无效信息,旨在避免或减少对患病儿童的无效治疗;同时,这些举措也在一定程度上丰富了儿科人群的适用剂型,也提高了美国儿童临床试验的参与率,从而有利于更多儿科试验的开展与实施。
3 我国儿童用药保障工作的现状分析
我国儿童用药保障工作相关政策的出台和实施相对较晚,虽取得了一定的成果,但同时也存在一些亟待解决的问题。
3.1 我国儿童用药保障工作的发展和成果
2003年,我国颁布《药物临床试验质量管理规范》首次将儿童纳入临床试验对象,为儿科试验的进行奠定了基础。随后在2011-2013年,我国相继出台了多项鼓励儿童药品研发的相关政策,旨在加快具有临床试验数据支持的儿童药品的注册申请审评。2014年,国家卫生计生委等六部委共同印发了《关于保障儿童用药的若干意见》,为保障儿童基本用药需求、促进儿童用药安全科学合理使用以及儿童药品的发展指明了方向。后续几年,国家频频出台多项政策,先后成立了儿童用药专家委员会,以指导儿童药品的审批及使用;要求医疗机构配备儿童药品,增加儿童用药的可及性;对儿童药品实施优先审评审批等,陆续制定了3批鼓励研发申报儿童药品清单,以鼓励我国儿童药品的研发与试验,促进我国儿童药品行业的快速健康发展。2020年最新版的《药物临床试验质量管理规范》中又特别强调了对儿科临床试验中儿童受试者的保护。一系列政策的出台,充分彰显了我国政府部门鼓励研发申报儿童药品的决心和力度,也使我国儿童药品的行业发展目标更加具体。近年来出台的我国儿童药品保障工作相关的政策与法规见表3。
目前,我国对儿童药品制定的政策主要为:鼓励研发创新、优先审评审批,该政策体现在上述多部法律法规中。根据国家药品监督管理局发布的报告,2016-2019年我国共有106种药品进入优先审批流程,其中有21种儿童药品通过优先审批上市[14](其数量统计如表4所示),这在一定程度上缓解了我国临床儿童药品不足的困境。
鉴于儿童在不同发育阶段的特殊性,为规范儿童药品的研究,除上述法律法规外,国家层面也较为重视加强对儿童药品研发技术的指导,先后发布了多部技术指南[15],如《儿科人群药代动力学研究技术指导原则》和《儿科人群药物临床试验技术指导原则》。此外,科技部等部门还统筹考虑了国家级科研基地中是否需要布局儿童药品临床试验基地、不良反应监测中心等,中央财政也结合具体情况给予了相应支持,符合国家相关税收条件的儿童药品研发生产企业,还可享受相应的税收优惠政策[16]。
另外,为深化医疗改革,进一步做好儿童药品保障工作,促进儿童适宜品种、剂型、规格的研发创制和申报审评,满足儿科临床用药需求,国家卫生健康委员会、工业和信息化部、国家药品监督管理局组织专家先后制定了3批鼓励研发申报儿童药品清单,共计106个药物品种,覆盖了神经精神疾病、内分泌疾病、感染以及肿瘤等多种疾病[17-18]。为方便儿童用药,提高儿童患者的接受性和依从性,这3批清单中口服液体制剂最多,共46种,占总数量的43.40%,如华法林口服混悬液、地西泮口服液等;此外还有颗粒剂、散剂等适用于儿童的剂型,体现了我国关于儿童用药的保障不仅重点考虑增加儿童药品品种,还考虑到了儿童药品的剂型、剂量以及方便使用等问题。
3.2 我国儿童用药面临的问题和相关建议
随着国家一系列鼓励政策的出台,我国儿童药品品种逐渐增多,为儿童疾病的临床治疗提供了更多、更安全的选择,但是我国儿童药品还存在着剂型规格缺乏、超说明书用药、不良反应发生率高、药品说明书儿童用药的相关信息缺失率较高等问题[19]。我国可通过借鉴美国儿童药品审批上市的先进经验,促进儿童药品的发展和完善。
3.2.1 完善相关政策法规体系 在儿童药品方面,美国取得的成绩与其相关的政策法规密切相关,鼓励政策和强制实施并存的方式更有利于儿童药品相关研究的开展。目前,我国制定的相关政策均为鼓励政策,以起到激励药品研发企业的作用,但是仍然需要配套适当的强制措施才能从根本上有力促进儿童药品的研发。我国可根据基本国情,以美国的PREA为参考制定强制性的开展儿童药品研发的相关政策,完善政策法规体系。
3.2.2 促进开展儿童药品临床试验 开展和推进儿童药品临床试验是儿童药品研发的关键环节,由于儿童受试者招募困难、风险高、配合度低、伦理问题复杂以及技术不成熟等,致使开展儿童药物临床试验仍存在较大困难[20],这不仅仅是我国面临的困难,也是世界各国共同的难题;此外,目前我国可进行儿童试验的机构较少,儿童研究的难度进一步增大。又由于儿童特殊的生理病理特点、病程进展、药物吸收-分布-代谢-排泄过程、依从性等与成人不同,需要特殊的配方、剂型、甚至口味,儿童药品研发成本比普通药品明显增高[21]。面对上述问题,我国可加快完善儿童药品管理条例,从法律法规层面对儿童药品的研发、生产、临床试验、说明书管理等方面作出明确规定,出台一系列指导儿童药品研发及注册指南等;成立儿童药品审评委员会,给予技术方面的咨询、建议、沟通等支持;政府还可以采取定向采购、财政资助等措施提高药品研发企业的积极性,引导儿童药品的研发和儿科试验的进行。
美国对854种药品说明书中儿童用药内容的更新与补充使得儿童可用药品的数量增长,使得儿童用药的安全性得到了进一步保障,且美国儿科研究保持了很高的透明度,公开了研究结果等数据信息,为其他国家儿童药品的研发、试验提供了宝贵的经验;但是,美国PREA要求所有藥品进行儿科试验以完善药品信息,这使得药物的研发成本有所提高。为了使有限的临床试验资源得到充分利用,我国可建立儿童临床用药的综合评价体系和临床数据库,制定需要进行儿科试验的药品目录,对目录中的药品强制进行儿科研究并完善说明书中的儿童用药相关信息;也可建立儿童药品研发或儿科试验的资源共享平台,一方面可减少不必要的研究,避免资源的浪费,另一方面也便于有关部门对试验过程及结果进行监督,保障研究的质量和可信度。我国在制定儿童药品优先审核目录和审评时,也可将美国的儿童药品目录及儿科试验结果作为参考。
3.2.3 其他 为尽早缓解目前儿童药品品种短缺的问题,我国可考虑通过进口国外儿童药品以满足我国儿童患者的治疗需求。建议相关部门尽快商讨儿童药品的进口是否可制定相应的优先审批政策,加快药品审批速度,尽早惠及我国儿童患者。
4 结语
儿童药品的安全性、有效性、可及性等问题在药品的研发、上市、供应、使用的整个环节都应被重视。为了提高现有儿童药品的可及性,近期国家卫生健康委员会相关专家在《关于政协十三届全国委员会第二次会议第0914号(社会管理类088号)提案答复的函》[22]中表示,将积极开展基本药物目录的评估,对新审批上市、疗效较已上市药品有显著改善且价格合理的儿童药品,适时启动调入程序,将安全性能高、价格适宜的儿童药品增加到国家基本药物目录和医保目录中,以提高药品生产企业的积极性,引导儿童药品研发和生产,更好地满足儿科临床用药需求,提升我国儿童用药水平,维护儿童健康权益。此外,在药品使用过程中,健全儿童药品不良反应监测体系,加强对包括儿童药品在内的药品不良反应监测及药品安全性再评价工作,对发现的儿童药品严重不良反应进行及时分析、评价也是确保儿童用药安全的重要环节。
美国儿童药品的发展领先于我国,我国可借鉴其相关政策法规、儿科研究及儿童药品目录,建立和完善适合我国国情的儿童药品制度和目录,提高我国儿童用药的安全性、有效性和可及性。
参考文献
[ 1 ] MURTHY S,MANDL KD,BOURGEOIS F. Analysis of pediatric clinical drug trials for neuropsychiatric conditions[J]. Pediatrics,2013,131(6):1125-1131.
[ 2 ] GUIMAR?ES M,STATELOVA M,HOLM R,et al. Biopharmaceutical considerations in paediatrics with a view to the evaluation of orally administered drug products:a PEARRL review[J]. J Pharm Pharmacol,2019,71(4):603-642.
[ 3 ] 广州标点信息股份有限公司. 2016年儿童用药安全调查报告[EB/OL].(2016-09)[2020-09-09]. https://www.menet. com.cn/report/201711/201711171730333033_136488.shtml.
[ 4 ] BAUM VC,BAX R,HEON D,et al. Pediatric drug regulation:international perspectives[J]. Paediatr Anaesth,2019, 29(6):572-582.
[ 5 ] PFLIEGER M,BERTRAM D. Pediatric drug development:ICH harmonized tripartite guideline E11 within the United States of America,the European Union,and Japan[J]. Arch Pediatr,2014,21(10):1129-1138.
[ 6 ] THOMSEN M. Global pediatric drug development[J]. Curr Ther Res Clin Exp,2019. DOI:10.1016/j.curtheres.2019. 02.001.
[ 7 ] RIVERA DR,HARTZEMA AG. Pediatric exclusivity:evolving legislation and novel complexities within pediatric therapeutic development[J]. Ann Pharmacother,2014,48(3):369-379.
[ 8 ] BUCCI-RECHTWEG C. Enhancing the pediatric drug development framework to deliver better pediatric therapies tomorrow[J]. Clin Ther,2017,39(10):1920-1932.
[ 9 ] KUEHN BM. Laws boost pediatric clinical trials,but report finds room for improvement[J]. JAMA,2012,307(16):1681-1682.
[10] FDA. Reviews of pediatric studies conducted under BPCA and PREA from 2007-2012[EB/OL].(2018-08-17)[2020- 09-09]. https://www.fda.gov/drugs/development-resources/ reviews-pediatric-studies-conducted-under-bpca-and-prea- 2007-2012.
[11] FDA. Reviews of pediatric studies conducted under BPCA and PREA from 2012-present[EB/OL].(2020-08-24)[2020-09-09]. https://www.fda.gov/drugs/developmentre- sources/reviews-pediatric-studies-conducted-under-bpcaand-prea-2012-present.
[12] FDA. New pediatric labeling information database[EB/OL].(2020-04-30)[2020-09-09]. https://www.accessdata.fda.gov/scripts/sda/sdnavigation.cfm?sd=labelingdatabase.
[13] 岳志華,王晓玲,张伟,等.美国儿童用药法规、实施成效及启示[J].临床药物治疗杂志,2020,18(9):83-87.
[14] 国家药品监督管理局. 2019年度药品审评报告[EB/OL].(2020-07-30)[2020-09-09]. https://www.nmpa.gov.cn/yaopin/ypjgdt/20200731114330106.html.
[15] 李丰杉,余勤.儿童用药研发及儿科临床试验的国际发展和国内现状[J].中国新药杂志,2020,29(17):1933-1938.
[16] 国家药品监督管理局.对十三届全国人大一次会议第3565号建议的答复:关于大力支持儿童专用药、儿童专用医疗器械研发的建议[EB/OL].(2018-07-16)[2020-11-30]. https://www.nmpa.gov.cn/zwgk/jyta/rdjy/20180716182901747.html.
[17] THABET Y,KLINGMANN V,BREITKREUTZ J. Drug formulations:standards and novel strategies for drug administration in pediatrics[J]. J Clin Pharmacol,2018,58(S10):S26-S35.
[18] VAN RIET-NALES DA,SCHOBBEN AF,EGBERTS TC,et al. Effects of the pharmaceutical technologic aspects of oral pediatric drugs on patient-related outcomes:a systematic literature review[J]. Clin Ther,2010,32(5):924-938.
[19] 许淑红,张绮,张林琦,等.探讨我国儿科用药的发展现状及政策层面的思考[J].中国临床药理学杂志,2020,36(12):1760-1767.
[20] WU W,TANG Z,CHEN J,et al. Pediatric drug development in China:reforms and challenges[J]. Pharmacol Res,2019. DOI:10.1016/j.phrs.2019.104412.
[21] 吴娟,张顺国,黄诗颖,等.儿童药物临床试验的发展及现状[J].医药导报,2018,37(1):74-77.
[22] 国家卫生健康委员会.关于政协十三届全国委员会第二次会议第0914号(社会管理类088号)提案答复的函[EB/OL].(2020-09-14)[2020-12-15]. http://www.nhc.gov.cn/wjw/tia/202009/9f90aca23fc74a62964d23482f800e7e.shtml.
(收稿日期:2020-09-14 修回日期:2020-12-24)
(编辑:孙 冰)

