Fe3O4-TiO2复合材料的制备及光催化降解四环素的研究
韩琪,汪恂,朱雷,顾晓雪,刘显
(武汉科技大学 城市建设学院,湖北 武汉 430065)
随着药品和个人护理品(PPCPs)的大量使用,其在水环境中的残留已成为了一个突出的环境问题[1-4],四环素作为PPCPs的一种,由于能抑制细菌生长,导致活性污泥法、生物膜法等传统的污水处理方法无法高效将其去除,而光催化技术能够解决这一问题[5]。其中TiO2作为一种光催化剂,具有绿色经济、性质稳定、无毒无害等优点,但自身在紫外光照下所产生的光生载流子易复合[6-7],而Fe3O4具有较好的导电性[8],可以作为电子受体,快速接受并传递电子,抑制光生电子与空穴复合[9],提高催化剂活性。本实验制备了Fe3O4-TiO2复合材料,探究其光催化降解四环素的性能并研究不同因素对降解率的影响。
1 实验部分
1.1 材料与仪器
钛酸正四丁酯、冰乙酸、无水乙醇均为分析纯;纳米四氧化三铁、超纯水均为自制。
HJ-6A型多头磁力搅拌器;KQ-500V型超声仪;HH-4型恒温水浴锅;YZ-GHX-A型光化学反应仪;TG16-WS型台式高速离心机;力辰pH-10型pH测试仪;FA2104S型分析天平;GXZ-9070MBE型恒温鼓风干燥箱;SDLA-B-0501-P型圣德利超纯水机;UV-6100S型紫外可见分光光度计;X′Pert PROX射线衍射仪;ESCALAB 250Xi光电子能谱仪;FEI Tecnai F20 S-TWIN透射电子显微镜;Micromerities ASAP 2020比表面积和孔径分布测试仪。
1.2 Fe3O4-TiO2光催化材料的制备
1.2.1 纳米Fe3O4的制备 采用共沉淀法制备纳米Fe3O4,将FeCl3·6H2O与FeCl2·4H2O以2∶1的物质的量之比溶于去离子水中,80 ℃水浴加热后迅速加入氨水至溶液呈黑色粘稠状,以保鲜膜封口并继续搅拌2~3 h,用吸铁石吸引黑色磁性材料至固液明显分离,先后使用去超纯水和无水乙醇洗涤黑色沉淀物至中性,干燥即得纳米Fe3O4。
1.2.2 Fe3O4-TiO2的制备 将10 mL钛酸正四丁酯、30 mL无水乙醇及5 mL冰乙酸混合得液体B。称取适量的纳米Fe3O4超声分散于无水乙醇中,并加入1 mL去离子水制得棕色悬浮液A。将A缓慢滴加至B中,充分搅拌2 h后放入水浴锅中恒温陈化得凝胶,并置于恒温干燥机中,干燥后研磨成粉,并放入马弗炉中以500 ℃煅烧2 h,即得质量比m(Fe3O4)∶m(TiO2)为2.5%的Fe3O4-TiO2复合光催化材料。

1.3 光催化性能的测试
称取20 mg四环素粉末倒入装有去离子水的烧杯中,搅拌并超声使其完全溶解后倒入1 L的容量瓶中,继续加入去离子水直至凹液面余容量瓶刻度线重合,摇匀后即得浓度为20 mg/L的四环素溶液。准确量取60 mL已配制的溶液作为反应的目标溶液,倒入装有磁子和60 mg Fe3O4-TiO2的石英玻璃管中,并置于岩征光反应仪中,先暗反应45 min(根据预演实验,暗反应45 min时,基本已达吸附-脱附平衡),然后打开光强为980 μW/cm2的紫外灯,每隔20 min对上清液进行取样并离心2次,将离心后的上清液置于紫外可见分光光度计中,并在特征波长λ=356 nm处读取吸光度值At,再根据Lambert-Beer定律,求得四环素的去除率:
η=(A0-At)/A0×100%
(1)
式中,A0和At分别为四环素溶液的原始吸光度值和紫外光照t时间的吸光度值。根据η的变化来探讨Fe3O4-TiO2去除四环素的性能。
1.4 催化剂的表征
采用X射线衍射仪对样品进行物相分析,采用XPS对样品进行定性及半定量分析,确定材料中可能存在的元素,采用比表面积和孔径分布测试仪对样品进行形貌分析,采用扫描电子显微镜观察样品微观形貌结构。
2 结果与讨论
2.1 Fe3O4含量的影响
本次实验合成质量比m(Fe3O4)∶m(TiO2)为0,1.5%,2.5%,3.5%这4种配比的Fe3O4-TiO2进行反应,结果见图1。
由图1可知,暗环境下Fe3O4-TiO2相较于纯TiO2在吸附性能上都有提升,这可能是因为Fe3O4对TiO2的改性,使其产生了更多的孔结构;打开紫外灯后Fe3O4-TiO2相较于纯TiO2有更好的光催化能力,其中m(Fe3O4)∶m(TiO2)=2.5%的Fe3O4-TiO2光催化降解四环素效果最佳,60 min可达91.06%,此时纯TiO2为56.49%,去除率较纯TiO2提高了1.61倍,这可能是因为Fe3O4对TiO2的改性,使能够更加有效地吸收利用紫外光;同时由于Fe3O4具有良好的导电性,可以作为电子受体材料,在光催化的过程中快速地接受并传递光生载流子,提高光生载流子的利用率,从而提高TiO2的活性。因此,Fe3O4-TiO2的最佳比为m(Fe3O4)∶m(TiO2)=2.5%。

图1 Fe3O4含量对光催化的影响Fig.1 Effect of Fe3O4 doping on photocatalysis
2.2 催化剂投加量的影响
分别称取20,40,60,80 mg的2.5% Fe3O4-TiO2,光反应60 min后结果见图2。
由图2可知,加入60 mg 2.5% Fe3O4-TiO2时四环素的去除效果最好,60 min可达91.06%,这可能是因为随着投加量的增加,同等条件下能让更多的污染物与2.5% Fe3O4-TiO2接触并且在紫外光照下能产生更多的活性物质,使去除效果增强。加入80 mg 2.5% Fe3O4-TiO2时去除效果反而降低,这可能是因为过多的2.5%Fe3O4-TiO2使反应溶液浑浊,透光性能下降,导致催化剂对紫外光的吸收减弱,从而降低了对四环素的去除效率。因此, 2.5% Fe3O4-TiO2的最佳投加量为60 mg。
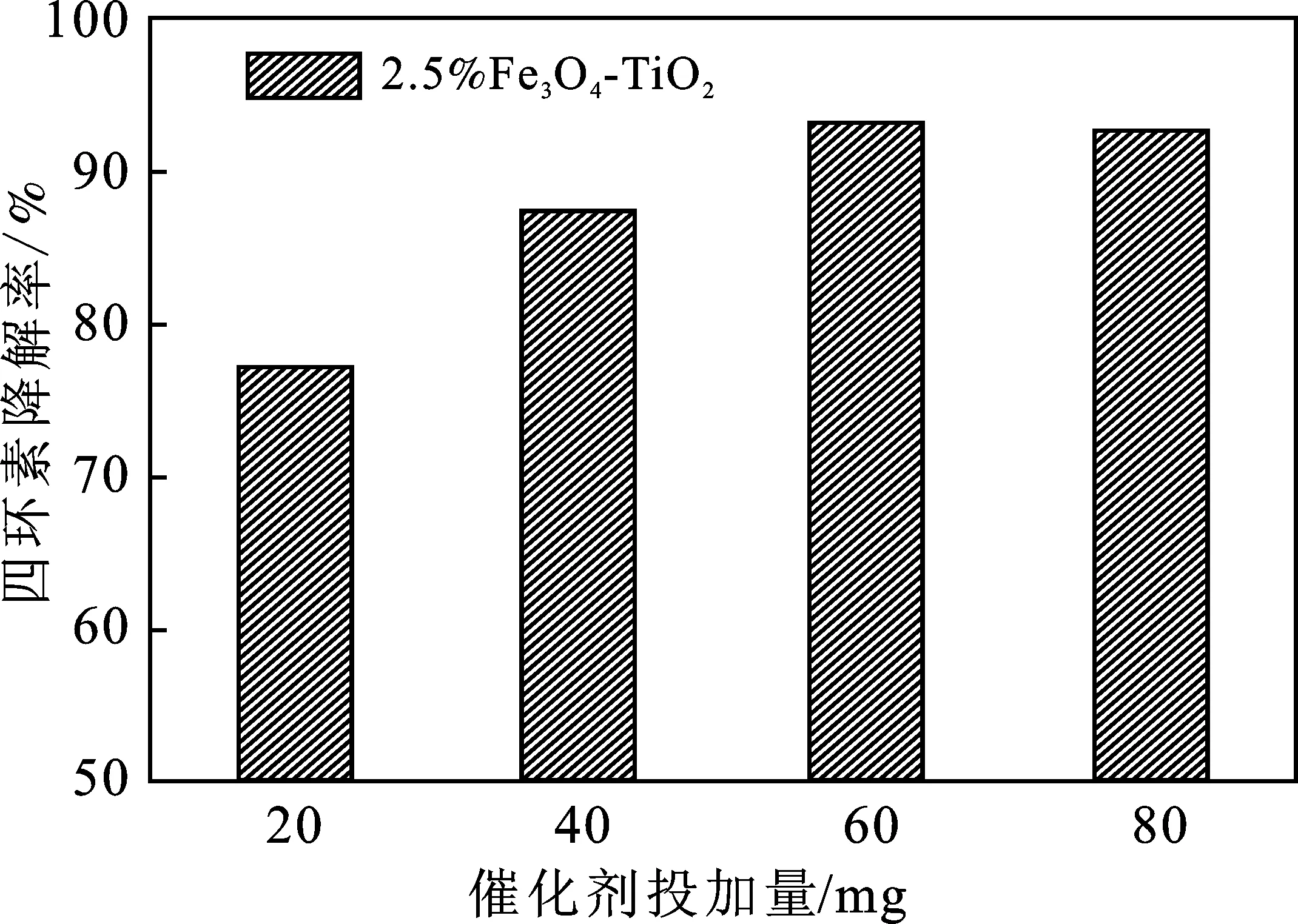
图2 催化剂投加量的影响Fig.2 Effect of catalyst dosage
2.3 反应溶液pH的影响
本次实验调节pH=3,5,7,9进行光催化实验,光反应60 min后结果见图3。

图3 不同pH条件下光催化降解曲线Fig.3 Effect of different pH on photocatalysis
通过图3对比发现,pH=7时四环素溶液的光催化去除率最高,这可能是因为在酸性环境中TiO2带正电荷,在碱性环境中带负电荷,而四环素是一种两性分子,在水溶液中存在3个电离平衡常数,分别为pKa1=3.30,pKa2=7.68,pKa3=9.68,pH<3.3,溶液中的四环素分子主要带正电荷,pH处于3.3~7.7,溶液中四环素分子主要以中性分子存在,pH>7.7,溶液中四环素分子主要带负电荷[10-12]。当溶液处于弱酸性或中性时,由于静电作用,四环素分子能够更好地与催化剂接触,并被催化剂表面的光生空穴氧化分解为小分子物质。
2.4 活性物种淬灭实验


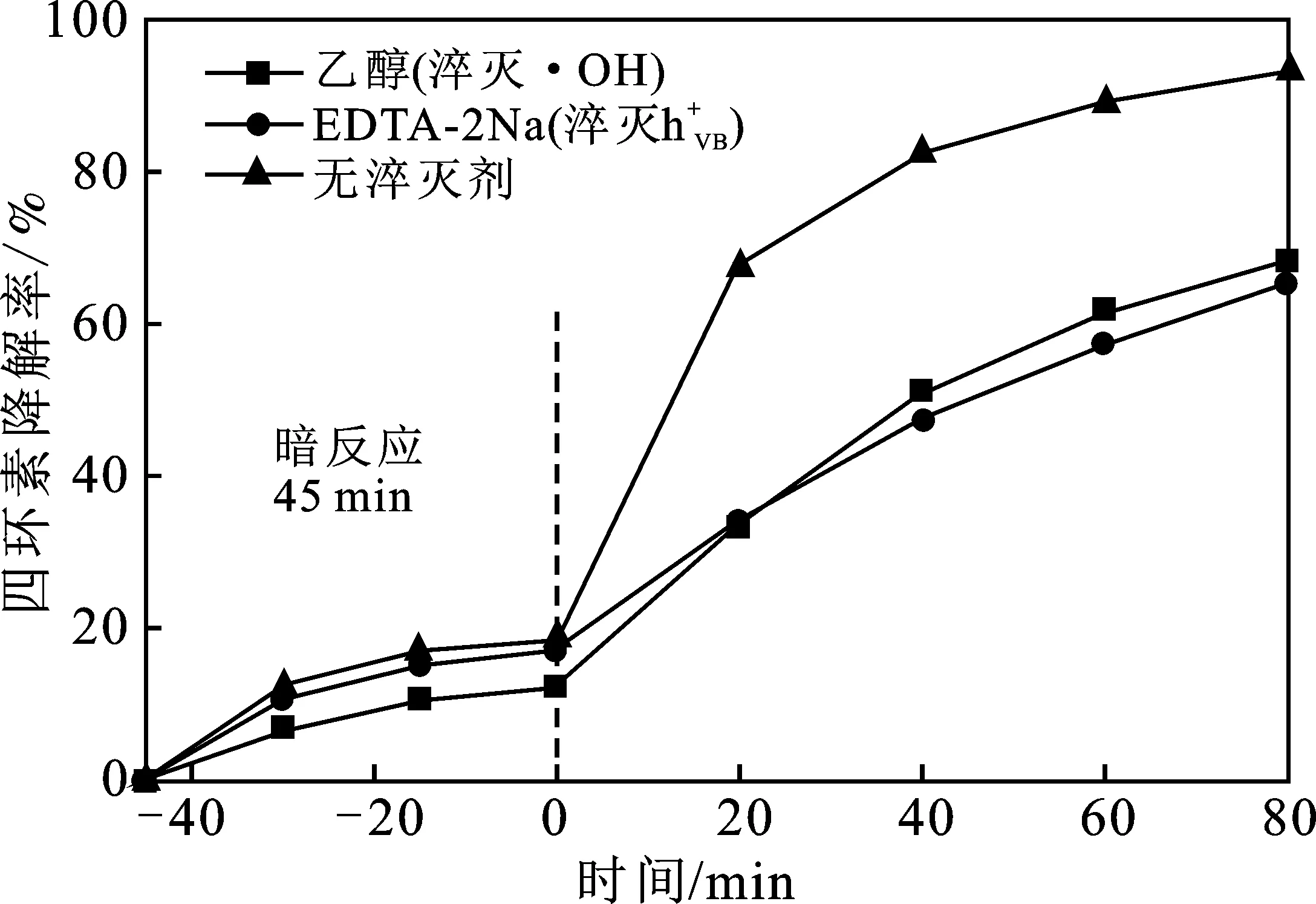
图4 活性物种淬灭实验Fig.4 Active species quenching experiment
2.5 催化剂的表征
2.5.1 XRD表征分析 图5为TiO2和2.5% Fe3O4-TiO2的X射线衍射图谱。

图5 TiO2和2.5% Fe3O4-TiO2复合材料的XRD图谱Fig.5 XRD patterns of TiO2 and 2.5% Fe3O4-TiO2 composite
由图5可知,TiO2和2.5% Fe3O4-TiO2在2θ=25.3,37.8,48.2,53.8,62.7 °的衍射峰与锐钛矿TiO2标准卡片(PDF 21—1272)相吻合,可以归属于锐钛矿TiO2(101)、(004)、(200)、(105)及(204)晶面,说明Fe3O4的加入并未改变TiO2的晶型,2.5% Fe3O4-TiO2的XRD中无Fe3O4的特征衍射峰出现,这可能是因为Fe3O4掺杂量较低,且钛酸正四丁酯发生水解缩合反应时形成的TiO2逐渐将Fe3O4包覆,导致未能检测出来。Fe3O4的复合使得TiO2的特征峰强度减弱,通过Scherrer公式计算可得纯TiO2和2.5% Fe3O4-TiO2的平均粒径分别为21.4,18.5 nm,说明纳米Fe3O4与TiO2复合抑制了TiO2晶粒的形成,导致平均粒径减小。
2.5.2 XPS表征分析 图6a为2.5% Fe3O4-TiO2的XPS扫描全图谱。




图6 2.5% Fe3O4-TiO2复合材料XPS图谱Fig.6 2.5% Fe3O4-TiO2 composite XPS map
由图6可知,2.5% Fe3O4-TiO2中明显含有O和Ti这两种元素,Fe元素峰值不明显可能是因为Fe3O4掺杂量太少,并且被TiO2包裹覆盖,图中结合能为285,459,530,710.5 eV处的能谱峰分别表示C1s、Ti2p、O1s、Fe 2p四种元素;图6b为Fe2p分图谱,其中结合能为710.9,724.9 eV处的峰分别表示Fe2p3/2和Fe2p1/2铁元素两种不同的外部电子结构[14],这与Fe3O4的电子图谱一致,说明2.5% Fe3O4-TiO2复合材料中Fe元素以Fe3O4的存在;图6(c)为Ti2p分图谱,图中结合能为458.6 eV和464.3 eV 的两处峰分别表示Ti2p3/2和Ti 2p1/2,表明2.5% Fe3O4-TiO2中Ti元素主要以Ti4+形式存在;图6d为O1s分图谱,其中结合能为530.57 eV与晶格氧530.0 eV接近,531.90 eV与吸附氧的532.42 eV 接近[15]。综上所述,Fe3O4与TiO2成功复合。
2.5.3 BET表征分析 图7为纯TiO2与2.5% Fe3O4-TiO2的N2吸附-脱附等温曲线。

图7 TiO2和2.5% Fe3O4-TiO2的N2吸附-脱附等温曲线Fig.7 N2 adsorption desorption isotherms of TiO2 and 2.5% Fe3O4-TiO2
由图7可知,纯TiO2与2.5% Fe3O4-TiO2的N2吸附-脱附曲线中都出现了回滞环,属于等温线中的Ⅳ型,同时,滞留回环的闭合点在P/P00.4~0.5之间,说明纯TiO2与2.5% Fe3O4-TiO2中存在大量介孔,有利于将污染物吸附到表面。其中纯TiO2属于H2型回滞环,复合材料属于H1型回滞环,说明2.5% Fe3O4-TiO2中的孔在材料中分布均匀,Fe3O4在TiO2中分散良好。
图8为纯TiO2与2.5% Fe3O4-TiO2的BJH孔径分布曲线。
由图8可知,两种样品的孔径主要分布在2~15 nm之间,属于介孔的范围,其中纯TiO2和2.5% Fe3O4-TiO2的BET比表面积为18.01,29.55 m2/g,孔体积为0.03 cm3/g和0.06 cm3/g,2.5% Fe3O4-TiO2较纯TiO2比表面积增大了1.64倍,孔体积增大了2倍,说明2.5% Fe3O4-TiO2比纯TiO2产生了更多的孔结构使比表面积增大,在同等条件下与污染物的接触面增大,有利于将污染物吸附到表面被·OH等氧化分解,从而提高光催化处理效果。

图8 TiO2和2.5% Fe3O4-TiO2的BJH孔径分布曲线Fig.8 TiO2 and 2.5% Fe3O4-TiO2 BJH pore size distribution curves
2.5.4 HRTEM表征 图9分别为TiO2(a,b,c)和2.5% Fe3O4-TiO2(d,e,f)的HRTEM衍射图。

图9 TiO2和2.5% Fe3O4-TiO2的TEM衍射图Fig.9 TEM diffraction patterns of TiO2 and 2.5% Fe3O4-TiO2
由图9可知,TiO2和2.5% Fe3O4-TiO2颗粒之间存在一定的团聚现象,2.5% Fe3O4-TiO2复合材料的平均粒径小于纯TiO2,其中纯TiO2的粒径在20~25 nm之间,晶格间距为0.38 nm, 2.5% Fe3O4-TiO2的粒径在16~20 nm之间,晶格间距为0.35 nm。图9c和图9f为TiO2和2.5% Fe3O4-TiO2衍射花样图,图9c中衍射环半径分别为2.8,4.15,5.20,5.86 nm-1,图9d中衍射环半径分别为2.81,4.13,5.29,5.89 nm-1,根据公式d=Lλ/R计算可得衍射环的晶面间距,比较标准卡片进而标定晶面指数,分别依次对应于锐钛矿相TiO2的(101)、(004)、(200)、(105)晶面。
3 结论

(2)制备的纯TiO2和Fe3O4-TiO2均为锐钛矿型,Fe3O4的加入抑制TiO2晶粒形成,使Fe3O4-TiO2平均粒径小于纯TiO2,形成了更多的中孔结构,增加了与四环素的有效反应接触面积,从而提高去除率,其中2.5% Fe3O4-TiO2复合材料的孔容为0.06 cm3/g,较纯TiO2增大了2倍,比表面积为29.55 m2/g,较纯TiO2增大了1.64倍。
——潘桂棠光生的地质情怀

