碱性离子液体甲氧化1-乙基-3-甲基咪唑盐的合成与表征
许玥,解田,全宏冬,彭枝忠,周海,孙洋,田波
(1.贵州大学 化学与化工学院,贵州 贵阳 550025;2.中低品位磷矿及其共伴生资源高效利用 国家重点实验室,贵州 贵阳 550016;3.赤峰瑞阳化工有限公司,内蒙古 赤峰 024076)
离子液体(Ionic Liquids,简称ILs)为100 ℃以下的熔融盐,由较大有机阳离子和较小有机或无机阴离子组成,独特且稳定的物化特性使其在溶剂、电化学[1]和生物催化[2]领域具有广阔应用前景。而碱性离子液体(BILs)作为新型绿色溶剂及催化剂[3],结合了离子液体及无机碱的优点,已在催化、吸附、分离等各个领域发挥重要作用[4-6]。但关于BILs的研究报道仍较少,因此,对其合成及性质的探究在催化和溶剂领域应用具有指导性意义。
本文所制备BILs甲氧化1-乙基-3-甲基咪唑盐[Emim]OCH3,其阴阳离子分别是非卤化盐类和烷基取代咪唑类([R1R2MIM]+),针对其及中间体溴化1-乙基-3-甲基咪唑[Emim]Br进行了一系列测定。
1 实验部分
1.1 试剂与仪器
N-甲基咪唑(99%)、甲醇钠(98%)均为化学纯;溴乙烷、乙腈、丙酮均为分析纯。
DF-101S型集热式恒温加热磁力搅拌器;FA2004N型电子分析天平;101-0AB型电热鼓风干燥箱;SHB-Ⅲ型循环水式多用真空泵;Nicolet is50型原位漫反射傅里叶变换红外光谱仪;TG209F1型热重分析仪;PHS-3C型pH计;DDS-307A型电导率仪。
1.2 碱性离子液体的合成
离子液体结构具有可设计性,因此种类繁多,其制备主要有两种基本方法:直接合成法、两步合成法[7],本文采用两步合成法制备[Emim]OCH3。
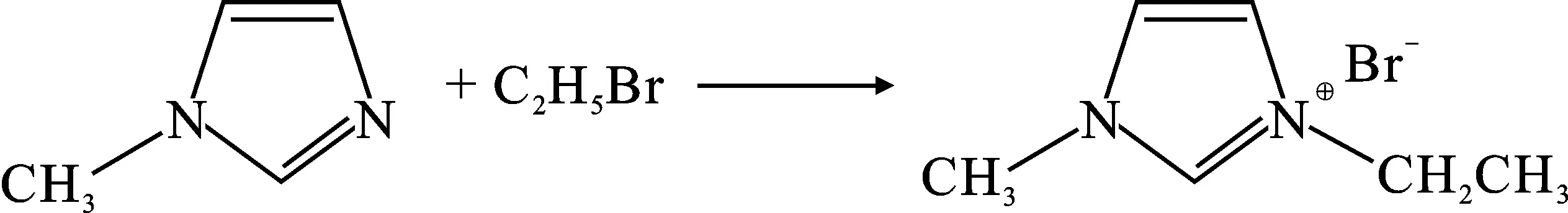
1.2.1 中间体合成 中间产物溴化1-乙基-3-甲基咪唑([Emim]Br)的合成:在250 mL三口瓶中加入19.93 mL(0.25 mol)N-甲基咪唑,常压分液漏斗中加入22.54 mL(0.3 mol)溴乙烷,后打开常压分液漏斗活塞使溴乙烷在室温条件下缓慢滴加到N-甲基咪唑溶液中充分搅拌反应5 h后,得到的白色固体用乙酸乙酯进行多次洗涤后,85 ℃常压蒸馏除去乙酸乙酯,再在80 ℃条件下干燥4 h,冷却后便得到45.13 g较高纯度的白色固体中间产物[Emim]Br,收率94.55%,将其放置于干燥皿中进行保存。反应式如下:
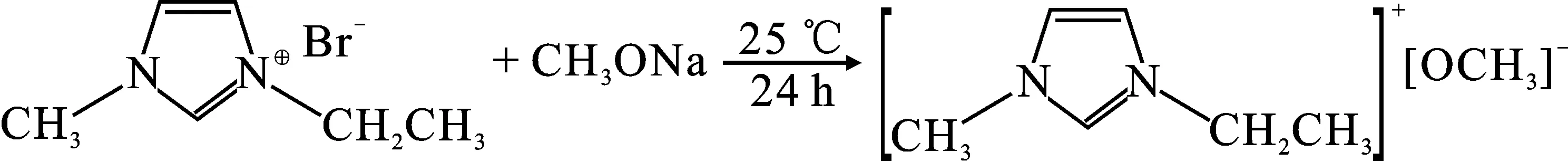
1.2.2 碱性离子液体合成 终产物甲氧化1-乙基-3-甲基咪唑盐([Emim]OCH3)的制备[8]:先在锥形瓶中加入适量的无水乙醇后再加入5.4 g(0.1 mol)甲醇钠进行搅拌,得到澄清甲醇钠溶液后加入19.09 g(0.1 mol)[Emim]Br溶液变为纯白色,室温下搅拌反应24 h,过滤除去白色固体NaBr,88 ℃常压蒸馏2 h得到11.8 g[Emim]OCH3,收率83.1%,产物放在干燥皿内备用。反应式如下:
2 结果与讨论
2.1 红外光谱分析
分别将5 mg[Emim]Br、5 mg[Emim]OCH3与干燥的溴化钾研磨、压片、红外光照射,在500~4 000 cm-1内测试,中间产物[Emim]Br的红外光谱见图1。
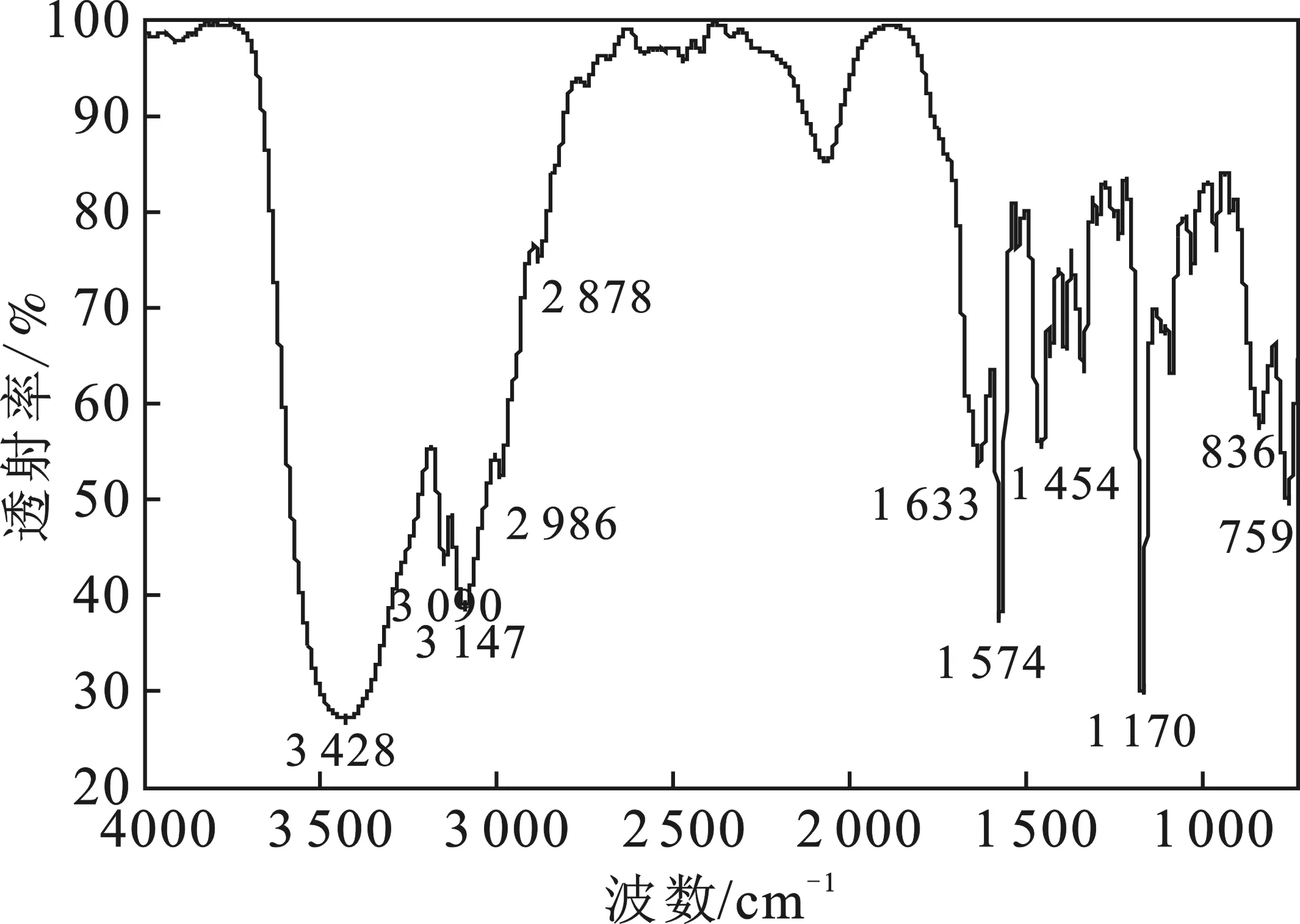
图1 [Emim]Br的IR光谱图Fig.1 Infrared spectrogram of[Emim]Br

终产物[Emim]OCH3的红外光谱见图2。
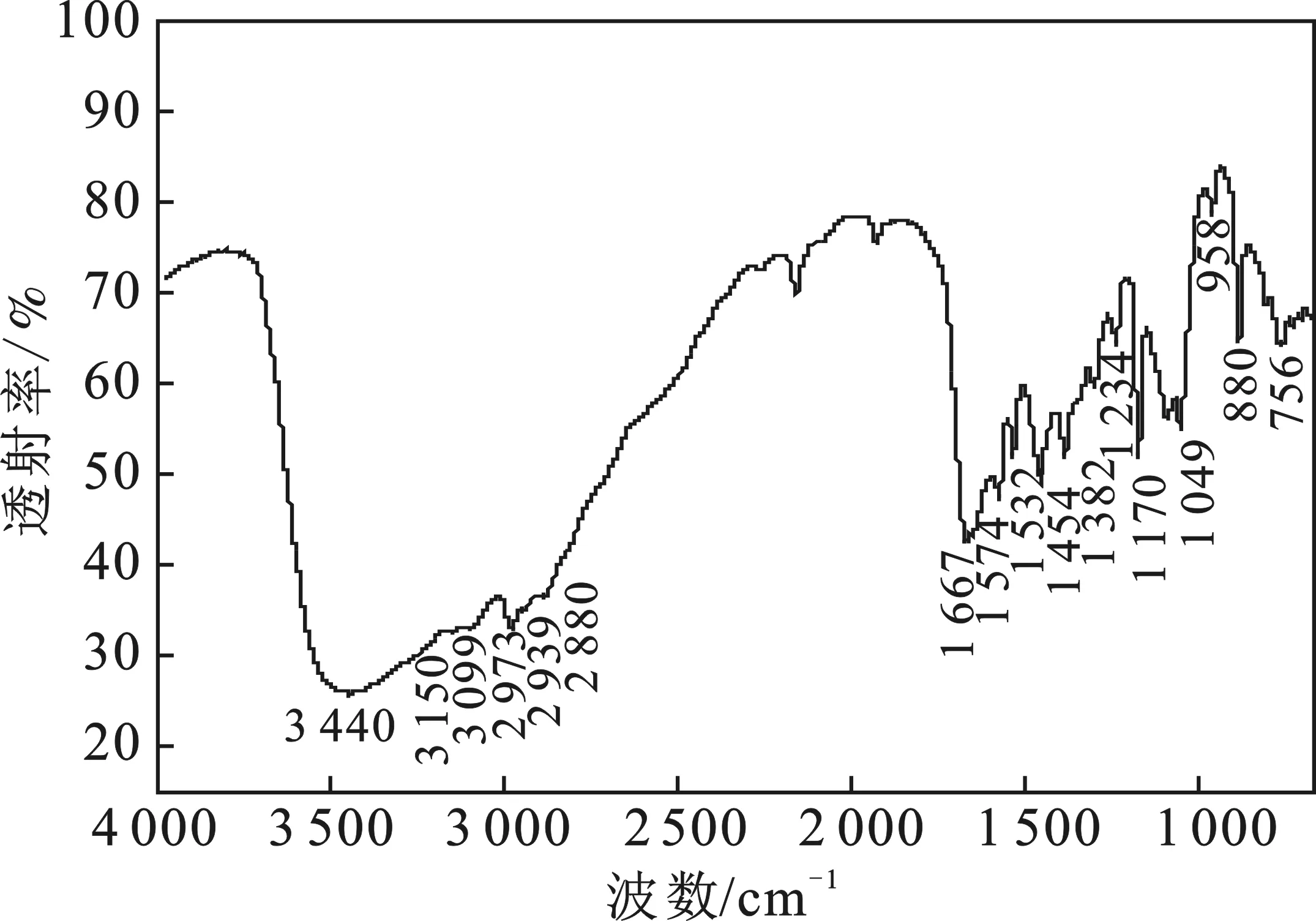
图2 [Emim]OCH3的IR光谱图Fig.2 Infrared spectrogram of[Emim]OCH3
2.2 热性能测定
在N2保护下,以10 ℃/min升温至700 ℃,得到[Emim]Br的热重曲线,见图3a。由图3a可知,起初H2O快速除去,导致曲线在分解温度(252 ℃)前质量大概降低4%,且热重最大损失温度约为338 ℃,与文献[12]报道基本吻合。

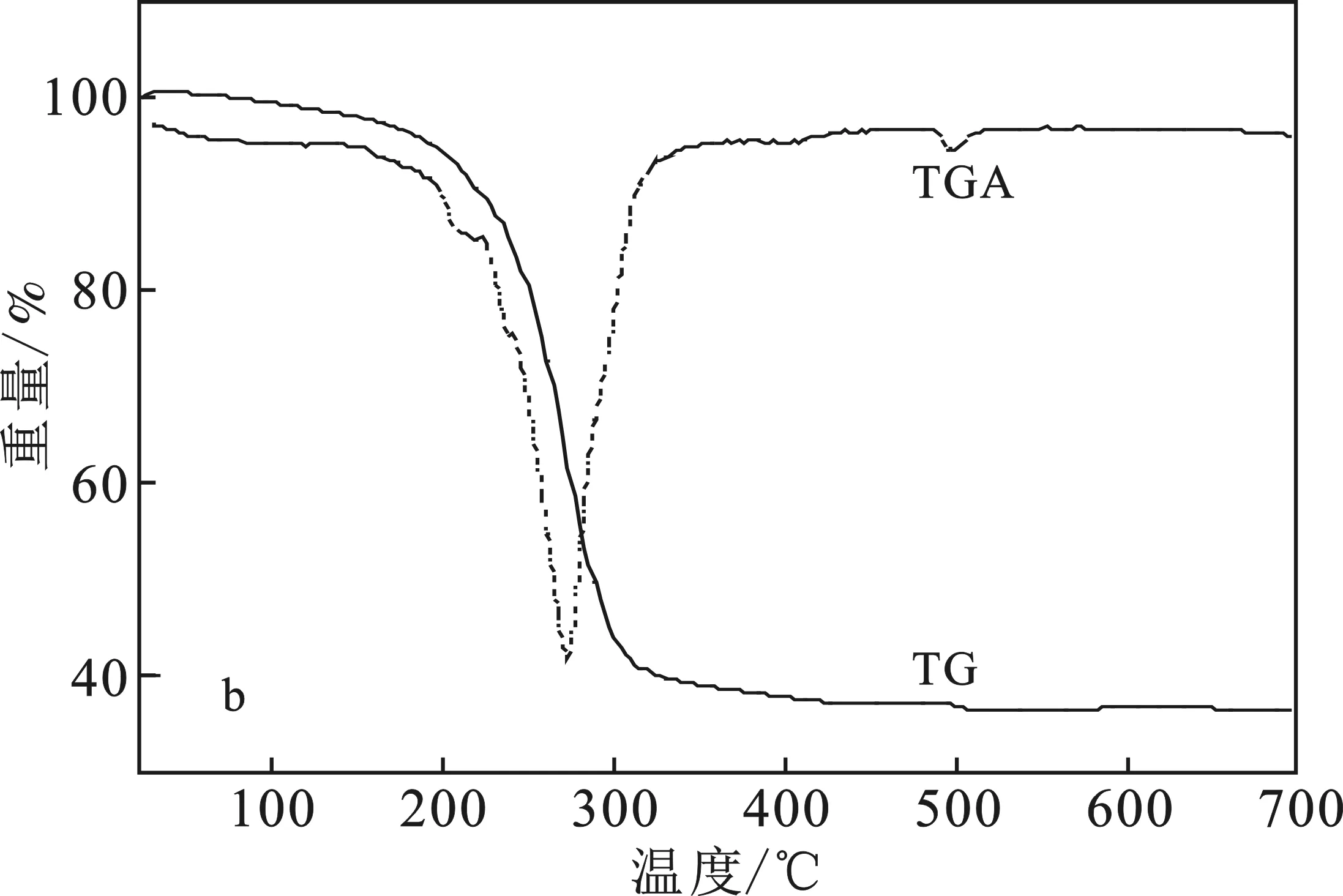
图3 [Emim]Br(a)与[Emim]OCH3(b)的TG(TGA)曲线Fig.3 TG(TGA) curves of[Emim]Br(a) and [Emim]OCH3(b)

2.3 碱性表征
碱度的测定对于咪唑基碱性离子液体的开发利用有着极其重要的意义,因此借鉴传统碱催化剂的碱性表征方法:pH值法[13]分别对[Emim]Br和[Emim]OCH3进行碱性表征。
2.3.1 pH值法的原理及计算方法 碱性离子液体的水溶液中,其碱性阴离子会发生水解平衡,且游离的OH-浓度降低,碱性降低:
B-+H2O←→HB+OH-
(1)
由Kb的定义式(式2)、质量守恒定律(式3)和电荷守恒定律(式4),可得(式5):
(2)
CB-=[B-]+[HB]=[A+]
(3)
[A+]+[H+]=[B-]+[OH-]
(4)
(5)
以上各式中的[HB]、[OH-]、[B-]、[A+]以及[H+]均表示摩尔浓度,CB-近似等于溶液浓度。由式(5)可知,在碱性离子液体的水溶液中,若已知该碱性离子液体水溶液的pH值,即可通过式(5~7)计算出[H+]、[OH-]、电离常数(Kb)值,最终由式(8)计算可得该碱性离子液体的负电离平衡常数对数值(pKb)。
pH=-lg[C(H+)]
(6)
[H+]·[OH-]=KW=1×10-14
(7)
pKb=-lgKb
(8)
2.3.2 离子液体的碱性强度 因空气中水分极易被离子液体吸收,故实验前先对样品进行干燥处理,然后将其配制成不同浓度的水溶液,分别用pH计测量并记录其各自pH值,计算可以得到不同浓度下ILs水溶液下的pKb值,见表1。因为离子液体的碱性随pKb值的增大而减小,因此可通过比较pKb值有效确定碱性强度。
由表1可知,随离子液体浓度的减小,其pH值减小,其pKb均值:[Emim]Br>[Emim]OCH3,故其碱性强弱为:[Emim]Br <[Emim]OCH3。两离子液体阳离子相同,阴离子不同,甲氧基的引入增强了ILs的碱度,结果表明阴离子对离子液体的碱度具有一定影响,且[Emim]OCH3的碱性较强,为其在碱催化领域的应用奠定了基础条件。
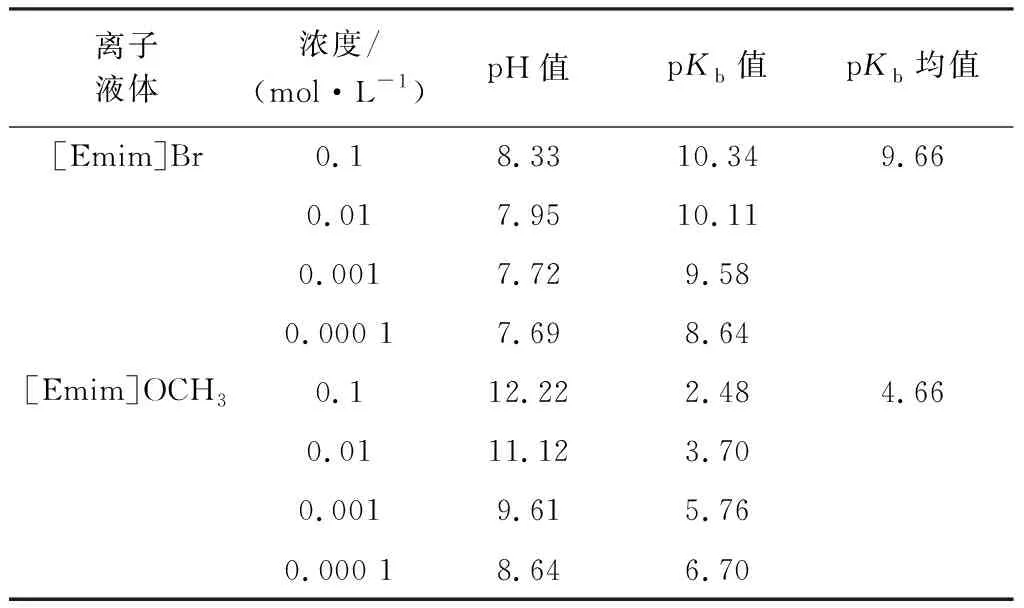
表1 pH值法得到的离子液体pKb值Table 1 pKb value of ILs obtained by pH method
2.3.3 温度对离子液体pH值的影响 为进一步研究pH值与温度的变化关系,分别测量了[Emim]Br和[Emim]OCH3的水溶液浓度为0.1 mol/L时,温度从25~55 ℃范围内的pH值,结果见图4。

图4 [Emim]Br和[Emim]OCH3的 pH值随温度变化曲线Fig.4 pH curves of[Emim]Br and[Emim]OCH3 with temperature
由图4可知,对于[Emim]Br、[Emim]OCH3与水的二元混合物,其pH值都随着温度的升高而略微降低,而[Emim]OCH3较[Emim]Br相比,pH值随温度变化趋势较为稳定。因此,在室温下即使温度有所波动对碱性离子液体[Emim]OCH3的碱性强度影响也较小。
2.4 电导率测定
电导率(κ)是离子液体电化学性能研究的重要方面之一,电导率一般表示的是溶液传导电流的能力,这种能力与自由质点的振动有关,自由离子的数量以及其迁移能力都会对电导率产生影响。[Emim]Br和[Emim]OCH3均由平面结构的咪唑阳离子组成,因共轭效应作用,使得电荷在整个咪唑环上分布均匀,阳离子与阴离子的库仑力相互作用较低,导致离子解离度较高,所以两离子液体会具有较高的导电性。
一般纯ILs的离子高度缔合且粘度比有机溶剂高[14],使得纯离子液体电导率较低,阻碍了其作为电解液在电化学领域中的应用。为改善纯ILs的这一电化学性质,通常与其它溶剂混合形成二元混合体系,便可显著降低粘度[15],同时可有效提高电导率。为研究所合成[Emim]Br和[Emim]OCH3的电导率性能,将其分别与不同溶剂水(H2O)、乙腈(C2H3N)、丙酮(C3H6O)进行混合,又由于温度、离子液体浓度、溶剂是影响体系电导率的重要因素,因而有必要进一步探究各因素对电导率的影响。
2.4.1 温度对离子液体电导率的影响 使用1 mol/L 的KCl标准溶液先对电导率仪的电极进行标定后,再用其测定离子液体[Emim]Br和[Emim]OCH3在相同浓度下(20 g/L)、温度为25~60 ℃之间,分别在不同溶剂水、乙腈中的电导率,结果见图5。
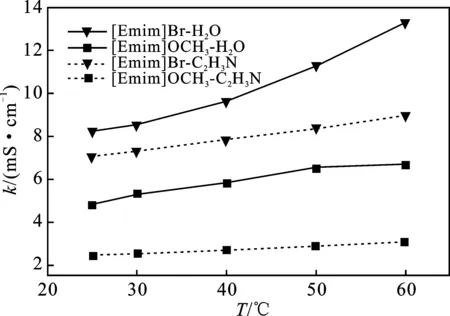
图5 [Emim]Br和[Emim]OCH3在不同溶剂中 的电导率随温度变化曲线Fig.5 Temperature dependence curves of electrical conductivity of[Emim]Br and[Emim]OCH3 in different solvents
由图5可知,ILs电导率均在10-1S/m数量级,并随温度升高缓慢增大。
电导率可由如下公式表示[16]:
k=∑niqiμi
(9)
其中,i为离子类型,n为自由离子数,q为电荷量,μ为离子的迁移率。根据上式可知,当温度升高时体系粘度降低[17],加快了离子在两相间的迁移速度,使得电导率相应增大。另一方面,解离为吸热过程,温度升高有利于解离,同时温度升高使ILs内能增大,增强了克服相互间聚合效应和氢键作用的能力,使得自由离子的数量增加,因此电导率随温度的升高而增大。
用以描述纯离子液体以及离子液体-有机溶剂(IL-MLD)混合体系的温度T与电导率k的阿伦尼乌斯(Arrhenius)公式[18]:
(10)
其中,A为指前因子,Ea为离子传输跃迁的活化能,R为摩尔气体常数。
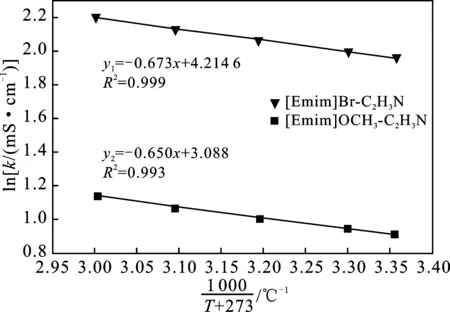
图6 [Emim]Br和[Emim]OCH3在乙腈溶剂 中的电导率与温度的Arrhenius关系Fig.6 Arrhenius relationship between temperature and electrical conductivity of[Emim]Br and[Emim]OCH3 in acetonitrile solvent
由图6可知,[Emim]Br和[Emim]OCH3在乙腈溶液中(C=20 g/L)的电导率k与温度T的关系符合Arrhenius公式,[Emim]Br-C2H3N和[Emim]OCH3-C2H3N体系活化能分别为5.046,5.938 kJ/mol,相关系数分别为0.999,0.993,拟合度较好,呈线性相关,从而进一步描述了k与T之间的关系[19]。
2.4.2 浓度以及溶剂对离子液体电导率的影响 用电导率仪分别测量碱性离子液体[Emim]Br和[Emim]OCH3在相同温度下(20 ℃)、不同浓度下(6~20 g/L),不同溶剂水、乙腈、丙酮中的电导率,根据测定结果分别绘制出[Emim]Br和[Emim]OCH3在不同溶剂中的混合体系电导率随浓度变化的关系,见图7。
由图7可知,ILs在水中电导率随浓度的增加而显著升高;在乙腈中电导率随浓度增加而升高的趋势略小于以水为溶剂的升高趋势;而在丙酮中的电导率随浓度变化趋势较为缓慢。由于溶剂的加入使二元体系黏度迅速降低,降低了阴阳离子间的静电作用和离子间的密堆积,加剧了离子的流动性,且ILs电离度也较高,因此电导率值均随其浓度的增加而升高。
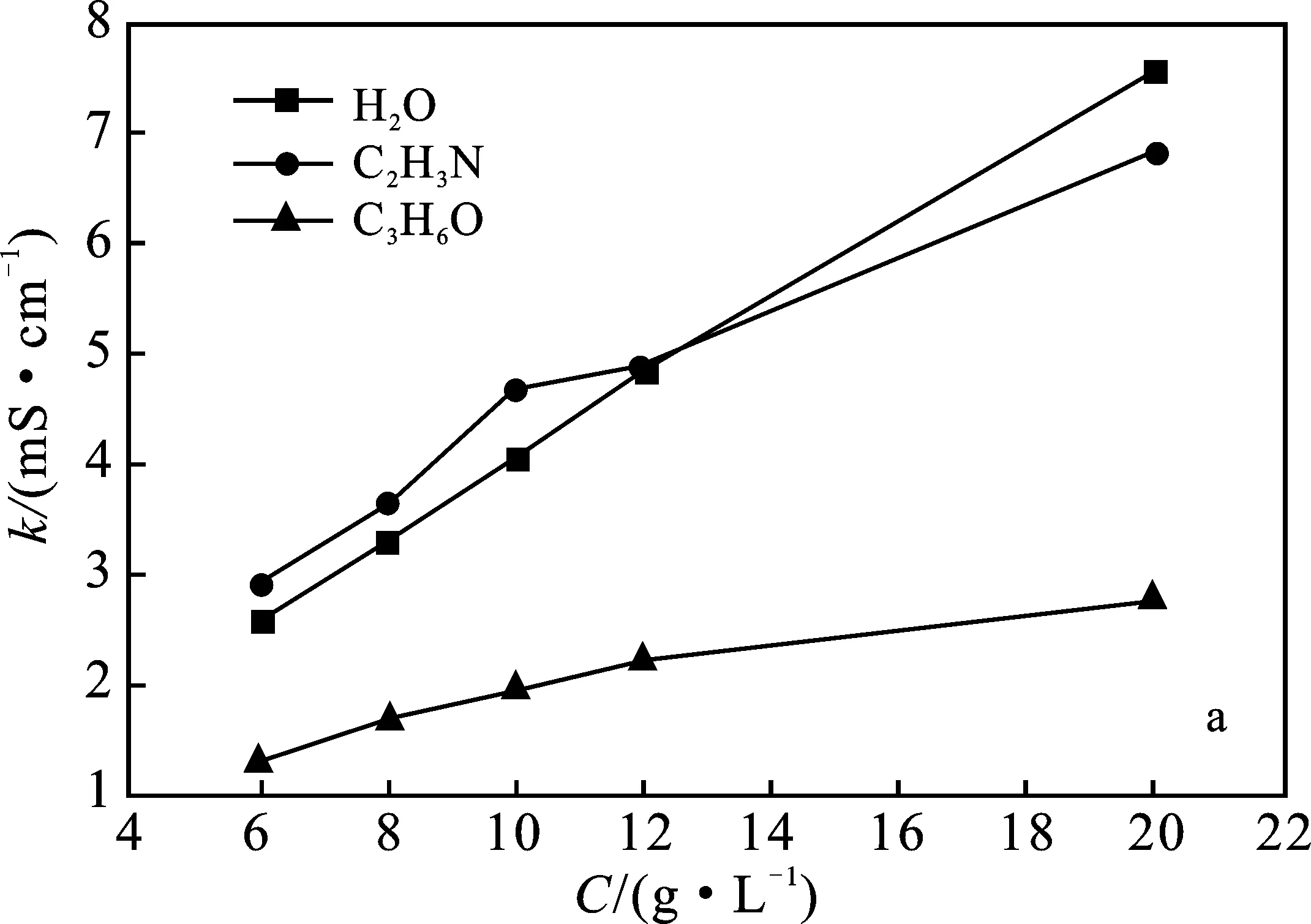
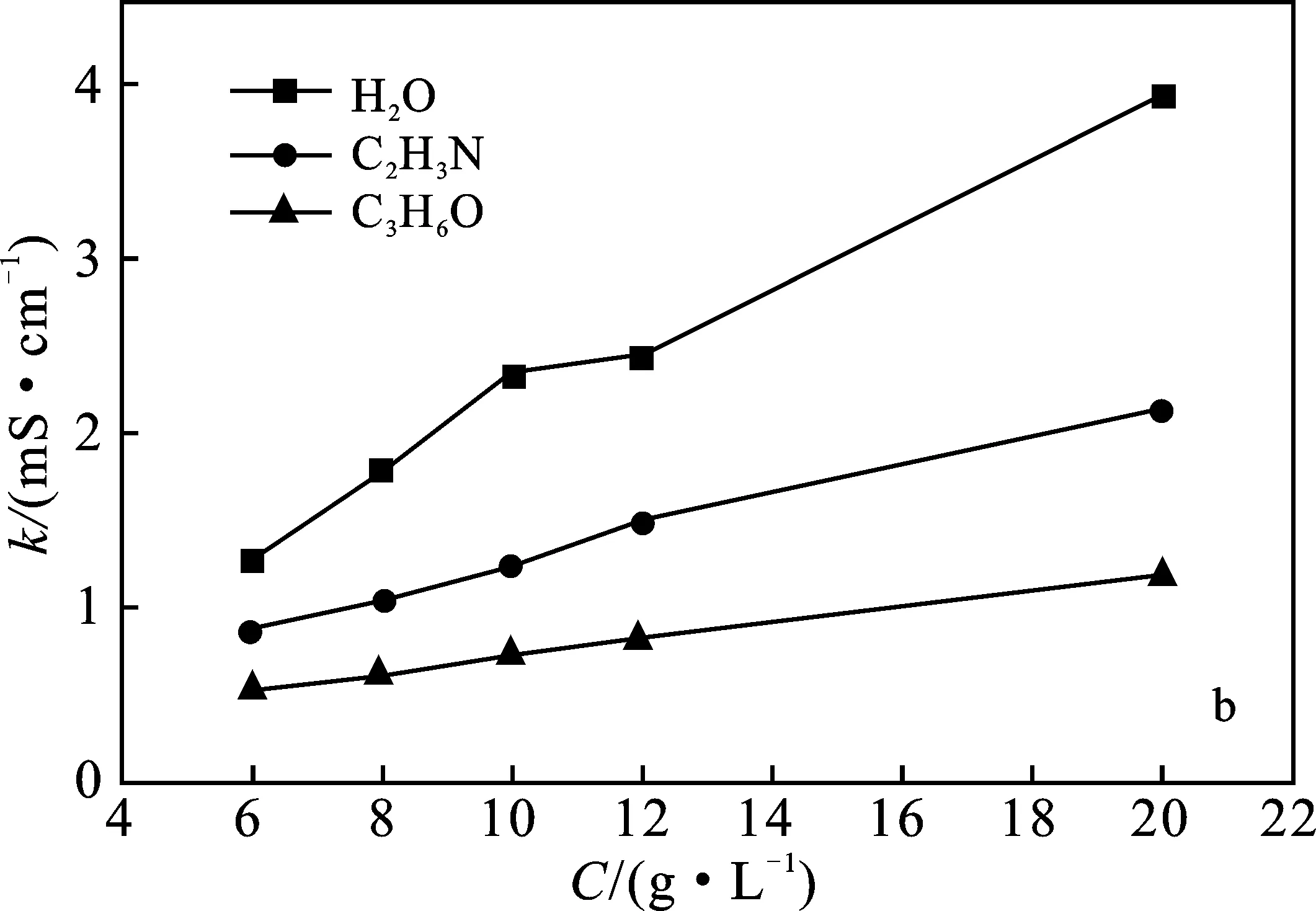
图7 [Emim]Br(a)和[Emim]OCH3(b)在 不同溶剂中的电导率随浓度变化曲线Fig.7 Concentration dependence curves of electrical conductivity of[Emim]Br(a) and[Emim]OCH3(b) in different solvents
由图7可知,离子液体与不同溶剂混合的电导率相差较大,其顺序为:k(水作溶剂)>k(乙腈作溶剂)>k(丙酮作溶剂)。介电常数(ε)大的溶剂可以更有效地与体系中的离子发生相互作用,这3种溶剂的介电常数大小次序为:
ε水(293.15 K)=80.4 >ε乙腈(294.15 K)=
37.5 >ε丙酮(298.15 K)=18.5
由此可知,水具有较高介电常数,为ILs的解离提供了较好条件,因此以水作溶剂时ILs的电导率大。同理,乙腈为非质子极性溶剂,其自身电解常数较大、相对稳定性高、粘度小,所以用乙腈作溶剂时ILs的电导率较大。
2.5 临界胶束浓度测定
采用电导法来分别测定离子液体[Emim]Br和[Emim]OCH3的临界胶束浓度值(cmc):在20 ℃下,使用标定后的电导率仪分别测定[Emim]Br和[Emim]OCH3的水溶液在不同浓度下的电导率,以浓度为横坐标,电导率对其浓度的二次微分为纵坐标作图,见图8。
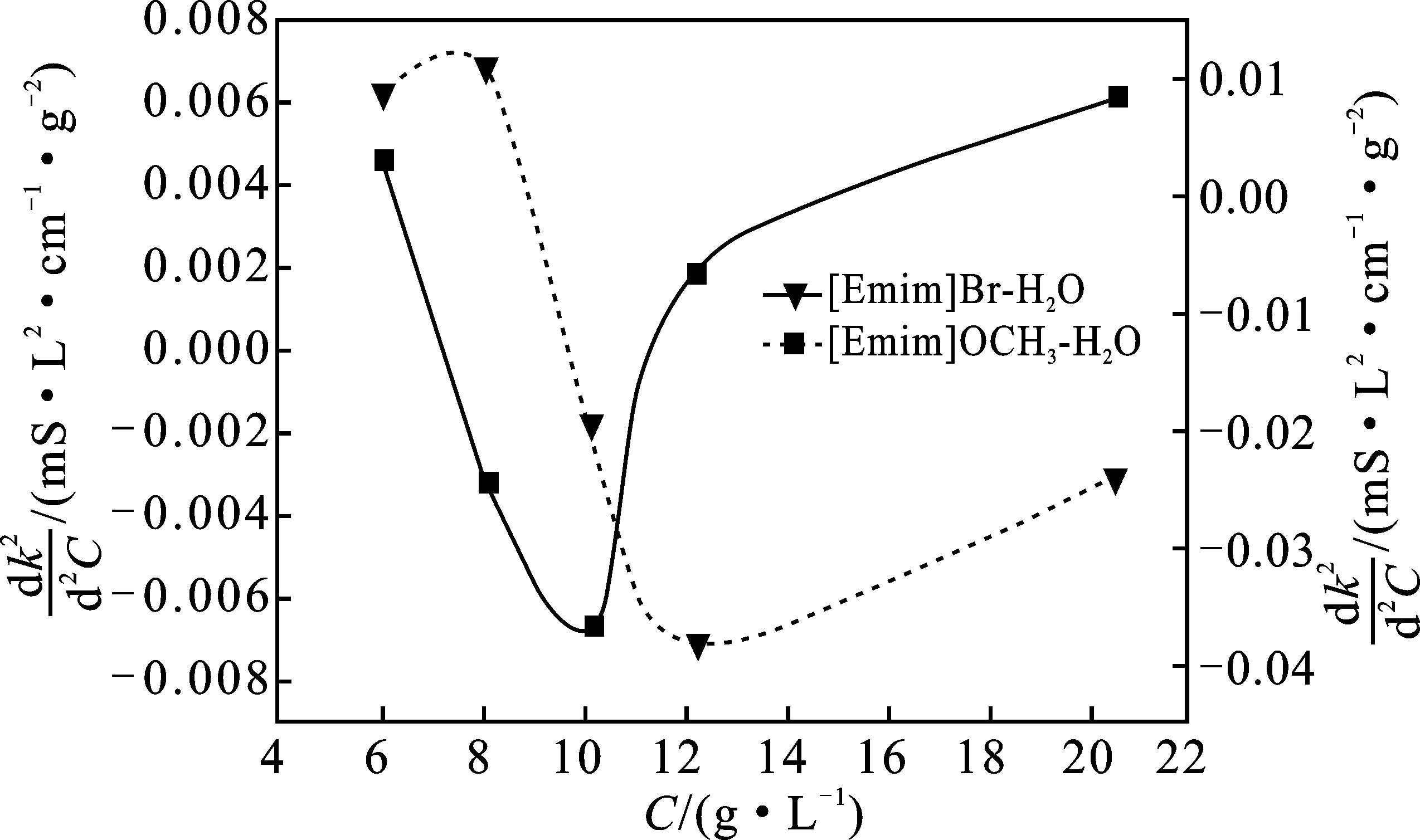
图8 [Emim]Br-H2O和[Emim]OCH3-H2O 溶液的电导率对浓度二次微分的变化曲线Fig.8 The quadratic differential curve of the conductivity of[Emim]Br-H2O and[Emim]OCH3-H2O solution with respect to concentration
由图8可知,两个体系的电导率对离子液体浓度二次微分的变化曲线存在极小值,而该值对应的离子液体浓度即为ILs的cmc值[20]。由此可得cmc[Emim]Br=12.09 g/L>cmc[Emim]OCH3=9.73 g/L,且阴离子的分子量大,使其cmc值减小。
2.6 溶解性测定
离子液体作为新型环境友好类溶剂,其溶解性是衡量其作为溶剂性能的重要参数之一,因此在常温下将中间产物[Emim]Br和最终产物[Emim]OCH3分别与不同溶剂进行混合,观察其溶解程度,结果见表2。

表2 [Emim]Br和[Emim]OCH3的溶解性 Table 2 Solubility of[Emim]Br和[Emim]OCH3
介电常数越大,极性越强;反之,介电常数越小,其极性越小。水、甲醇、乙醇、乙腈、丙酮溶剂的介电常数都比较大,而乙酸乙酯、苯甲醛、三氯甲烷溶剂的介电常数都相对较小,石油醚、四氯甲烷溶剂的介电常数很小。由于[Emim]Br和[Emim]OCH3为较强极性的强电解质,依据相似相容的原理,可以推测出[Emim]Br和[Emim]OCH3易溶解在极性较大的溶剂中,不易溶解在极性小的溶剂中,由表2可知,实验结果与推测相符,且[Emim]Br不溶于乙酸乙酯、苯甲醛、三氯甲烷,但当改变阴离子后,[Emim]OCH3对这些溶剂的溶解性显著增强。
3 结论
(1)[Emim]Br和[Emim]OCH3热稳定性良好。
(2)采用pH值法,测量计算出[Emim]Br和[Emim]OCH3的pKb均值分别为9.66和4.66,发现碱性离子液体[Emim]OCH3表现为强碱性,且在温度25~55 ℃范围内,其碱性大小受温度变化影响较小。
(3)研究了碱性离子液体[Emim]Br和[Emim]OCH3在不同溶剂水、乙腈、丙酮中的电导率,发现溶剂的性质对ILs的电导率有较大的影响,其顺序为:k(水作溶剂)>k(乙腈作溶剂)>k(丙酮作溶剂)。混合体系k在20 ℃、6~20 g/L时随浓度的增加而增加;同浓度下k在25~60 ℃内随温度的升高而增加,且混合体系k随温度的变化关系符合Arrhenius公式。
(4)[Emim]Br和[Emim]OCH3的cmc值分别为12.09,9.73 g/L。
(5)常温下,[Emim]Br和[Emim]OCH3与水、甲醇、乙醇、乙腈、丙酮溶剂都可互溶,此外[Emim]OCH3与乙酸乙酯、苯甲醛、三氯甲烷也可互溶。

