内源性鼻疽诺卡菌眼内炎一例
左程友 陈燕 江国华 董诺
作者单位:厦门大学附属厦门眼科中心 361000
患者,男,67岁。因“左眼突然眼痛、视力下降伴同侧头痛10 d”于2019年12月30日在厦门大学附属厦门眼科中心就诊。患者3个月余前四肢及躯干无明显诱因出现斑块状皮下淤血(见图1),就诊于当地医院,诊断为“过敏性皮炎”,自诉涂抹“藏药”治疗2个月后缓解(用药情况不详)。近期患者体质量减轻约10 kg,常感乏力、头晕,病因不明。既往有高血压病、糖尿病以及肾病病史数年,药物控制基本稳定。有青霉素、磺胺类药物过敏史。无眼部外伤史及手术史。眼部检查:矫正视力为右眼1.0,左眼手动/眼前10 cm。眼压:右眼14.4 mmHg(1 mmHg=0.133 kPa),左眼14.8 mmHg。左眼混合性充血,睫状压痛明显,角膜轻度水肿,少许色素性角膜后沉积物;前房深度正常,房水轻度浑浊,Tydnall(+);瞳孔欠圆,直径约3.5 mm,部分后粘连。瞳孔区晶状体前囊见少许色素沉着,晶状体灰白色混浊,眼后节红光反射未见(见图2)。全身检查:一般生命体征平稳,呼吸系统、消化系统、神经系统等未见明显异常。入院查血常规示:白细胞计数10.27×109/L,红细胞计数3.86×109/L,中性粒细胞绝对值8.11×109/L,淋巴细胞绝对值1.44×109/L,单核细胞绝对值0.66×109/L,血红蛋白99 g/L,红细胞压积31.49%,血小板计数352×109/L,C反应蛋白37.2 mg/L;肝功能示:白蛋白33.5 g/L,球蛋白43.0 g/L,白球比例0.78;肾功能示:肌酐195 μmol/L。眼部B超提示左眼玻璃体混浊,脉络膜脱离,视网膜可疑脱离(见图3)。颅脑CT扫描检查提示缺血性脑白质病、脑萎缩、右侧下鼻甲肥厚,双侧筛窦炎症。胸部CT扫描提示双肺上叶小叶中心型肺气肿、右肺下叶后基底段间质性肺炎;腹部CT扫描显示左肾盂,右输尿管上段结石合并右输尿管上段扩张,管壁增厚,双肾周渗出影。诊断为:①左眼玻璃体混浊;②左眼视网膜脉络膜脱离;③左眼年龄相关性、并发性白内障;④高血压病;⑤糖尿病;⑥肾病;⑦贫血;⑧低蛋白血症;⑨泌尿系结石。于2019年12月30日行左眼前房冲洗、白内障超声乳化吸除联合玻璃体切割、硅油填充手术治疗,术中取前房液及玻璃体腔液送检。手术过程:术中切除混浊的玻璃体后见视网膜下有2个黄白色脓肿,占玻璃体腔约2/3范围,整个视网膜水肿色灰,血管充血扩张,脓肿呈波动状,于后极部相贴,遮挡视乳头。重水注入下脓肿内脓液可向周边移动,见视乳头充血、水肿(见图4),继续重水注入复位脱离的视网膜、脉络膜,于上方近锯齿缘处切开脓肿,排出黄白色脓液,部分送检。灌注液500 ml加入100 mg万古霉素,用玻璃体切割头尽可能地将脓液吸除,常规气液交换,硅油填充,术后球周注射万古霉素5 mg联合妥布霉素10 mg。术毕见角膜轻度水肿,前房少量残余气泡(见图5)。结合术中眼底情况,高度怀疑内源性眼内炎,行血液培养。术后处理:静脉滴注左氧氟沙星注射液0.2 g/d,头孢曲松钠 2 g/d,分2次;莫西沙星滴眼液点眼1次/h,氟康唑滴眼液点眼1次/2 h,并进行抗炎、麻痹睫状肌等处理。术后第2天,患者术眼未感明显不适,左眼视力手动/眼前10 cm,眼压23.2 mmHg。角膜轻度水肿,前房深,房水混浊(+);瞳孔圆,直径约3.5 mm,下方虹膜周切口可见,玻璃体腔硅油清亮,眼底红光反射未见,隐约可见视神经乳头充血,边缘不清,视网膜水肿,色灰黄,血管窥不清。继续全身及局部用药。术后第3天,患者诉术眼胀痛,眼压31 mmHg。眼部检查见角膜水肿加重,房水浑浊(++),瞳孔药物性散大约4.5 mm,瞳孔区可见脓性分泌物覆盖(见图6)。复查B超示左眼玻璃体腔内硅油尚清,脉络膜、视网膜脱离明显改善(见图7)。予以布林佐胺滴眼液、酒石酸溴莫尼定滴眼液2次/d降眼压治疗。术后第4天,患者术眼角膜水肿无改善,瞳孔区渗出物增厚,眼压持续升高,达41 mmHg。2020年1月3日行前房冲洗,瞳孔区、下方虹膜周切处渗出脓苔清除,玻璃体腔注入万古霉素1 mg/0.1 ml。继续静脉滴注左氧氟沙星0.2 g/d,头孢曲松钠2 g/d,分2次,氟康唑滴眼液点眼2次/d,莫西沙星滴眼液点眼1次/h。2020年1月4日眼内液基因检测报告提示鼻疽诺卡菌感染。本院标本涂片革兰染色、细菌培养及血培养均阴性。2020年1月5日起改用阿米卡星注射液静脉滴注0.2 g/d,左氧氟沙星滴眼液1次/2 h,阿米卡星滴眼液1次/h点眼。但炎症反应控制欠佳,左眼疼痛难以忍受,持续性高眼压,约40 mmHg,降眼压药物控制欠佳,视力:光感/2 m。2020年1月9日再次行左眼前房冲洗,并取出混浊硅油,术中使用10 mg/L阿米卡星灌注液灌洗[1],眼底结构窥不清,仅上方可见部分灰色视网膜。反复冲洗后,常规气液交换、填充硅油。术后第1天,左眼眼压33.4 mmHg,混合性充血,角膜明显水肿,玻璃体腔硅油清亮,眼底无红光反射。继续行抗炎、抗感染、降眼压等处理。术后第2天,瞳孔区再次出现黄白色脓性渗出,且逐渐加重,眼压持续升高,予以前房穿刺放液降眼压处理,每天2次。患者眼痛、头痛难忍,视力:光感不确,拒绝继续治疗,强烈要求摘除眼球。于2020年1月17日行左眼球摘除术,术中未发现球外感染灶,术后疼痛缓解。将摘除眼球做细菌培养与病理检查,细菌培养结果阴性,病理检查显示视网膜、脉络膜组织等炎性改变(见图8)。眼球摘除术后1个月复查,患者无眼痛、头痛,结膜无充血、水肿。术后2个月施行义眼植入术。
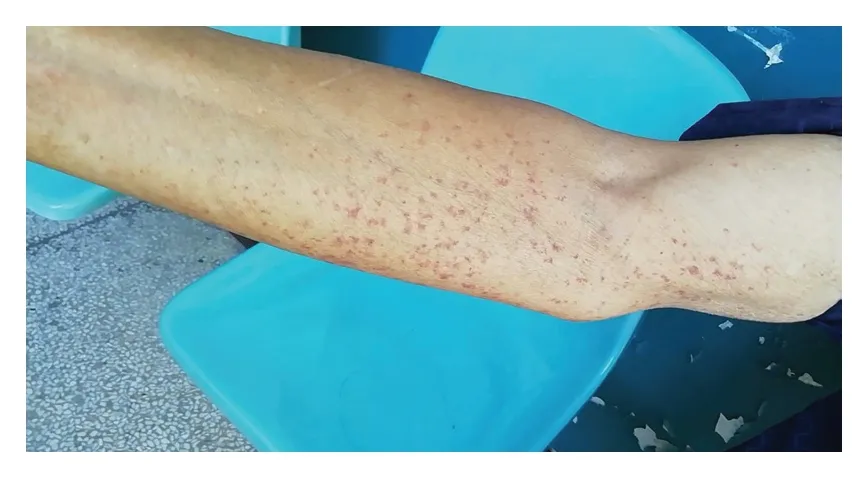
图1.内源性鼻疽诺卡菌眼内炎眼部症状出现前3个月手臂皮肤照片皮肤上散在瘀斑Figure 1.Photo of an arm,3 months before endogenous noc ardiafarcinicaendophthalmitis ocular symptoms emerged.Ecchymos is on the skin.
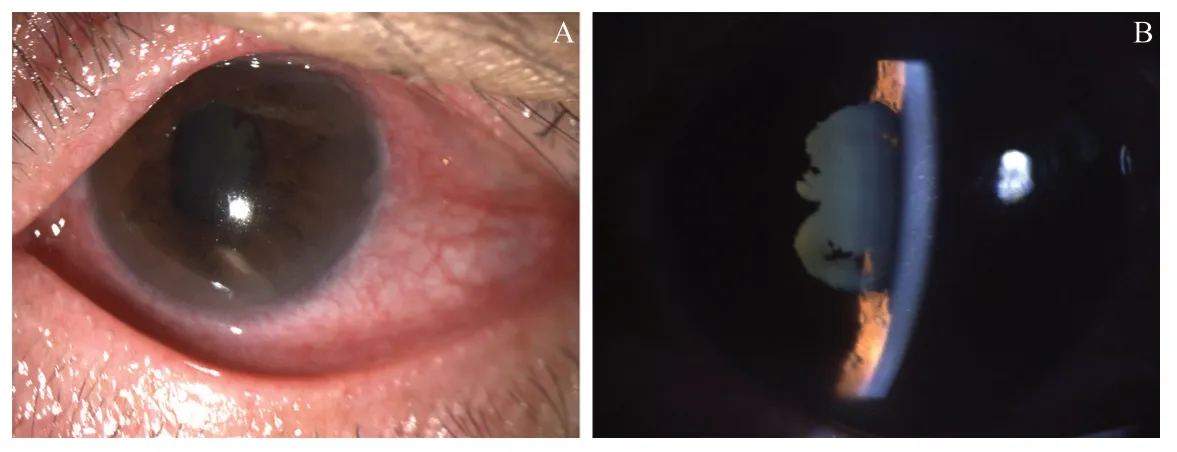
图2.左眼内源性鼻疽诺卡菌眼内炎眼前节照片混合性充血,角膜轻度水肿,少许色素性角膜后沉积物,前房深度正常,房水轻度浑浊,瞳孔欠圆,直径约3.5 mm,部分后粘连,瞳孔区前囊可见少许色素沉着,晶状体灰白色混浊,眼后节未见红光反射Figure 2.Photo of the anterior segment of the left eye with endogenous nocardiafarc inicaendophthalmitis.Mixed hyperemia,mild corneal edema,slightly pigmented keratic precipitate (KP).Anterior chamber depth is normal with slight turbidity of the aqueous humor.The pupil is not round,about 3.5 mm in diameter,posterior synechia of the iris,slight pigmentation is observed in the anterior capsule of the lens.The red-light reflection is on the vitreous so the fundus is invisible.
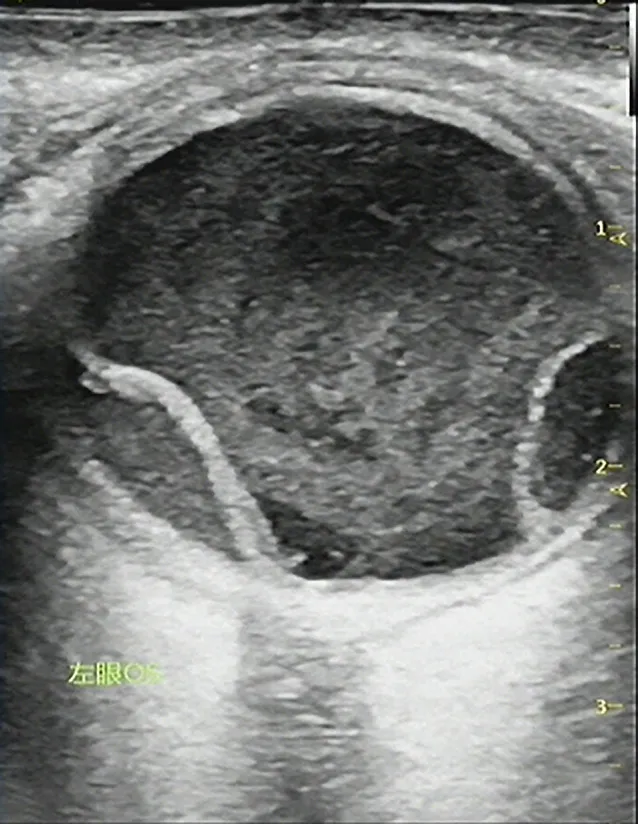
图3.左眼内源性鼻疽诺卡菌眼内炎的B超检查左眼玻璃体混浊,脉络膜脱离,视网膜可疑脱离Figure 3.B-scan ultrasonography of the left eye with endogenous noc ardiafarcinicaendophthalmitis.The scan suggests left vitreous opacity,choroidal detachment and suspected retinal detachment.
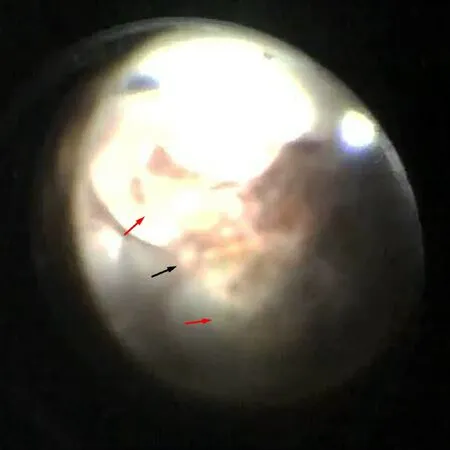
图4.左眼内源性鼻疽诺卡菌眼内炎玻璃体切割术中眼后节照片术中显微镜下见视网膜下2个黄白色脓肿(红色箭头所示),占据玻璃体腔内约2/3,随着手术的进行,逐渐暴露出视乳头(黑色箭头所示)Figure 4.Photo of the posterior segment of the left eye during vitrectomy for endogenous nocardiafarcinicaendophthalmitis.During the operation,two yellow-white abscesses (indicated by the red arrow) are observed,occupying about two-thirds of the vitreous cavity.As the operation proceeded,the optic papilla gradually became visible (indicated by the black arrow).
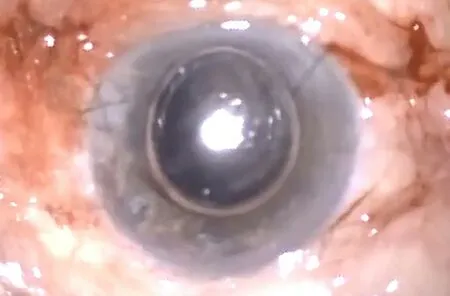
图5.左眼内源性鼻疽诺卡菌眼内炎玻璃体视网膜术后眼前节照片角膜轻度水肿,前房见残余气泡Figure 5.Photo of the anterior segment of the left eye after vitreoretinal surgery for endogenous nocardiafarcinicaendophthalmitis.Mild corneal edema with residual air bubble in the anterior chamber.
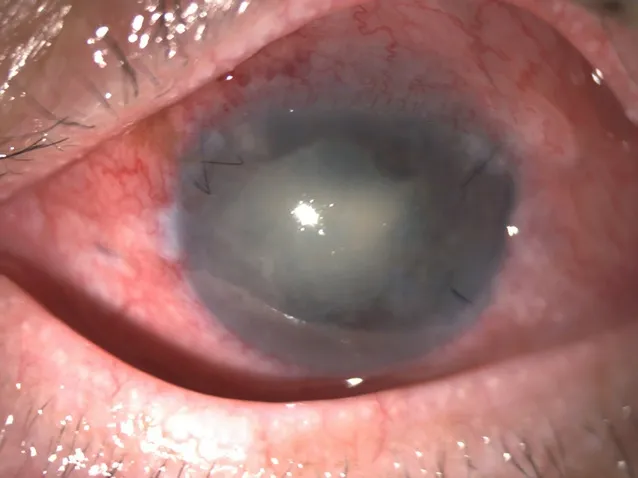
图6.左眼内源性鼻疽诺卡菌眼内炎玻璃体视网膜术后3 d眼前节照片混合性充血,角膜明显水肿,房水浑浊(++),瞳孔散大约4.5 mm,瞳孔区隐约可见脓性分泌物覆盖Figure 6.Photo of the anterior segment of the left eye,3 days after vitreoretinal surgery for endogenous nocardiafarcinicaendophthalmitis.Mixed hyperemia,obvious corneal edema,turbid aqueous humor (++).The pupil is about 4.5 mm in diameter,with purulent secretion covering the pupil area.

图7.左眼内源性鼻疽诺卡菌眼内炎玻璃体视网膜术后3 d B超检查玻璃体腔内硅油尚清,脉络膜、视网膜脱离明显改善Figure 7.B-scan ultrasonography of the left eye,3 days after vitreoretinal surgery for endogenous nocardiafarcinicaendophthalmitis.The silicone oil is clear in the vitreous cavity,choroidal and retinal detachment have significantly improved.
讨论:
对于免疫功能缺陷或低下患者,如系统性红斑狼疮、干燥综合征、长期激素应用等,容易发生内源性脉络膜脓肿、眼内炎。该患者患高血压病、糖尿病病史多年,且合并肾病、贫血、低蛋白血症等基础性疾病,机体免疫力低下。发病前患者曾有明确皮肤病病史,在皮肤病症状消退一段时间后即出现眼部症状。根据混合性充血、角膜水肿、前房渗出物、玻璃体混浊以及B超检查结果,结合玻璃体切除术中所见浓稠的黄白色玻璃体混浊,巨大脉络膜隆起病变,视网膜毒性反应,初步确认为内源性眼内炎、脉络膜脓肿。

图8.左眼内源性鼻疽诺卡菌眼内炎眼球病理标本及HE染色图片巩膜灰白,视网膜表面粗糙,棕褐色,镜下所见视网膜剥脱、结构破坏,表面见大量炎性渗出物及坏死组织,溃疡形成,炎症累及大部分眼球壁、巩膜及周围软组织内少量慢性炎细胞浸润,纤维组织增生。病理诊断:慢性化脓性炎、溃疡形成,炎症累及视网膜、脉络膜、睫状体、虹膜及视神经;游离片状组织部分区域见少量丝状物Figure 8.Photos of a pathologic specimen of the left eye and HE staining of endogenous nocardiafarcinicaendophthalmitis.The sclera is gray.The surface of the retina is brown and rough.Microscopic observation shows that the retina has peeled off and the structure is damaged.There is a large amount of inflammatory exudate and necrotic tissue on the surface.Ulcer formation,inflammation involving most of the eyeball.A small amount of chronic inflammatory cell infiltrates into the sclera and surrounding soft tissues,fibrous tissue proliferation.Pathological diagnosis:Chronic suppurative inflammation,ulcer formation,inflammation involving the retina,choroid,ciliary body,iris,and optic nerve.A few filaments are seen in parts of the free sheet tissue.
诺卡菌感染多见于免疫功能低下、免疫缺陷或长期服用皮质类激素、免疫抑制剂的患者,免疫功能正常者亦有感染的风险[2]。目前已发现星型诺卡菌、巴西诺卡菌、豚鼠诺卡菌与鼻疽诺卡菌这4种会对人体致病的诺卡菌,其中鼻疽诺卡病菌最少见,可引起皮肤,皮下组织,肺部急、慢性化脓性疾病,也可经血行播散途径侵入脑部或其他组织而引起相应病变。诺卡菌包膜内含有结核菌硬脂酸,可促进化脓性炎症向脓肿发展,同时其丝状分支结构、网状生长特性亦是脓肿形成的重要原因[3-5]。据报道,诺卡菌是内源性脉络膜脓肿最常见的致病菌[4],但鼻疽诺卡病菌所致脉络膜脓肿、化脓性眼内炎目前国内尚未见报道,病程早期诊断困难,应与内源性真菌性眼内炎相鉴别,常见的真菌如曲霉菌、念珠菌为条件致病菌,在机体免疫力功能异常,长期使用激素、抗生素等情况下由感染灶通过血液循环散播全身,真菌进入血液后形成菌血症,常有发热等症状,病程进展缓慢,数日后出现眼部或其他组织感染症状。眼部感染早期以视力下降、眼前黑影飘动等症状为主,多有前葡萄膜炎症状,眼痛不明显,视网膜或视网膜下方可出现单个或多个黄白色浸润病灶,累及玻璃体时可出现玻璃体灰白色、絮状浑浊。症状无明显特异性[6],所以在无法排除真菌感染之前,应给予抗真菌治疗。化脓性眼内炎诊断的金标准为细菌培养,但鼻疽诺卡菌分离、鉴定难度大,临床上容易造成漏诊或误诊。该患者前房液、玻璃体标本、脉络膜脓性液体涂片、细菌培养等均阴性,未找到明确的病原学依据,但术后第5天眼内液基因检测结果提示鼻疽诺卡菌,才明确该患者为鼻疽诺卡病菌感染所致脉络膜脓肿。
近年来,基因检测作为一种新兴的检测手段在临床上应用越来越广泛,在细菌培养结果及药物敏感性试验结果报告之前,眼内液核酸检测可为疾病的病原学诊断提供可靠的依据。患者入院初期因未明确致病菌,经验性地针对重症细菌或真菌感染性眼内炎治疗,给予广谱抗生素联合抗真菌药物治疗,主要为万古霉素和头孢曲松钠,但治疗效果欠佳。待明确鼻疽诺卡菌感染后查找国内外相关文献[7-9],鼻疽诺卡菌对阿米卡星、利奈唑胺、左氧氟沙星、莫西沙星、复方新诺明等抗生素敏感,因为患者存在磺胺类药物过敏史,故治疗时选取左氧氟沙星、阿米卡星局部及全身治疗。鼻疽诺卡菌眼部感染极为少见,临床上缺少相关的治疗经验,毒力较其他诺卡菌更强[10],治疗病程长达6个月到半年以上[3,11-13]。由于患者眼内液细菌培养结果为阴性,治疗上缺少明确的药物敏感性试验结果作为指导,排除患者过敏性药物,选取了阿米卡星、莫西沙星等局部及全身治疗,但药物具体疗效尚不明确,无法适时控制感染及炎症反应,最终因患者眼压持续升高,难以控制,结束治疗。
回顾整个病程,患者玻璃体切除术中即发现其眼内感染严重,脉络膜脓肿较大,术后玻璃体腔内填充硅油,复位脱离的视网膜和脉络膜,尽可能地保眼球,但硅油的存在一定程度上阻碍了玻璃体腔内药物的扩散,影响了后续治疗;其次,眼内液培养阳性率低,异地检测耗时久,致病菌极其少见,缺乏明确的用药指导;患者多次手术后眼内感染及炎症反应仍难以控制,眼压升高,疼痛难忍,患者对后续治疗失去信心,最终结束病程。虽然本病例最终治疗失败,但其治疗过程中的经验教训值得我们认真思考总结,希望能够引起临床医生对鼻疽诺卡菌眼内感染的重视。
目前鼻疽诺卡菌感染所引起的眼内炎、脉络膜脓肿等相关的报道呈逐年上升趋势,因此,当免疫缺陷、免疫力低下尤其是长期服用皮质类激素、免疫抑制剂的患者出现眼内炎、脉络膜脓肿的症状、体征时,在考虑内源性真菌感染的同时,还应警惕鼻疽诺卡菌感染的可能。通过本病例,我们对鼻疽诺卡菌感染有了初步的认识,同时也为今后的诊断、治疗积累了一定的经验。由于鼻疽诺卡菌感染较为少见,缺乏特异性,实验室病原学培养检测耗时久,阳性率低,常延误治疗时机,而基因检测可以在疾病发生的早期为临床医师提供快速、准确的诊断依据,为疾病的治疗赢得了宝贵的时间,值得借鉴和推广。
利益冲突申明本研究无任何利益冲突
作者贡献声明左程友:收集数据,参与选题、设计及资料的分析和解释;撰写论文;根据编辑部的修改意见进行修改。陈燕:收集数据,参与选题、设计及资料的分析和解释;修改论文中关键性结果、结论;根据编辑部的修改意见进行核修。江国华:收集数据、参与选题、设计和修改论文的结果、结论;根据编辑部的修改意见进行修改。董诺:参与选题、设计、资料的分析和解释,修改论文中关键性结果、结论,根据编辑部的修改意见进行核修

