直接硼氢化钠-过氧化氢燃料电池电极材料的研究现状
宋聪颖, 王贵领
(1.哈尔滨工程大学 材料科学与化学工程学院, 哈尔滨 150001; 2.山东大学 前沿交叉科学青岛研究院,青岛 266237)
0 引 言
燃料电池是一类能够将储存在燃料中的化学能转化为电能的电化学装置[1]。与传统的热力发电相比,燃料电池的发电过程是基于燃料分子与氧化剂分子的化学结合而发生的,仅涉及化学能到电能的一步转化。而热力发电则需要通过燃烧的方式首先将化学能转化为热能,再由热能转化为机械能,最终转化为电能。由于避免了燃烧过程,燃料电池被认为是一种高效、无污染的发电装置。此外,燃料电池在发电过程中几乎没有旋转或者移动的部件,意味着它可以无噪音、无振动地安静运行。而燃料电池固有的模块化特性也使其具有简单、紧凑的结构,以及高的功率密度和能量转化效率。这些特性使得燃料电池在众多领域展现出巨大的应用前景。
随着燃料电池的不断发展,可以应用于燃料电池的燃料也逐渐多样化,包括氢气、甲烷、甲醇、乙醇和甲酸等等[2]。氢气作为最初应用于燃料电池的燃料,其氧化产物为水,实现了零污染发电过程[3]。然而氢气大多通过化石燃料重整制得,不可避免地需要消耗化石燃料,且其制备过程涉及二氧化碳排放的问题。此外,氢气作为气体,也面临着运输和储存困难的问题。甲烷、甲醇等含碳化合物,除了依赖于化石燃料之外,在氧化过程中容易造成催化剂中毒现象。这使得开发毒性低、运输和储存方便、绿色无污染、电化学活性高的新型燃料成为了亟待解决的问题[4]。除了燃料的选择之外,燃料电池的发电效率很大程度上取决于催化剂的作用,它决定了是否能够迅速地将燃料中的化学能释放出来。另外,催化剂的制备工艺和生产成本也是衡量催化剂可行性的重要指标。因此,越来越多的研究者致力于开发新型燃料和高效、低成本的催化剂以推动燃料电池的进一步发展。
1 DBHPFC简介
1.1 DBHPFC的提出
NaBH4是一种与众不同的液体燃料,不含C元素。在发电过程中不会产生CO2,也不会产生造成催化剂中毒的CO[5]。与另一个不含C元素的液体燃料肼相比,NaBH4的毒性更低,能量密度更高。NaBH4作为阳极燃料、O2作为阴极氧化剂时,其电池的理论电位可以达到1.64 V,明显高于其他液体燃料电池和传统氢氧燃料电池的理论电位,如表1所示。
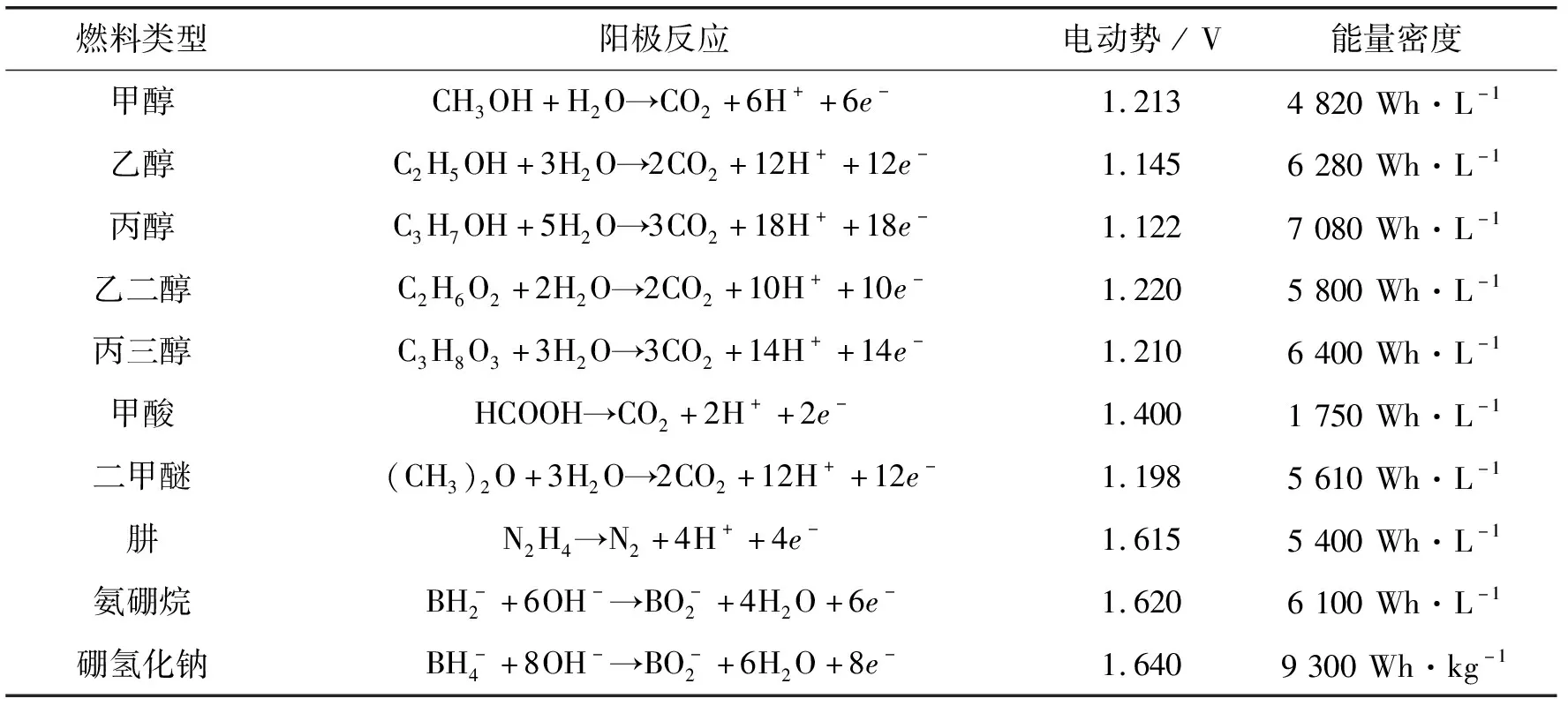
表1 不同液体燃料的阳极反应式、理论电动势(以O2作为阴极氧化剂)和能量密度

1.2 DBHPFC的工作原理
在DBHPFC中,阳极反应和阴极反应如式(1)和式(2)所示,DBHPFC在碱性条件下的工作原理如图1所示[9]。

图1 碱性条件下DBHPFC的工作原理示意图[9]
(1)
(2)
从上式中可以看出,使用H2O2代替O2作为阴极氧化剂,可以获得更高的电池理论电压(2.11 V),这一数值明显高于直接甲醇氧气燃料电池(1.21 V)和氢氧燃料电池(1.23 V)[10]。当然,DBHPFC的这一优势是建立在NaBH4和H2O2能够在阳极和阴极发生直接氧化和还原反应的前提下。在阳极区域,NaBH4可能会发生水解反应产生H2,H2的氧化反应会对阳极电势产生一定的影响。在阴极区域,H2O2水解产生的O2的还原反应也会产生混合电势。除了碱性介质外,H2O2还可以在酸性介质中发生还原反应,如式(3)所示。DBHPFC在酸性条件下的工作原理如图2所示。

图2 酸性条件下DBHPFC的工作原理示意图[9]
4H2O2+8e-+8H+→ 8H2O,E0= 1.77 Vvs.SHE
(3)
如果H2O2在酸性介质中发生还原反应,DBHPFC的理论电压可以高达3.01 V,比碱性介质中的理论电压还要高0.9 V。因此,如果能够有效抑制燃料和氧化剂的分解作用,DBHPFC将会提供比直接甲醇氧气燃料电池和氢氧燃料电池更高的能量输出。
2 NaBH4的电氧化反应
(4)
(5)

H2+2OH-→2H2O+2e-,E0=-0.828 Vvs.SHE
(6)

(7)
(8)
(9)


(10)
(11)

(12)
M+xH→MHx
(13)
MHx+xOH-→M+xH2O+xe-
(14)

2.1 NaBH4电氧化反应催化剂
Ni、Pt和Pd等催化剂对NaBH4的电氧化反应和水解反应均具有较好的催化活性[27-28]。因此,使用这些催化剂通常可以获得较高的功率密度和较低的法拉第效率。例如Ni电极,其法拉第效率仅为50%。在NaBH4浓度较低的情况下,Pd和Pt催化剂电极可以获得较高的燃料利用率。Celikkan等研究了NaBH4在一系列金属催化剂(包括Au、Pt、Ag、Pd和Ni)表面的电氧化反应[29]。在研究的所有金属中,Au对NaBH4电氧化反应的催化效果最好,而Ni表现出最差的催化活性。Chatenet等发现NaBH4在Au和Ag电极上的电氧化过程可以转移大约7.5个电子,而在Pt电极上转移电子数仅为4[19]。Au和Ag电极上NaBH4的利用率高是因为它们对于NaBH4水解反应的催化活性相对较低。但是在Au和Ag电极表面,NaBH4的电氧化反应动力学较慢,尤其是在Ag电极表面。
胶体Pt、Pt合金、胶体Os、Os合金、Au合金、Ag合金等贵金属合金也可被用于催化NaBH4的电氧化反应[30-32]。Au与Pd或者Pt形成合金后,表面NaBH4的电氧化动力学明显加快且起始氧化电位降低。由于胶体Au的颗粒尺寸大于Pt和Pd的颗粒尺寸,因此形成合金后,合金催化剂的颗粒尺寸小于胶体Au的颗粒尺寸,这可能是导致催化剂活性提高的原因。但是,仍然需要进一步的研究来确定粒径尺寸对电极反应动力学以及反应机理的影响。
在非贵金属中,Ni是研究的最广泛的NaBH4电氧化反应催化剂[28]。这是由于Ni对吸附氢和含氢的不饱和氢化物具有独特的亲和力。而且,Ni也是储氢合金材料(如AB2和AB5型合金)的主要成分[33]。与Pd催化剂相比,Ni电极上可以得到更负的开路电位和更低的库伦效率。相反,Pd则具有较高的开路电位和较高的库伦效率。因此,将Pd和Ni进行复合将有利于提高电池的性能[34]。如果加入Ag和Au,将会更加有效地抑制H2的析出反应[35]。但是Ni电极表面会逐渐生成稳定的氧化物或者氢氧化物,导致电极在长期使用过程中的极化现象加剧[36]。

储氢合金是另一类可用于NaBH4电氧化反应的金属催化剂,它们具有可逆吸附和释放氢的能力。在众多储氢合金中,AB2和AB5型储氢合金在储氢能力和使用条件方面都是最有优势的两类储氢合金[40]。由于储氢合金能够吸附大量的氢,因此可以减缓H2的析出。此外,特殊的表面处理可以进一步提高其电化学性能。对于Zr基AB2型储氢合金,经过F处理后,其比表面积明显增大且Ni覆盖的表面增多。Wang等制备了LmNi4.78Mn0.22储氢合金并用于直接硼氢化钠燃料电池[41]。他们发现,经过表面修饰的LmNi4.78Mn0.22储氢合金电极表面H2的生成速率明显降低,燃料利用率得到了提高。
传统的电极制备方法通常是将催化剂粉末、异丙醇、Nafion或者PTFE混合得到浆料,然后将浆料涂覆或者喷至碳纸或者碳布等集流体表面。Nafion的使用可以提高电极的离子导电性。Kim等报道,增加25 wt.%的Nafion用量可以有效降低接触电阻并提高电池的性能。但是当Nafion的用量超过25 wt.%后,电池的性能反而降低[42]。这是由于作为电子绝缘体,过多的Nafion使得电极的导电性变差,电极的极化现象加剧。此外,Nafion等聚合物黏结剂价格昂贵,其大量使用会增加电极成本。
2.2 NaBH4电氧化反应催化剂的集流体材料
根据之前的报道可以看出,催化剂颗粒的均匀分散可以有效提高催化剂的利用率,并使其发挥出最佳的催化活性。但是在传统的电极制备方法中,黏结剂的使用以及简单的机械混合通常使得催化剂颗粒聚集在一起,并且被黏结剂所包裹。催化剂颗粒的聚集使催化剂无法充分暴露活性表面,而黏结剂的包裹会降低电极的导电性,最终影响电极的催化活性,这使得导电集流体的使用得到了越来越多人的关注。如果能够将催化剂直接均匀生长在集流体的表面,不仅可以避免使用黏结剂,还能达到有效分散催化剂的目的,使催化剂表面能够充分与反应物接触,实现催化剂的高利用率。
集流体通常需要具有较大的比表面积和良好的导电性,以保证电极能够充分发挥催化作用。目前,使用较多的集流体材料大致可以分为两大类:金属集流体和碳材料集流体。金属集流体包括泡沫镍(Ni foam)[43]、泡沫铜(Cu foam)[44]和钛板(Ti plate)[45]等。碳材料集流体包括碳布(Carbon cloth)[46]和碳海绵(Carbon sponge)[47]等。Liu等采用电沉积的方法在泡沫铜集流体表面得到了具有三维多孔结构的Co-P/Cu foam催化剂电极[44]。电沉积得到的Co-P和泡沫铜之间具有非常强的结合力,并且三维多孔结构可以使催化剂表面与电解液充分接触。电化学测试结果表明,NaBH4电氧化反应在该电极上的转移电子数为6。Ding等采用化学镀的方法将CoB催化剂制备到泡沫镍的表面,得到了CoB/Ni foam电极,其结构如图3所示[43]。CoB的沉积并没有堵塞泡沫镍的孔道结构,只是均匀沉积在泡沫镍的表面。与CoB直接涂覆至泡沫镍表面得到的电极相比,化学镀方法得到的三维多孔电极对NaBH4电氧化反应表现出更好的催化活性和稳定性。采用CoB/Ni foam电极组装的直接硼氢化钠-氧气电池在40 ℃时的峰功率密度可以达到230 mW·cm-2。除了泡沫金属之外,钛板因其良好的稳定性和导电性也被用作支撑NaBH4电氧化催化剂的集流体。Selskis等首先通过化学镀的方法在钛板表面得到一层金属Co,接着利用伽伐尼置换的方法将Co/Ti plate置于HAuCl4的溶液中,最终得到了Au-Co/Ti催化剂电极[48]。电化学测试结果表明,与Au/Ti电极相比,Au-Co/Ti电极对NaBH4电氧化反应的催化活性更高,但是副产物H2的产量也更大。

图3 (a)NaBH4在CoB/Ni foam电极表面反应示意图;(b)CoB/Ni foam电极的SEM图;(c)CoB/Ni foam电极组装的直接硼氢化钠-氧气电池的性能图[38]
碳材料集流体是另一类常用的NaBH4电氧化催化剂的支撑材料。Binder等将AuPd合金电沉积到碳布表面[8]。碳布的使用使得AuPd颗粒得到了均匀分散,降低了催化剂颗粒发生团聚的风险。AuPd/Carbon cloth电极上NaBH4电氧化反应的转移电子数为6.9。随后,他们又使用该电极组装了直接硼氢化钠-氧气电池,在70 ℃的温度条件下,功率密度可以达到60 mW·cm-2。Ye等将日常生活中常见的海绵进行了碳化处理得到了碳海绵[47]。这种碳海绵具有与泡沫镍类似的三维多孔道结构,有利于催化剂表面与反应物的充分接触。通过改变电沉积的条件得到了三种不同形貌(多孔、片状和球形)的Co/carbon sponge 电极,如图4所示。其中,碳海绵支撑的片状Co催化剂电极表现出最好的催化活性。在1 mol·L-1NaOH和0.12 mol·L-1NaBH4溶液中,电位为-0.55 V时,Co/carbon sponge 电极上NaBH4的氧化电流密度可以达到248 mA·cm-2。此外,在该电极上,NaBH4电氧化反应所需要的活化能仅为10.18 kJ·mol-1。
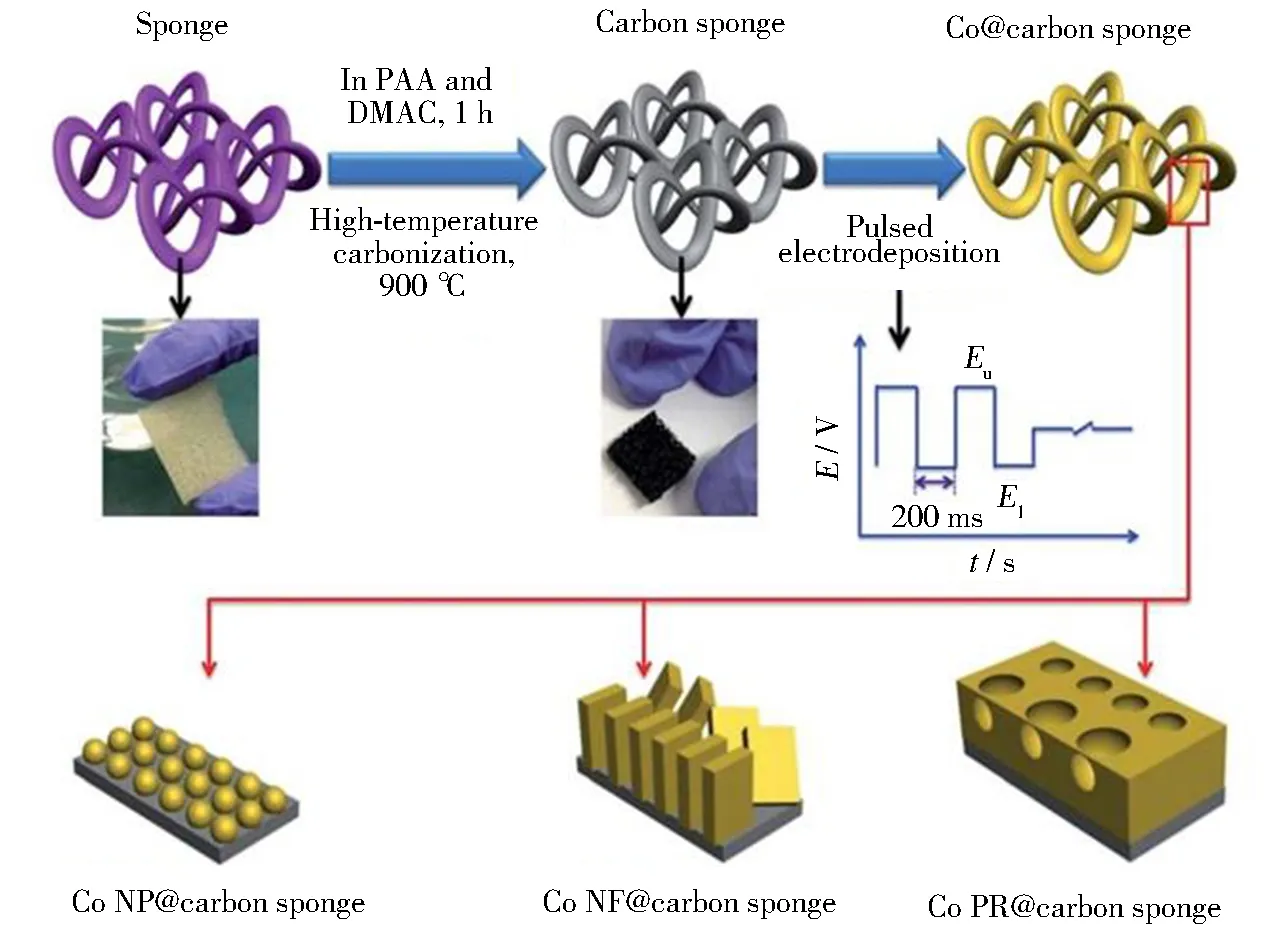
图4 Co@carbon sponge电极的制备示意图[41]
由此可以看出,集流体在电极中不仅起到导电的作用,其对催化剂材料的支撑作用对于电极的性能具有非常重要的影响。集流体通常具有三维立体的结构,对催化剂具有很好的分散作用,可以在一定程度上避免催化剂颗粒发生严重团聚而导致利用率降低。此外,催化剂可以通过多种方式(例如溶剂热、电沉积、化学沉积和伽伐尼置换等)直接生长在集流体的表面。通过以上方法制备的电极,催化剂与电极之间通常具有较强的结合力,可以在长时间的使用过程中保持结构的稳定。
3 H2O2的电还原反应
航空航天技术和水下动力系统的不断发展对燃料电池提出了新的要求。传统燃料电池多采用O2作为阴极氧化剂,但是在太空和水下等无氧的条件下,O2的大量使用受到了一定的限制,寻找可代替O2的新型阴极氧化剂成为许多研究者关注的新问题。H2O2作为一种液体强氧化剂,其还原反应的理论电压高,且运输和储存便利,被人们认为是可以代替O2的新型阴极氧化剂。H2O2在酸性和碱性介质中的电还原反应过程如式(2)和式(3)所示。与O2的电还原反应(4e-过程)相比[49],H2O2的电还原反应仅涉及2个e-,并且在固-液两相界面发生,而O2的电还原反应需要在固-液-气三相界面区域发生,难度更大。根据文献[50]的报道,H2O2的电还原反应速率比O2的电还原反应速率高6个数量级。因此,采用H2O2作为阴极氧化剂的燃料电池可以获得比采用O2作为氧化剂的燃料电池更高的性能。
但是在阴极催化剂的作用下,H2O2容易发生自分解反应生成O2和H2O,如式(15)所示。产生的O2吸附在电极表面发生进一步还原,如式(16)所示。如果产生的O2从电极表面逸出,则会导致H2O2利用率降低。
H2O2→H2O+(1/2)O2
(15)
O2+2H2O+4e-→4OH-
(16)
E(H2O2)=1.78-0.059pH
(17)
以H2O2作为氧化剂的阴极电位与pH相关[51-52],如式(17)所示。同时,pH也会影响H2O2自分解反应的速率。当pH较低时,H2O2更容易发生直接电还原。当pH较高时,H2O2发生自分解反应的概率增大,H2O2发生直接电还原的同时伴随着O2的还原。由于O2电还原的电位低于H2O2电还原的电位,因此当pH升高时,电极电位为两个反应的混合电位。此时,O2电还原的电位对电极电位的影响更大,导致电极电位的降低。随着溶液pH的改变,H2O2阴极开路电位在1.64~3.02 V内变化[53]。
3.1 H2O2电还原反应催化剂
与O2的电催化还原不同,关于H2O2电催化还原的研究非常有限。Pt是广泛用于O2电还原反应的催化剂,它对H2O2的电还原反应同样具有催化作用。但是,在Pt催化剂的作用下,H2O2的自分解速率也会加快,不利于H2O2的充分利用。其他贵金属和贵金属合金,例如Pd-Ir、Pd-Ag、Ag和Au也被报道可以用作H2O2电还原反应的催化剂[54]。Sequeira等研究了碳负载二元Pt0.75Co0.25合金和Pt0.75Ni0.25合金对H2O2电还原反应的催化活性,并与Pt/C催化剂进行了比较[55]。实验结果表明,碳负载的Pt0.75Ni0.25合金的催化活性与Pt/C催化剂相当,碳负载的Pt0.75Co0.25合金在三者中表现出最佳的催化活性。Dimcheva等采用电沉积方法制备了Pd-Pt和Pd-Au合金作为H2O2电还原反应的催化剂[56]。在-0.6~0 V的电位范围内,循环伏安结果显示,Pd-Pt和Pd-Au合金催化剂的催化性能明显高于相同方法制备的单金属催化剂的催化活性,这表明Pd和Pt或者Au在催化H2O2电还原的过程中具有协同作用。X-射线衍射(XRD)和扫描电子显微镜(SEM)的结果表明,Au的加入使得Pd由纳米颗粒状转变为菜花状,且粒径随着Au浓度的增加而减小。Pt与Pd共沉积形成了椭圆形颗粒,随着Pt含量的增加,Pd-Pt合金颗粒先增大后减小。这一结果显示,合金催化剂的形成不仅影响催化性能,也会改变催化剂的形貌。
贵金属和它们的合金虽然可以有效催化H2O2的电还原反应,但是同样会在一定程度上促进H2O2的自分解反应,并且贵金属有限的储量和高昂的价格也是限制它们实际应用的重要因素。因此,寻找能够替代贵金属的低价催化剂成为了迫切需要。近年来,具有纳米结构的过渡金属氧化物催化剂,例如Mn3O4[57]、Co3O4[58]和CuO[59]等被报道对H2O2的电还原反应具有较好的催化活性。其中,Co3O4因其优异的催化活性和稳定性而备受关注。然而,Co3O4作为金属氧化物本身具有电子导电性差的问题,会加剧电极的极化现象,进而增大电池的内阻,因此有必要对过渡金属氧化物进行改性或者与其他材料复合来提高电子导电性。Wu等利用水热合成法和退火处理制备了多孔Au膜层负载Co3O4纳米片催化剂电极[60]。Au膜层的支撑作用提高了电极的整体导电性,其三维多孔结构以及Co3O4的纳米片结构均有利于与电解液充分接触,因此获得了优异的催化活性。
除了贵金属和过渡金属氧化物,铁卟啉配合物[61]、铜三嗪配合物[62]和普鲁士蓝[63]等也可以作为H2O2电还原反应的催化剂。但是它们的催化活性远不及贵金属,且在高浓度H2O2溶液中的稳定性也有待提高。此外,酶作为H2O2电还原反应的催化剂具有高的还原电位并且不会催化O2的析出,然而酶需要在特定的环境中工作,在高浓度H2O2溶液中和高温条件下容易失活而失去催化活性。
3.2 H2O2电还原反应催化剂的集流体
与NaBH4电氧化反应相似,H2O2的电还原反应也可使用贵金属作为催化剂。为了提高贵金属的利用率,许多研究者选择将贵金属负载于集流体的表面,保证贵金属能够得到有效的分散和充分发挥催化作用。过渡金属氧化物虽然对H2O2的电还原反应也表现出高效的催化作用,但是单独使用时,其自身较差的电子导电率将会影响其催化作用。将过渡金属氧化物原位生长于集流体表面也是一种改善其催化性能的方法。过渡金属氧化物与集流体表面的紧密接触能够促进二者之间的电子转移,有效缓解电极的极化现象。
目前,应用于H2O2电还原反应催化剂的集流体大致分为两类:金属集流体(泡沫镍(Ni foam)、铜箔(Cu foil)、钛板(Ti plate)等)和碳材料集流体(碳布(Carbon cloth)、碳纸(Carbon paper)等)。Yang等通过简单的电沉积方法在碳布表面制得了松针状的Au催化剂(Au/carbon cloth)[64]。由于碳布的比表面积较大,Au松针可以在其表面均匀分散,不会发生明显的团聚现象。电化学测试结果表明,Au/Carbon cloth电极在酸性体系中对H2O2的电还原反应具有优异的催化活性。在3 mol·L-1H2SO4和0.1 mol·L-1H2O2溶液中,Au/Carbon cloth电极上的电流密度可以达到-0.72 A·cm-2·mg-1。Zhang等将石墨涂覆于A4纸表面(图5),得到了一种新颖的柔性导电集流体[65]。通过电沉积和化学还原的方法,在该集流体上制得了Pd修饰Co纳米片催化剂。该催化剂电极在不同电位条件下均表现出良好的催化稳定性,并且这种石墨修饰的A4纸集流体具有价格低廉、质量轻的优点,会减轻电池系统的整体重量,有利于获得更大的能量密度。
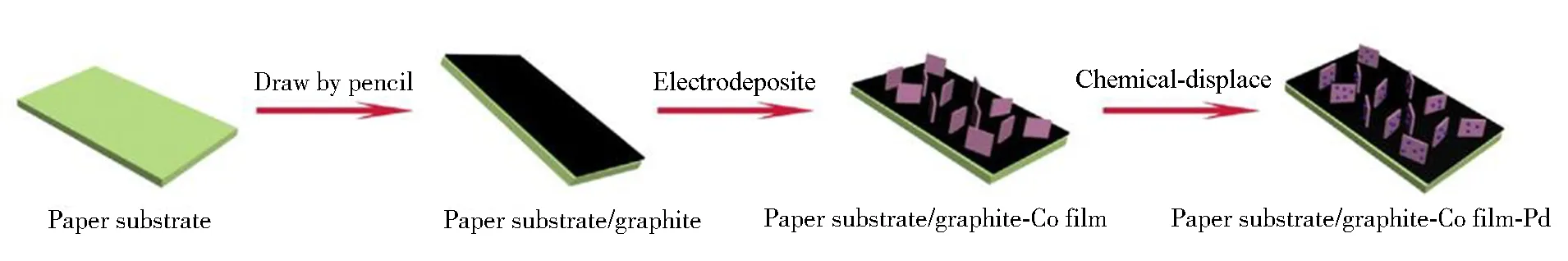
图5 石墨修饰A4纸负载Pd修饰Co纳米片电极的制备过程示意图[59]
泡沫镍是一种具有三维多孔道结构的金属集流体,不仅可以用于构建NaBH4电氧化反应的催化电极,也可用作支撑H2O2电还原反应的催化剂。Cao等首先将一层具有多孔结构的Co电沉积至泡沫镍的骨架上,接着利用伽伐尼置换方法在Co的表面制得一层贵金属Au,最终得到了泡沫镍负载的Au修饰Co催化电极(AuCo/Ni foam)用于H2O2的电还原反应[59, 66]。泡沫镍的支撑作用和多孔Co层提供的较大比表面积使表面的贵金属Au催化剂得到了充分的利用。在3 mol·L-1KOH和0.5 mol·L-1H2O2溶液中,电位为-0.3 V时,AuCo/Ni foam电极上的还原电流密度达到了-0.66 A·cm-2·mg-1,而采用相同方法得到的泡沫镍直接负载Au(Au/Ni foam)电极上,此时的电流密度仅为-0.16 A·cm-2·mg-1。铜箔是另一种常见的金属集流体,Li等在铜箔表面制得了具有纳米线团簇结构的CuO,该电极上H2O2的起始还原电位与贵金属电极上的起始还原电位相当[60]。Wang等通过化学气相沉积方法对传统的钛合金集流体进行了修饰,在钛合金表面得到了均匀的碳包覆的TiC纳米棒阵列(C@TiC),接着在C@TiC表面得到了一层多孔Pd催化剂(图6)[67]。C@TiC的支撑作用和Pd的多孔结构使得Pd暴露出巨大的活性比表面积,因此该电极对H2O2电还原反应展现出优异的催化活性,在2 mol·L-1H2SO4和2 mol·L-1H2O2溶液中,电位为-0.2 V时,电极上的还原电流密度高达3.47 A·mg-1,这一数值高于大多数文献中报道的数值[68-70]。由此可以看出,具有较大比表面积的集流体对催化剂的支撑作用,可以使得催化剂更好地暴露出反应位点,充分与电解液接触,因此获得更高的催化剂利用率。
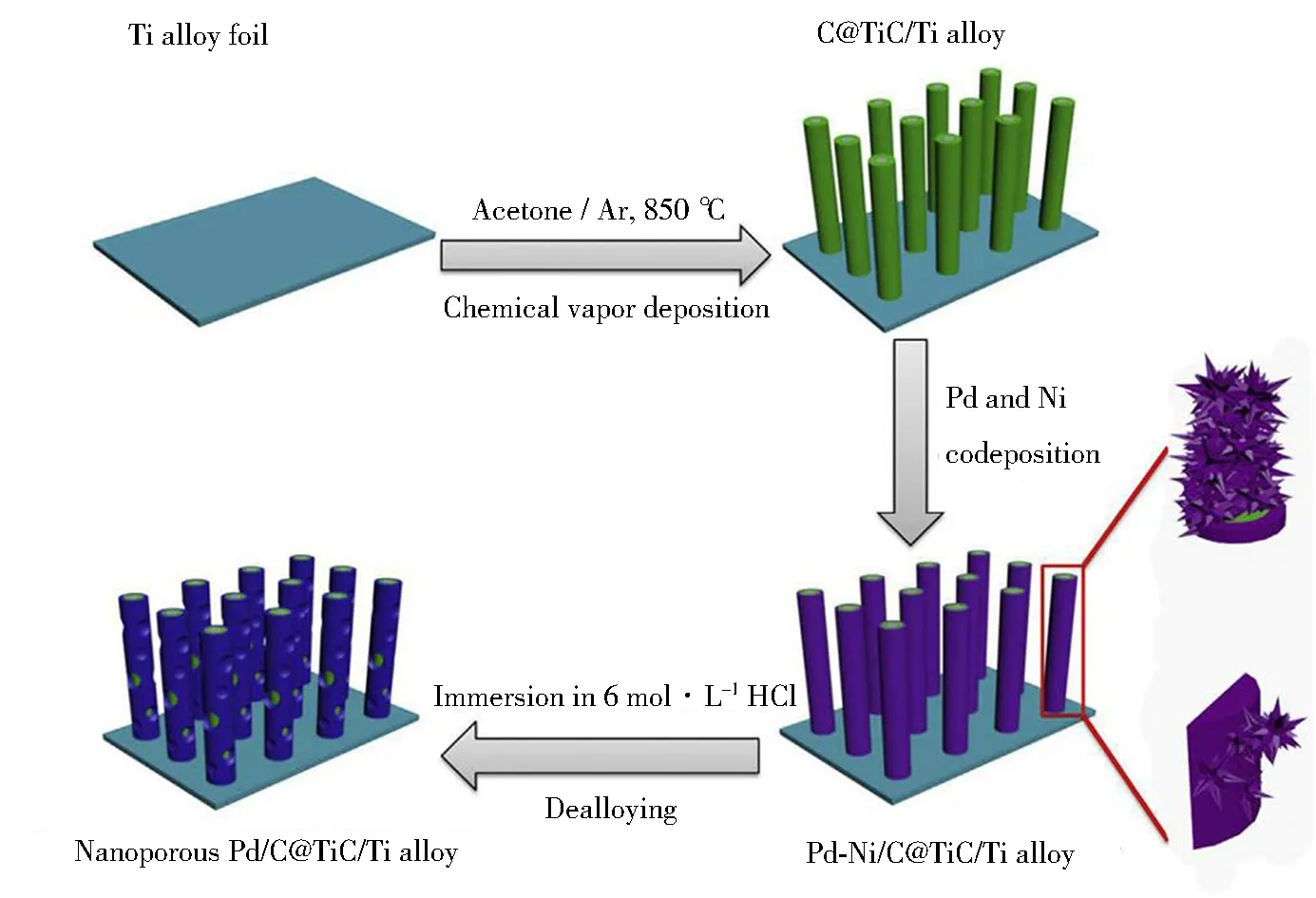
图6 Pd/C@TiC/Ti alloy电极的制备过程示意图[61]
4 前景和展望
DBHPFC是一种新型液体燃料电池,具有能量密度高、燃料运输和储存方便等显著优势。目前,关于DBHPFC的研究大多集中在设计具有优异催化活性的电极材料方面,燃料的利用率和电极成本的问题未能得到很好的兼顾。如果能够克服工作过程中NaBH4水解反应和H2O2自分解反应引起的燃料和氧化剂利用率低的问题,DBHPFC将会在水下军事设备和航天器中展现出巨大的应用潜能。寻找对NaBH4的直接电氧化反应和H2O2的直接电还原反应具有良好催化性能和选择性的催化剂是未来DBHPFC发展面临的重要挑战。在传统电极材料(无论是阳极还是阴极)的制备过程中,粘结剂的使用不仅增加电极成本,也会对电极的稳定性产生影响。因此,为了提高催化剂的利用率,获得更有效的催化作用,可以从以下几个方面对催化剂电极进行设计:(1)采用具有三维立体结构的导电集流体支撑催化剂,使得催化剂能够得到均匀的分散,保证与反应物的充分接触;(2)通过调节催化剂的组分和结构,改善催化剂对电极反应的催化选择性,兼顾催化活性与选择性;(3)为了减少传统贵金属的用量,减小贵金属催化剂的粒径尺寸并与其他具有特殊结构的催化剂进行复合,使二者能够发挥协同作用,从而获得比单一贵金属更好的催化性能。
——庆祝中国共产党成立一百周年贵金属纪念币展

