液相色谱法测定小麦粉中赭曲霉毒素A不确定度评估
王玉梅,刘 真,李 丹,杨军丽
(南京市食品药品监督检验院,江苏南京 211198)
赭曲霉毒素A(Ochratoxin,OTA)是由多种青霉属和曲霉属真菌产生的代谢产物,目前在多种粮食及制品中都检测出OTA的情况[1]。人和动物进食被OTA污染的食物后,由于OTA在体内代谢较慢,会在体内蓄积,目前粮食及其制品中的OTA的检测情况已引起国内外的高度关注[2]。我国目前还没有关于人群OTA膳食摄入量的评价研究,但食品安全国家标准规定了谷物等粮食及制品中OTA的限量为5 μg/kg,同时指明了其方法标准为GB 5009.96—2016[3]。本文参照《化学分析测量不确定度评定》(JJF 1135—2005)[4]和《测量不确定度评定与表示》(JJF 1059.1—2012)[5],依据《食品安全国家标准 食品中赭曲霉毒素A的测定》(GB 5009.96—2016)[3]分析小麦粉中赭曲霉毒素A的不确定度,为实验室质量控制提供科学准确的依据。
1 材料与方法
1.1 材料与试剂
赭曲霉毒素A标准品(PriboFast,CAS号303-47-9,纯度为99.0%);色谱级乙腈、甲醇、冰乙酸;分析纯氯化钠、碳酸氢钠、磷酸二氢钾、浓盐酸;阳性小麦粉样品(实验室自制)。
1.2 仪器与设备
岛津液相色谱仪(LC-20AD);电子天平;离心机;涡旋振荡器;赭曲霉毒素A免疫亲和柱(PriboFast,≥100 mg,3 mL),定量滤纸,玻璃纤维滤纸。
1.3 前处理方法
按GB 5009.96—2016[3]标准方法。粮食和粮食制品。样品需全部粉碎且通过孔径1 mm的筛后混匀后备用。称取试样25.0 g,加入100 mL乙腈水溶液(体积比6+4),高速均质3 min,准确量取滤液4 mL后加入26 mL磷酸盐缓冲液(PBS),并充分混合均匀,置于高速离心机中离心(10 000 r/min,5 min),取上清待过柱备用。将全部滤液过赭曲霉毒素A免疫亲和柱(PriboFast,≥100 mg,3 mL),依次使用10 mL PBS缓冲液、10 mL水淋洗赭曲霉毒素A免疫亲和柱,弃去流出液并抽干小柱,最后使用1.5 mL的甲醇洗脱,用干净离心管收集洗脱液,置于氮气仪吹干(45 ℃)。用流动相溶解残渣并定容到500 μL,供上机检测。
1.4 样品中赭曲霉毒素A残留量计算
样品中赭曲霉毒素A残留量计算如式(1)所示。

式中:X—样品中赭曲霉毒素A残留量,μg/kg;C—仪器检出目标物浓度,ng/mL;V—试样最终定容体积,mL;m—样品称样量,g;K—稀释倍数,K=25。
2 结果与分析
2.1 仪器测定赭曲霉毒素A含量C产生的不确定度
赭曲霉毒素A含量的不确定度主要包括以下两个方面,即配制标准储备溶液产生的不确定度,标准曲线配制产生的不确定度。
2.1.1 标准储备液配制产生的不确定度Uc(1)
于10 mL容量瓶中放入准确称取的10 mg的赭曲霉毒素A标准品(纯度>99%),用甲醇溶解后并定容至容量瓶刻度,得到标准储备液,其浓度为1 000 μg/mL。
(1)赭曲霉毒素A标准品纯度产生的不确定度。从其标准物质证书中获取相关信息,赭曲霉毒素A标准品的纯度>99%,按均匀分布来计算,由其纯度产生的相对不确定度分别为
(2)称量赭曲霉毒素A标准品产生的不确定度。《数字指示秤》(JJG 539—2016)标准中规定了:在0~5 g称量范围内,电子天平的最大允许误差为±0.05 mg,因此可以得到天平称量标准品时的产生的相对不确定度为
(3)配制赭曲霉毒素A标准储备液时由定容体积产生的不确定度。《常用玻璃量器检定规程》(JJG 196—2006)[6]标准中规定,温度为20 ℃时100 mL的A级容量瓶允差误差为±0.1 mL,按对称分布计算不确定度为温度为20 ℃,定容液甲醇的体积膨胀系数为1.1×10-3/℃,按均匀分布计算,100 mL的容量瓶由温度产生的体积不确定度为综合以上两部分合成得到的相对标准不确定度为
2.1.2 稀释赭曲霉毒素A标准储备液过程中产生的不确定度Uc(2)
火烧油层技术虽然驱油效果较好,但其有诸多技术难点:无法控制地下真实燃烧状态;对燃烧带前缘的调整与控制;点火、注气、举升工艺对装备的要求较高;产出流体的检测和安全环保控制较难。
稀释过程中使用1 mL的移液管移取赭曲霉毒素A标准储备液1 mL于100 mL A级容量瓶中,用甲醇稀释定容至刻度,得到浓度为10 μg/mL标准中间溶液1;移取1 mL标准中间溶液1,用甲醇定容于100 mL A级容量瓶中,得到标准中间溶液2,浓度为100 ng/mL。取均匀分布,产生的不确定度见表1。
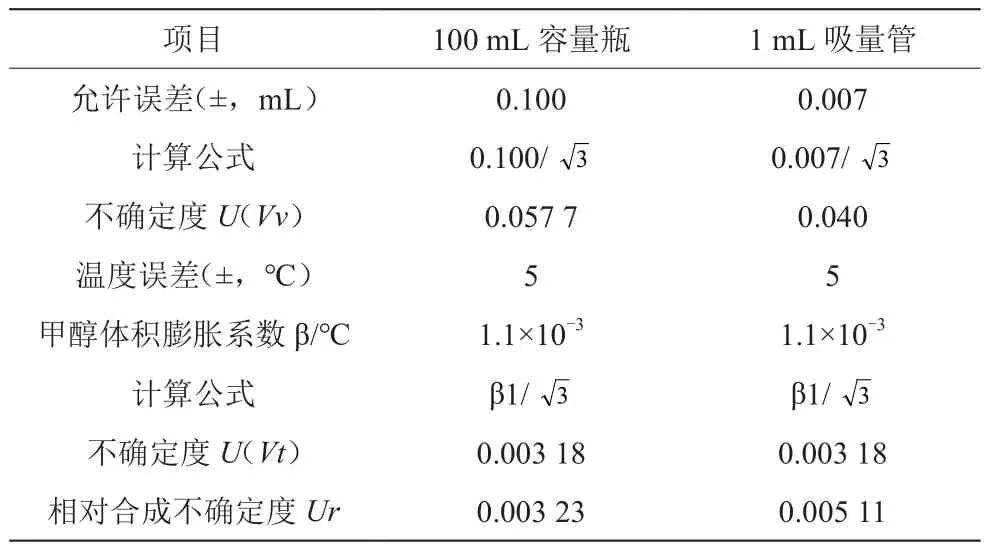
表1 稀释赭曲霉毒素A标准储备液过程中引入的不确定度
由储备液稀释过程产生的相对标准不确定度为:
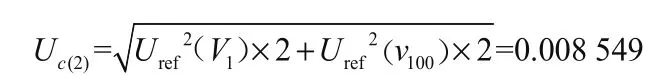
2.1.3 赭曲霉毒素A标准曲线制作及拟合产生的不确定度Uc(3)
移取适量流动相将赭曲霉毒素A标准溶液稀释成浓度为 0.5 ng/mL、1 ng/mL、2 ng/mL、5 ng/mL、10 ng/mL、20 ng/mL和50 ng/mL的标准系列溶液,进样体积为50 μL,每个点均平行测定2次,测定数据见表2。

表2 赭曲霉毒素A标准曲线数据
取阳性小麦粉样品,对其中赭曲霉毒素A浓度C0进行2次重复检测,结果见表3。通过高效液相色谱自动定量软件分析得到相应色谱峰面积A,拟合得到线性回归方程Ai=aCi+b,其中a为斜率,b为截距。
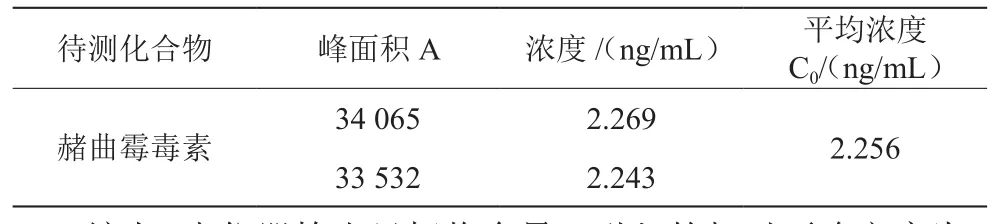
表3 阳性小麦粉样品测量数据
由标准曲线拟合产生的不确定度为
Uc(3)=,其中SR为标准溶液峰面积残差的标准差n为测试次数,本试验中n=7×2=14;p为对C0的测定次数,为标准溶液平均浓度,则Uc(3)=0.742 1,0.032 89。

2.2 测量重复性产生的不确定度U()
在空白小麦粉试样中添加1.0 μg/kg的赭曲霉毒素A标准溶液,平行测定6次,测定结果见表4。计算得到

表4 小麦粉中赭曲霉毒素A测定结果
2.3 由试验回收率引入的不确定度U(R)
2.4 称量样品时产生的不确定U(m)
按本试验要求,称取小麦粉25 g,电子天平最大允差是±0.005 g,取均匀分布,其产生的相对不确定度为
2.5 量取体积时产生的不确定U(V)
量取体积产生的不确定度主要分为定容体积和进样体积两部分引入的不确定度组成。
2.5.1 定容体积产生的不确定度U(V1)
小麦粉样品按照试验方法经提取净化,最终使用1 mL A级移液管定容至0.50 mL,允差为±0.007 mL,取均匀分布,其相对不确定度为
2.5.2 上机体积产生的不确定度U(V2)
高效液相色谱进样针容积相对标准偏差为±1%,取均匀分布,其相对不确定度
结合以上两部分引入的不确定度,由体积量取引入的合成不确定度为
3 合成不确定度
U(x)=依据JJF 1135—2005[5],在95.45%的置信水平下,取包含因子k=2,赭曲霉毒素A的测定值为1.12 μg/kg,扩展不确定度
4 测定结果
按照该方法测定小麦粉中赭曲霉毒素A的结果为:


