射干种子萌发抑制物特性研究
杜逍,陈昊天,梁伟玲,赵敏,刘艳芬,武玉翠
(河北工程大学园林与生态工程学院,河北 邯郸 056038)
射干(Belamcanda chinensis L.)为鸢尾科射干属多年生直立草本药用植物,以黄褐色块状根茎入药,味苦、性寒,有清热解毒、消痰、利咽的功效,可用于热毒痰火郁结、咽喉肿痛、痰涎壅盛、咳嗽气喘的治疗[1]。成熟种荚分3 室,每室有3~11 粒种子,种子近球形,质地坚硬,外被黑色有光泽的假种皮,内部有细网纹[2]。目前,射干主要靠种子和根茎繁殖。由于根茎繁殖效率较低,且容易导致药材品质退化,因此应尽量寻求种子繁殖。但是,在自然状态下,射干种子发芽率较低、发芽不整齐,且萌发时间较长,需要20~30 d。因此,提高种子发芽率,缩短萌发时间,是提高射干繁殖效率的关键所在[2,3]。
利用射干种子吸水试验,通过观察去皮和带皮射干种子的萌发情况,研究种皮对射干种子萌发的影响;并进一步利用射干种皮和胚乳浸提液对小麦种子萌发及幼苗生长的影响试验,探究影响射干种子萌发的内源抑制物质及其存在部位,旨为提高射干繁殖的生产效率提供参考。
1 材料与方法
1.1 试验材料
射干种子采自河北工程大学校园内,晒干后备用。小麦品种为金麦54 号,由河北金穗种业开发有限公司生产。射干种苗栽培基质购自河北奥龙园艺有限公司。
1.2 试验方法
1.2.1 射干种子形态观察 选取饱满的射干种子,肉眼观察其结构特征;然后放到蒸馏水中浸泡24 h[4],用解剖针剥开种皮,置于放大镜下观察种皮和胚乳的形态。
1.2.2 射干种子吸水性测定 取带皮射干种子2 g,置于装有50 mL 蒸馏水的100 mL 烧杯中浸泡,每隔一定时间取出称重1 次。先用滤纸吸干种子表面浮水,称重后再次吸水,反复数次至种子质量不再变化[5]。绘制射干种子的吸水曲线[6]。
1.2.3 射干种皮对种子萌发的影响 取射干种子若干粒,用机械手段去除其黑色种皮。将去皮和带皮的种子分别播种于装有栽培基质的花盆(直径135 mm、高19 mm)中,播种深度2 cm,播种量50 粒/盆,3次重复,在自然条件下进行培养[6]。播种15 d 后,每天上午观察并记录1 次种子的发芽数量,观察期为1 个月。计算射干种子的发芽率和发芽势:
发芽率=种子萌发数量/50×100%
发芽势=培养22 d 种子的萌发数量/50×100%
1.2.4 射干种子不同部位浸提液对小麦种子萌发和幼苗生长的影响 将射干种皮放入粉碎机内充分打碎,称取0.6 g,用蒸馏水分别定容至10、15 和20 mL,在室温下浸泡36 h 后用定量滤纸过滤,得到浓度分别为0.06、0.04 和0.03 g/mL 的种皮浸提液;取射干胚乳碾碎,称取0.6 g,用蒸馏水定容至10 mL,在室温下浸泡36 h 后用定量滤纸过滤,得到浓度为0.06 g/mL的胚乳浸提液。在直径100 mm 的培养皿中铺4 层滤纸,放置小麦种子100 粒,加入5 mL 射干种子浸提物溶液进行处理,试验设0.06、0.04 和0.03 g/mL 种皮浸提液以及0.06 g/mL 胚乳浸提液4 个处理,以加入5 mL 蒸馏水为对照(CK),每处理均3 次重复。在温度23 ℃、1 200 lx 光照6 h/黑暗6 h 环境下培养,期间每隔2 h 统计1 次小麦种子的萌发数量,计算种子发芽势;培养28 h 后,以小麦种子露白为标准,每隔10 h 统计1 次小麦种子的萌发数量,培养至72 h 结束,计算小麦种子发芽率和萌发抑制率。培养5 d 后,测量小麦根长和苗高,计算根长和苗高抑制率。培养期间,喷洒蒸馏水保持滤纸湿润。
发芽势=培养0~24 h 种子的萌发数量/100×100%
萌发抑制率=(1-处理组种子萌发数量/对照组种子萌发数量)×100%
根长抑制率=(处理组根长-对照组根长)/对照组根长×100%
苗高抑制率=(处理组苗高-对照组苗高)/对照组根长苗高×100%
1.3 数据处理与分析
采用Excel 软件对试验数据进行统计分析和方差分析等。
2 结果与分析
2.1 射干种子的形态特征
观察发现,射干种子呈卵圆形,直径0.35~0.60 cm,表面黑色、有光泽;种皮墨绿色或黑色,质地较柔软,放大镜下观察有细网纹;胚乳白色,质地坚硬,均匀分布于胚外侧,占据种子大部分空间。
2.2 射干种子的吸水性特征
随着浸泡时间的延长,射干种子的净吸水量增加呈先快后慢的趋势变化(图1)。其中,浸泡6 h 内指标值呈直线上升趋势,净吸水量约占种子总吸水量的36.59%;浸泡6~36 h,种子仍保持较快的吸水速率;浸泡36~60 h,种子净吸水量增加缓慢;浸泡60 h 后,种子净吸水量几乎不再增加,种子吸水基本达到饱和。射干种子吸水过程所表现的3 个阶段符合其他种子的吸水规律,说明射干种皮具备通畅吸水透水的能力,并不存在严重的透水障碍。因此推测,种皮的透水性不是导致射干种子休眠的主要原因。

图1 射干种子的吸水曲线Fig.1 Water sorption curve of B. chinensis
2.3 射干种皮对种子萌发的影响
射干去皮种子的发芽数量(图2)、发芽率和发芽势(表1)均显著>带皮种子,其中发芽率为带皮种子的1.71 倍,且萌发的幼苗比较强壮。表明射干种皮对种子萌发具有明显的抑制作用,去皮可以明显促进射干种子萌发。
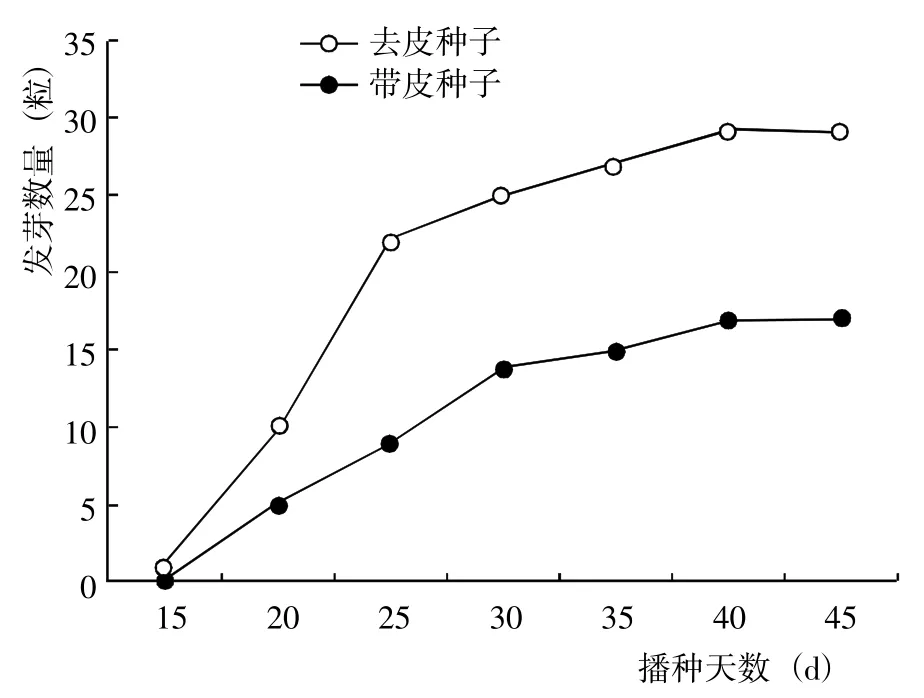
图2 射干去皮和带皮种子的发芽数量Fig.2 Germination quantity of B. chinensis seeds without and with seed coats

表1 射干种子的发芽率和发芽势Table 1 Germination rate and germination potential of B. chinensis seeds (%)
2.4 射干种子不同部位浸提液对小麦种子萌发和幼苗生长的影响
2.4.1 对小麦种子萌发的影响 射干种子不同部位浸提液处理的小麦种子萌发率均<CK,其中种皮浸提液处理影响较大,而胚乳浸提液处理的指标值与CK 差异始终不显著(图3)。表明射干种子不同部位浸提液均对小麦种子萌发具有一定的抑制作用,其中射干种皮浸提液的抑制作用明显,且抑制效果也明显高于胚乳浸提液。

图3 射干种子不同部位浸提液对小麦种子萌发的影响Fig.3 Effects of difference extract from B. chinensis on the germination of wheat seeds
射干种皮浸提液处理的小麦种子培养14~38 h,萌发数明显较少,发芽率显著<CK;培养38~56 h,种子陆续萌发,发芽率与CK 差异逐渐减小;培养72 h后,种子发芽率均≥97.67%,不同浓度处理之间及其与CK 之间差异均不显著。射干种皮浸提液处理会明显推迟小麦种子萌发,且推迟作用随着种皮浸提液浓度的增大而增强,0.03、0.04、0.06 g/mL 种皮浸提液处理的小麦种子发芽势分别为57.33%、53.33%和39.00%,指标值与0.06 g/mL 胚乳浸提液处理(86.00%)和CK(90.00%)相比明显降低。表明射干种皮浸取液可显著抑制和延缓小麦种子萌发,且这种抑制作用随着浸提液浓度的增大而增强。
2.4.2 对小麦种子幼苗生长的影响 射干种子不同部位浸提液处理的小麦根长和苗高均<CK,其中种皮浸提液处理的指标值与CK 差异均达到了显著水平,而胚乳浸提液处理与CK 差异均不显著;不同部位浸提液处理的小麦根长和苗高均差异较大,其中种皮浸提液对幼苗根长和苗高的抑制作用明显高于胚乳浸提液(表2)。种皮浸提液处理下,其抑制作用随着浸提液浓度的降低而降低,其中0.06 与0.04 g/mL 浓度处理的小麦根长和苗高无显著差异,但二者均显著<0.03 g/mL 浓度处理。表明射干种子不同部位浸提液均对小麦种子幼苗生长具有一定的抑制作用,其中射干种皮浸提液抑制作用明显,且抑制效果也明显高于胚乳浸提液。由此推断,射干种子的内源抑制物主要存在于种皮。
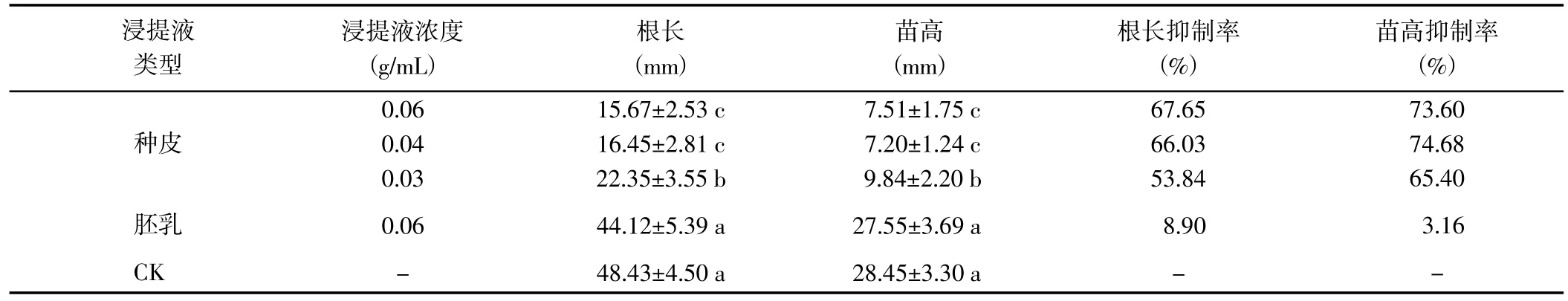
表2 射干种子不同部位浸提液对小麦幼苗生长的抑制效果Table 2 Inhibition effects of different extracts from B. chinensis on the growth of wheat seedlings
射干种子不同部位浸提液处理对小麦根长与苗高的影响效果不同,其中种皮浸提液对小麦株高生长的抑制作用更强。
3 结论与讨论
自然界中多数植物存在种子休眠现象,即具有生活力的种子即使在适宜的环境条件下仍不能萌发的现象[7~10]。研究表明,部分植物种子的休眠主要受种皮透气性、透水性等结构因素的影响,种皮致密使胚与外界水、气交换受到严重影响,从而导致种子萌发受到抑制[11];还有部分种子的休眠现象是由于种子内部存在内源抑制物质而影响储存有机物质的生理代谢活动,导致种子无法正常萌发[12]。贾和田[13]研究发现,用机械手段去掉射干种子的种皮后可以提高种子萌发率,说明种皮对射干种子萌发具有一定的抑制作用。本研究观察发现,射干种子浸泡36 h 内吸水较快;浸泡36~72 h,种子吸水量明显减少;浸泡72 h 后,吸水量几乎不再增加,种子吸水基本达到饱和。射干种子的吸水过程基本符合一般种子的吸水规律,种皮产生的机械阻碍对水分流通影响不大,由此推测,射干种子的休眠现象不是由于种皮机械阻碍造成的。
前人研究证明,植物种子中存在内源抑制物质是导致种子休眠的主要原因之一[14],且自然界大多数植物种子中含有萌发抑制物[15]。赵燕[5]研究发现,滇重楼种子的胚乳内存在大量易溶于甲醇的萌发抑制物;陆秀君等[16]研究发现,天女木兰种子的抑制物质主要存在于假种皮和胚乳中;贾彩霞[17]研究发现,核桃种子各部分均存在内源萌发抑制物。可见,种子萌发抑制物质分布较为广泛,存在于种子的各个部位,但不同部位中的抑制物含量与种类也有所差别。本研究中,在花盆中播种去皮和带皮的射干种子,观察其萌发情况,发现射干去皮种子的发芽率和发芽势均显著好于带皮种子,且较带皮种子萌发的幼苗更加健壮、长势更好,由此可基本断定射干种皮内存在内源萌发抑制物。以蒸馏水处理为CK 进一步比较了射干种皮浸提液与胚乳浸提液对小麦种子萌发和幼苗生长的抑制效果,发现射干胚乳浸提液对小麦种子萌发和幼苗生长影响不大;射干种皮浸提液对小麦种子萌发和幼苗生长均具有显著的抑制作用,且这种抑制作用也明显高于胚乳浸提液。射干种子休眠主要与其内源种子萌发抑制物有关,且该抑制物质集中存在于种皮。
自然界中,种子萌发抑制物的种类有很多[18],其种类不同,作用机理和对幼苗的影响方式也有所差别[19]。如,多花黄精种子内的萌发抑制物主要影响幼苗根部生长和叶绿素合成[4];黄连种子内存在脱落酸、香豆素等物质,主要影响幼苗伸长[20]。本研究结果表明,射干种皮浸提液对小麦生长具有显著的抑制作用,其中对苗高的抑制作用强于对根长的抑制作用。
综上所述,射干种子休眠现象是由种皮中的内源萌发抑制物所致,而非致密种皮不透水导致的机械阻碍,种子萌发抑制物对小麦幼苗的影响主要体现在抑制苗高和根长2 个方面。射干种皮内源抑制物的成分及其抑制机理有待进一步研究。

