轻烧粉酸溶法制备氢氧化镁及热分解机理研究
黄娜娜,李会杰,仇 龙,于亚杰,王禹博,王东意,李 雪,2,刘云义,2
(1.沈阳化工大学 辽宁省化工应用重点实验室, 辽宁 沈阳 110142;2.辽宁精细化工协同创新中心, 辽宁 沈阳 110142)
我国菱镁矿资源丰富[1],但菱镁矿资源利用率不高,导致资源浪费严重.氢氧化镁是一种重要的无机材料,具有广泛的应用前景[2-3].目前关于制备氢氧化镁的工艺研究较多[4-5],但是产品附加值低、经济效益不高.因此,提高资源利用率和产品附加值成为当前亟待解决的问题.由于煅烧温度决定氧化镁的活性及应用领域,因此,需要对氢氧化镁的热分解机理[6-7]及热分解动力学[8-9]做进一步研究.为提高轻烧粉的利用率,制备高产量高质量的氢氧化镁产品,本研究以廉价的轻烧粉为原料,研究酸溶反应条件对Mg2+浸出率的影响.以酸溶MgCl2溶液为沉镁母液,氨气为沉淀剂,制备高产量高质量的氢氧化镁产品,并对产品的热分解动力学和热分解机理进行分析.
1 实验部分
1.1 原料
实验原料轻烧粉的主要成分见表1.
1.2 轻烧粉活性测定
测定轻烧粉中氧化镁活性的方法很多,比较常用的有比表面积法、柠檬酸时间法和水合法等.
比表面积法:用分析天平称一定质量的轻烧粉,通常以吸附氮气的方法测量,根据比表面积吸附理论求出每克轻烧粉所具有的总比表面积,用比表面积的大小表示轻烧粉吸附能力的大小.
柠檬酸时间法:在40 ℃恒温水浴中,控制搅拌速度恒定,将1.70 g轻烧粉加入到200 mL含有酚酞指示剂的 0.07 mol/L的柠檬酸溶液中,秒表记录从轻烧粉开始加入到溶液呈现红色的时间,以表示轻烧粉中氧化镁的活性.
1.3 酸溶过程
1.4 沉镁过程
2 实验结果与讨论
2.1 轻烧粉活性测试结果
通过比表面积法、柠檬酸时间法和水合法测定轻烧粉活性,结果如表2所示.由表2可知:轻烧粉的比表面积较小;用柠檬酸时间法测得的时间较长;水合法测得的活性氧化镁含量较低.这是因为在以柠檬酸时间法及水合法测定轻烧粉活性的过程中,氧化镁与柠檬酸及水合法中去离子水的接触面积小,反应速率慢.
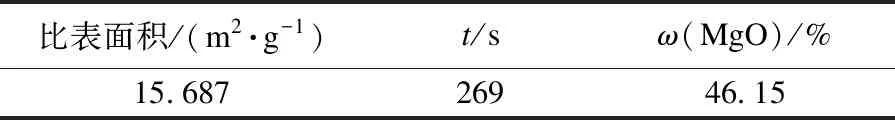
表2 轻烧粉活性测试结果Table 2 Activity test results of light burned powder
2.2 酸溶条件对Mg2+浸出率的影响
2.2.1 酸矿比对Mg2+浸出率的影响
以菱镁矿轻烧粉和稀盐酸为原料,制备氯化镁溶液.图1为酸矿比对Mg2+浸出率的影响曲线.由图1可知Mg2+的浸出率随着酸矿比的增加而逐渐增加.这是由于酸矿比增大,酸的用量增加,酸与矿粉反应更充分,浸出率增加.当酸矿比为1.9∶1时,Mg2+浸出率达到84.2%;当酸矿比为2∶1时,Mg2+浸出率达到87.2%.虽然Mg2+浸出率有所升高,但是酸矿比为2∶1时,氯化镁溶液呈酸性,且溶液中杂质离子的含量增加.因此,综合考虑酸矿比为1.9∶1时,既可以使Mg2+浸出率处于较高水平,又可以减少盐酸的用量,提高原料的利用率.
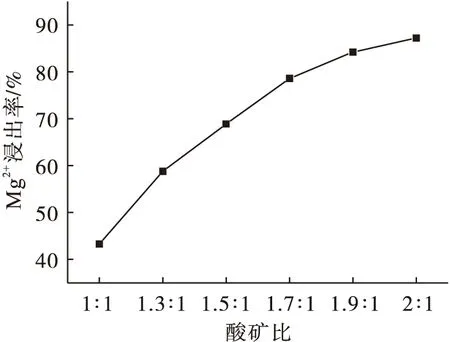
图1 酸矿比对Mg2+浸出率的影响Fig.1 Effect of acid ore ratio on Mg2+ leaching rate
2.2.2 酸溶时间对Mg2+浸出率的影响
从图2酸溶时间与Mg2+浸出率的关系曲线可以看出:延长酸溶时间,Mg2+浸出率随之升高.在1.0~2.0 h时,Mg2+浸出率增加速度较快;当时间超过2.0 h后,Mg2+浸出率几乎不再变化.适当延长酸溶时间能够使轻烧粉与盐酸反应更充分,有利于Mg2+浸出;但酸溶时间过长,轻烧粉中氧化镁发生水化反应,生成氢氧化镁,反而不利于Mg2+的浸出.

图2 酸溶时间对Mg2+浸出率的影响Fig.2 Effect of acid dissolution time on Mg2+ leaching rate
2.2.3 盐酸浓度对Mg2+浸出率的影响
图3为盐酸浓度与Mg2+浸出率的关系曲线.由图3可知:Mg2+浸出率随着盐酸浓度的增加而降低.这是因为盐酸具有挥发性,浓度越高,挥发性越强,与轻烧粉反应的盐酸相应减少;另一方面盐酸与轻烧粉反应时会释放热量,盐酸浓度越高,释放的热量越多,进一步促进了盐酸的挥发,从而使Mg2+浸出率降低.因此,盐酸浓度为2.0 mol/L时,轻烧粉的利用率最高,达到89.4%.
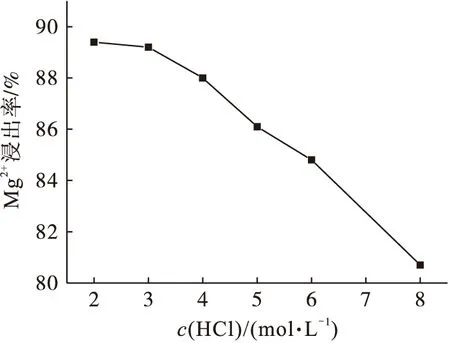
图3 盐酸浓度对Mg2+浸出率的影响Fig.3 Effect of hydrochloric acid concentration on Mg2+ leaching rate
2.3 沉镁过程反应条件对Mg2+转化率的影响
2.3.1 反应温度与Mg2+转化率的关系
以1.0 mol/L酸溶氯化镁精制液为原料,NH3为沉淀剂,进行沉镁反应,考察反应温度对Mg2+转化率的影响,图4为反应温度与Mg2+转化率的关系曲线.由图4可知:随着反应温度的升高,Mg2+转化率先增加后减小.在一定范围内升高温度可促进分子运动,增加分子碰撞机会,有利于氢氧化镁的生成,Mg2+转化率增大;当温度超过80 ℃时,NH3在溶液中的溶解度降低,Mg2+转化率减小,不利于氢氧化镁生成.
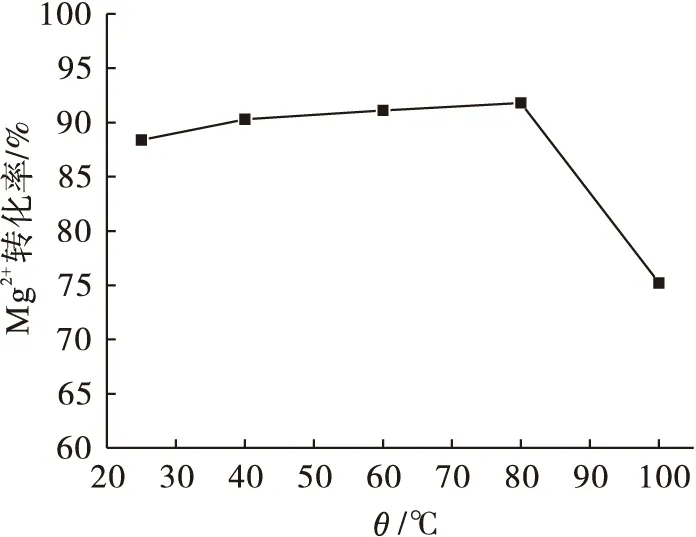
图4 反应温度与Mg2+转化率的关系Fig.4 Relationship between reaction temperature and Mg2+ conversion rate
2.3.2 氯化镁初始浓度与Mg2+转化率的关系
氯化镁初始浓度与Mg2+转化率的关系如图5所示.

图5 氯化镁浓度与Mg2+转化率的关系Fig.5 Relationship between magnesium chloride concentration and Mg2+ conversion rate
由图5可知:随着氯化镁初始浓度的增加,Mg2+转化率逐渐增大.因为氯化镁初始浓度越大,溶液过饱和度越大,Mg2+越多,与OH-接触的机会就越多,氢氧化镁的产率越高.当Mg2+浓度超过 1.0 mol/L时, Mg2+转化率仅有较小幅度的提高.这是因为当Mg2+初始浓度为1.0 mol/L时,OH-几乎完全被Mg2+消耗,即使再增加Mg2+的浓度,与OH-发生反应的机会也不多,所以Mg2+的转化率提高不多.
2.3.3 氨镁比与Mg2+转化率的关系
图6为氨镁比与Mg2+转化率的关系曲线.由图6可知:随着氨镁比的增加,Mg2+的转化率呈现递增的趋势,先快速增长,而后趋于平缓.实验结果表明:适当增加NH3用量,有利于提高Mg2+转化率,即有利于Mg(OH)2晶体生成.当氨镁比为4∶1时,Mg2+转化率为91.8%;氨镁比超过4∶1时,Mg2+转化率几乎不再变化.
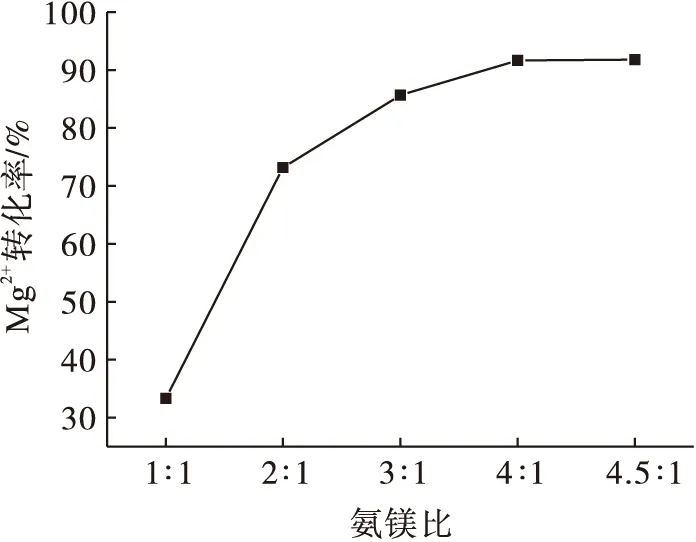
图6 氨镁比与Mg2+转化率的关系Fig.6 Relationship between ammonia-magnesium ratio and Mg2+ conversion rate
2.4 氢氧化镁SEM图及XRD分析
1.0 mol/L的酸溶氯化镁溶液在80 ℃、氨镁比4∶1的条件下制备得到氢氧化镁,使用高低真空扫描电镜(日本电子JSM-6360LV)和X射线衍射仪(德国布鲁克D8)对其进行表征,结果如图7所示.


图7 氢氧化镁SEM和XRD图Fig.7 SEM images and XRD patterns of Mg(OH)2
从图7(a)中可以看出氢氧化镁产品为片状;由图7(b)可知:氢氧化镁XRD图谱与标准图谱基本一致,且特征衍射峰强度高,峰形尖锐,表明产品的主物相为氢氧化镁.XRD图谱中除了氢氧化镁特征峰外没有杂峰,说明产品纯度较高.通过化学分析法测出产品纯度为98.5%.
2.5 氢氧化镁热分解过程的分析
用综合热分析仪(德国耐驰公司STA449C)在N2气氛下对氢氧化镁产品进行表征,设置升温速率分别为5、10、15、20、30 ℃/min,从40 ℃加热到1000 ℃.氢氧化镁的TG曲线和DTG曲线见图8.
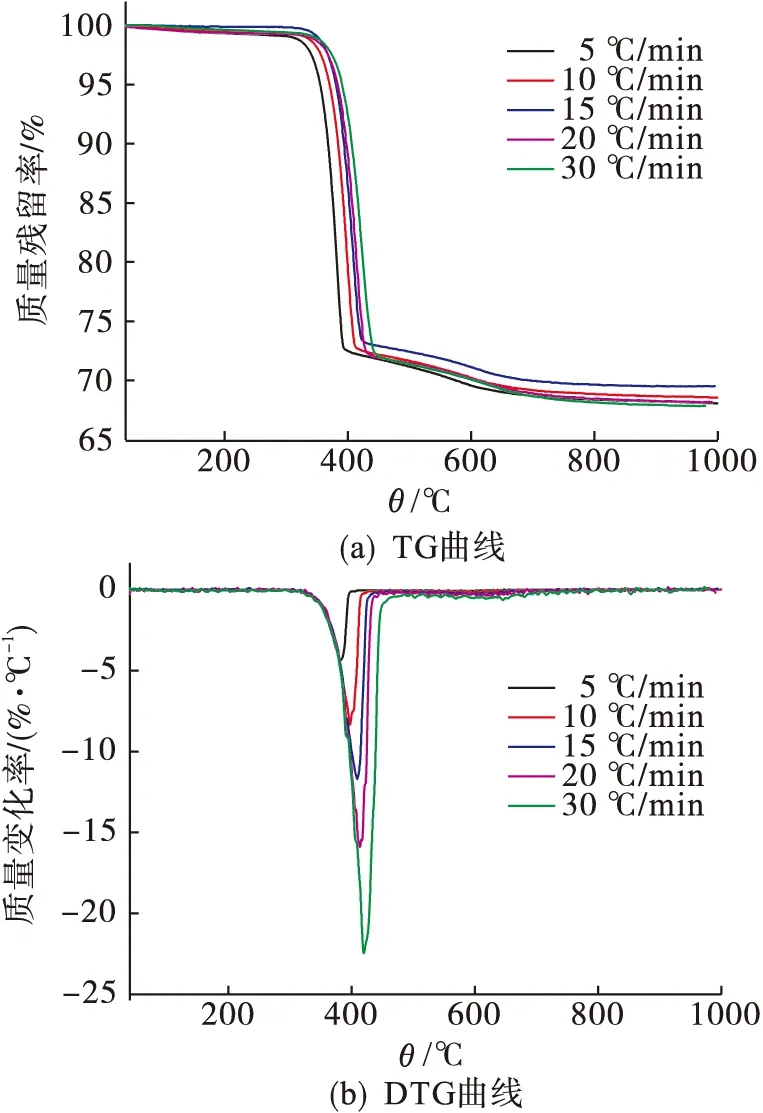
图8 氢氧化镁TG-DTG曲线Fig.8 TG-DTG curves of Mg(OH)2
由图8可知:TG曲线只出现一个失重平台,温度在350~430 ℃之间;DTG曲线出现一个峰,且对应的温度随升温速率的增加向高温移动,说明氢氧化镁的分解一步完成,热分解过程为
Mg(OH)2→MgO+H2O↑.
2.5.1 热分解活化能的计算

图9 不同升温速率下的lnβ~1/T图Fig.9 lnβ ~ 1/T diagrams at different heating rates
由Doyle方程可以推出:直线的斜率为-1.052E/R,其中R=8.314 J·mol-1·K-1.计算出热分解的活化能:E(25%)=159.57 kJ·mol-1(a=25%,lnβ=-20 190.748/T+33.41,r2=0.99);E(50%)=155.53 kJ·mol-1(a=50%,lnβ=-19 680.129/T+31.99,r2=0.99);E(75%)=150.52 kJ·mol-1(a=75%,lnβ=-19 045.826/T+30.62,r2=0.99);平均活化能E1=155.21 kJ·mol-1.
由Kissinger方程可以推出:直线的斜率为-E/R,其中R=8.314 J·mol-1·K-1.计算出热分解的活化能:E(25%)=157.09 kJ·mol-1[a=25%,ln(β/T2)=-18 886.700 6/T+18.45,r2=0.99];E(50%)=152.54 kJ·mol-1[a=50%,ln(β/T2)=-18 347.196 1/T+16.98,r2=0.99];E(75%)=147.10 kJ·mol-1[a=75%,ln(β/T2)=-17 932.171 6/T+15.95,r2=0.99]; 平均活化能E2=152.24 kJ·mol-1.
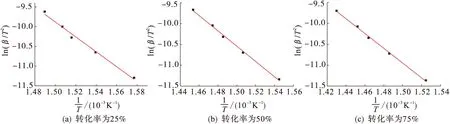
图10 不同升温速率下的ln(β/T2)~1/T图Fig.10 ln(β/T2)~1/T diagrams at different heating rates
两种方法的计算结果基本吻合,因此我们可以得出氢氧化镁的热分解平均活化能为E=153.73 kJ·mol-1.
2.5.2 氢氧化镁热分解反应机理
固体热分解过程所涉及的机理有很多[10-12],如何选择一个合适的机理函数是十分困难的.氢氧化镁热分解符合随机成核之后再生长的机理.本研究选用5种不同的随机成核之后再生长的反应机理方程[10],如表3所示.采用Coats-Redfern方程和Dolye方程来判断机理函数,结果如表4所示.
在2.5.1中通过Doyle方程和Kissinger方程分别计算出氢氧化镁的热分解平均活化能为155.21 kJ·mol-1、152.24 kJ·mol-1,因此,通过对表4进行分析可以判断氢氧化镁热分解的机理函数,其随机成核后生长的机理函数是:G(a)=[-ln(1-a)]2/3;g(a)=3/2(1-a)·[-ln(1-a)]1/3.

表3 5种常见的固体热分解反应机理函数Table 3 Mechanism functions of 5 common solid decomposition reactions
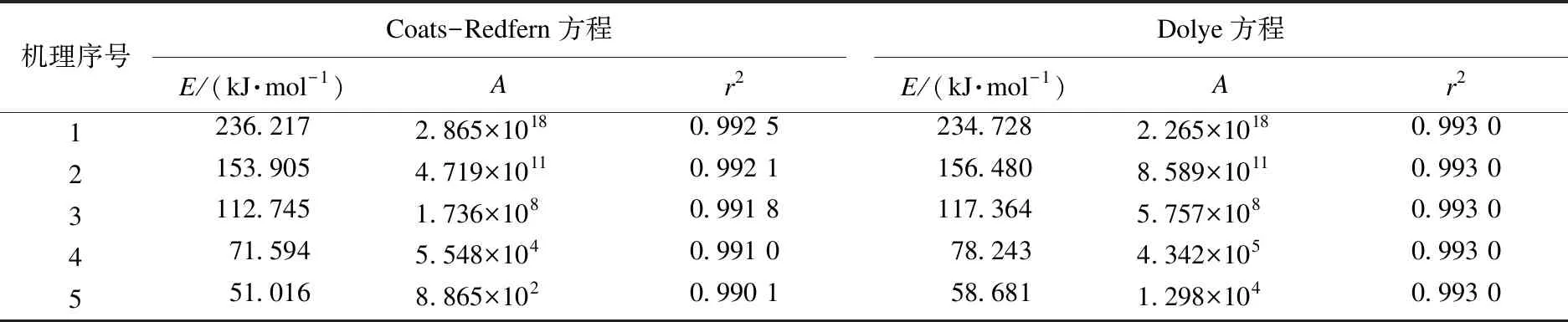
表4 Coats-Redfern方程和Dolye方程拟合结果Table 4 Fitting results of Coats-Redfern equation and Dolye equation
3 结 论
酸溶反应过程中,Mg2+浸出率随着酸矿比的增加、酸溶时间的延长而升高,随着盐酸浓度的增加而降低.确定最佳反应条件:酸矿比1.9∶1、酸溶2 h、盐酸浓度2.0 mol/L,Mg2+浸出率达到89.4%,轻烧粉利用率较高.沉镁过程中,Mg2+转化率随反应温度的升高、氯化镁溶液浓度的增加和氨镁比的增加而升高.最佳工艺条件:反应温度80 ℃、氯化镁溶液浓度1.0 mol/L、氨镁比4∶1时,Mg2+转化率达到91.8%.此工艺条件下,氢氧化镁产品纯度高、产量高.通过对氢氧化镁的TG-DTG分析,得知氢氧化镁的分解是一步完成的.采用Doyle法和Kissinger法分别计算出氢氧化镁热分解活化能为155.21 kJ·mol-1、152.24 kJ·mol-1,平均热分解活化能为153.73 kJ·mol-1,其随机成核后生长的机理函数是:G(a)=[-ln(1-a)]2/3;g(a)=3/2(1-a)[-ln(1-a)]1/3.

