藏猪和大约克猪ACADM基因表达量与脂肪沉积性状的相关性分析
唐可人,李盼,段梦琪,张健,张芳芳,王珍梅,董世雄,强巴央宗,商鹏*
(1. 西藏农牧学院动物科学学院,西藏 林芝 860000;2. 黑龙江省大庆市杜尔伯特蒙古族自治县一心乡畜牧水产中心,黑龙江 大庆 163000)
脂肪不仅作为动物机体重要的能量来源之一,同时在畜禽肉产品中与瘦肉率和肉品质具有密切联系。通常情况下,动物脂肪合成和代谢是脂肪沉积的一种平衡状态,脂肪沉积的增加或减少会影响肉品质[1]。因此,猪脂肪沉积能力已成为影响猪肉品质最关键因素[2]。动物机体脂肪沉积与代谢受多基因调控,目前已经报道的与脂肪沉积和代谢的基因主要包括脂肪细胞决定和分化因子1(ADD1)、脂肪和肥胖相关基因(FTO)、脂肪酸合成相关酶、脂肪酸分解相关酶等[3]。本研究团队前期对藏猪和大约克猪肌肉组织进行了转录组学(RNA-seq测序技术)和蛋白质组学(isobaric tags for relative and absolute quantifi-cation, iTRAQ蛋白质谱技术)的联合分析,确定了中链酰基辅酶A脱氢酶(acyl-CoA dehydrogenase,ACADM)为脂肪沉积性状关键差异表达基因[4]。
ACADM是4个酰基辅酶A脱氢酶(ACAD)之一,由9种已知蛋白质组成,主要参与催化中链脂肪酸的β-氧化[5]。ACADM基因位于SSC6上的QTL区间,因此它可能是一个与肥胖和生长性状相关的重要候选基因[6],该基因的缺乏会引起机体分解中链脂肪酸能力下降和肝功能异常,甚至会导致动物死亡[7]。Mitsuyoshi等[8]通过对从74例非酒精性脂肪性肝病活检标本的ACADM基因转录水平定量分析,发现患者的表达水平显著高于对照组,且随病情发展显著降低,这与该基因的脂肪变性和脂肪沉积有关。因此,本试验以脂肪型猪种(藏猪)和瘦肉型猪种(大约克猪)为研究对象,对ACADM基因起始密码子上游1 kb区域进行了多态性分析;并采用RT-qPCR技术检测ACADM基因在肝脏、背脂、背最长肌和心脏组织中的表达差异,联合其背膘厚和背最长肌组织中肌内脂肪含量进行相关性分析,旨在初步探究ACADM基因对猪脂肪沉积性状的影响,以期为开发脂肪沉积性状有效遗传标记及育种工作提供一定的思路和参考依据。
1 材料与方法
1.1 试验材料
试验以藏猪和大约克猪为研究对象,藏猪来源于西藏农牧学院教学实习牧场,大约克猪来源于林芝市银丰农牧科技有限公司养殖场。共采集118份藏猪和大约克猪耳组织(藏猪58头,大约克猪60头),置于75%酒精中,-20 ℃冰箱保存,用于DNA提取。随机挑选180日龄藏猪和大约克猪各10头,无亲缘关系,相同的日粮水平,自由采食的模式饲养。屠宰后,按照文献[9]三点法测定背膘厚;采集肝脏、背脂、心脏和背最长肌组织,液氮速冻,-80 ℃保存,用于RNA提取。
1.2 DNA、RNA提取及cDNA制备
采用苯酚-氯仿法从耳组织中提取总DNA,将其溶解在RNase-Free ddH2O中,-20 ℃保存备用。利用RNA提取试剂盒(北京天根生化科技有限公司,DP171221)提取总RNA;采用一步法cDNA反转录试剂盒(北京天根生化科技有限公司,KR180123)对总RNA进行反转录,将所得合格的cDNA保存于-20 ℃备用。
1.3 单核苷酸多态性(SNPs)筛选与基因分型引物设计
下载GenBank中猪ACADM(登录号NC_010448.4)基因起始密码子上游1 kb区域DNA序列,利用Primer Premier 5.0软件设计引物(表1),由上海生工生物工程有限公司合成,TE缓冲液溶解,4 ℃保存。

表1 ACADM基因5′侧翼区引物信息
1.4 RT-qPCR引物设计
下载GenBank中猪的ACADM(登录号XM_003359209.1)mRNA序列,以RNF7(登录号NM_001245011.1)为内参基因[10],采用Primer Premier 5.0软件设计引物(表2),由上海生工生物工程有限公司合成,TE缓冲液溶解,4 ℃保存。

表2 ACADM基因和RNF7基因实时荧光定量引物信息
1.5 基因型频率与等位基因频率检测
采用Sanger测序法对ACADM基因起始密码子上游1 kb区域DNA序列进行混池测序检测,每个品种各10头,用Chromas Pro和DNAMAN 6.0软件进行序列比对分析,筛选SNPs位点后,扩大样本进行个体测序,测序工作由上海生工生物工程有限公司完成,统计基因型频率与等位基因频率。分别对ACADM基因2个突变位点进行转录因子预测,转录因子结合位点在http://jaspar.binf.ku.dk/网站上进行搜索。
1.6 RT-qPCR分析
以cDNA为模板,对ACADM和RNF7基因利用Eppendorf Mastercycler PCR仪进行扩增,每个样品点设置3个重复。20 μL反应体系,包括SYBR Green Mix(北京天根生化科技有限公司,FP171206)10 μL,上、下游引物(10 μmol /L)各1 μL,RNase-free water 7 μL,cDNA模板1 μL。荧光定量PCR扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火20 s,72 ℃延伸30 s,80 ℃检测荧光,共38个循环。样品mRNA的相对表达量使用2-ΔΔCt法[11]进行计算。
1.7 肌内脂肪含量测定
采用传统索氏抽提法测定肌内脂肪含量,参照文献[12],最后计算每个样品的肌内脂肪含量值。
1.8 统计与分析
利用SPSS 18.0软件分别对ACADM基因表达量进行双因素(品种和组织)分析以及背膘厚、ACADM基因背最长肌表达量与肌内脂肪含量的相关性(Pearson相关系数)分析,使用Pearson chi-square对ACADM基因的基因型频率和等位基因频率进行显著性检验,测定结果以“平均值±标准误”表示。
2 结果与分析
2.1 SNPs筛选
在ACADM基因起始密码子上游1 kb区域共发现2个多态性位点(图1a、图1b),分别在起始密码子上游101和569 bp位置发现C/G突变,记为C-101G(图1a)和C-569G(图1b)。
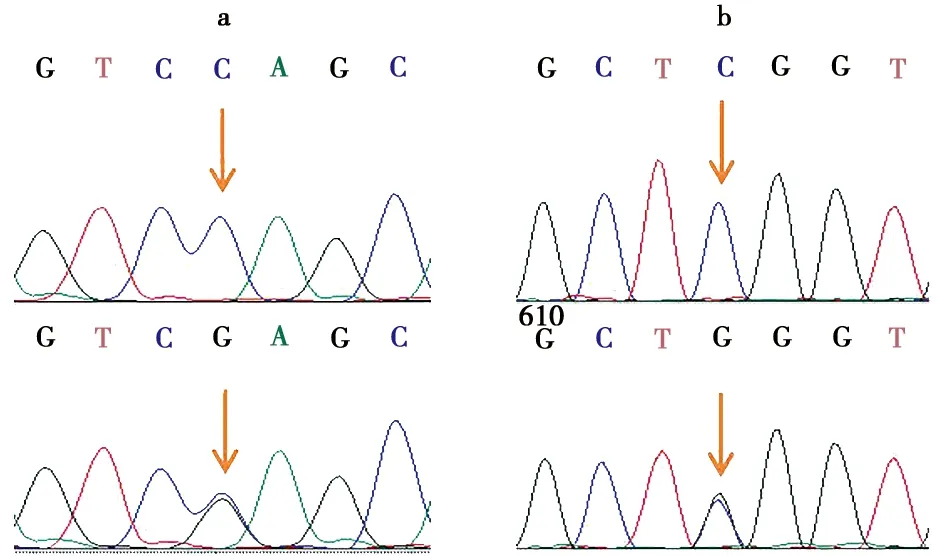
a.C-101G位点; b.C-569G位点
2.2 ACADM基因多态性位点基因型频率和等位基因频率分布分析
由表3可知,在品种内,C-101G和C-569G的基因型分布在藏猪和大约克猪中均符合Hardy-Weinberg平衡(P>0.05);在品种间,C-101G和C-569G位点的基因型频率呈极显著差异(P<0.01),藏猪群体中的优势基因型均为CC型,大约克猪群体中的优势基因型为GG型。
通过网站转录因子预测发现SNPs位点碱基突变前后部分转录因子结合位点消失和新转录因子产生,发现藏猪ACADM基因5′侧翼区2个SNPs位点C-101G突变后存在Tcf12、KLF5、KLF1、KLF4等转录因子结合位点;C-569G突变后存在CEBPA、CEBPB、Rxra等多个转录因子结合位点,这些位点大多参与动物机体生长发育,调控脂肪沉积和低氧诱导因子信号通路,这可能与ACADM基因的表达调控有关。
2.3 不同组织中ACADM mRNA定量分析比较
由图2可见,藏猪肝脏、背脂、背最长肌和心脏组织中ACADM mRNA水平均极显著高于大约克猪(P<0.01)。
2.4 藏猪、大约克猪屠宰胴体重与背膘厚检测比较
由表4可见,180日龄藏猪屠宰胴体重极显著低于大约克猪(P<0.01);藏猪的背膘厚极显著高于大约克猪(P<0.01)。
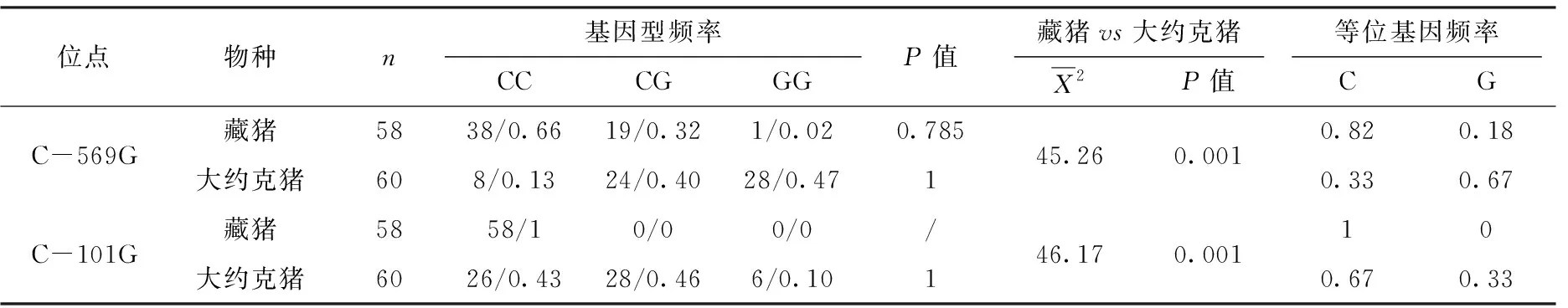
表3 藏猪、大约克猪ACADM基因多态性位点基因型频率和等位基因频率分析
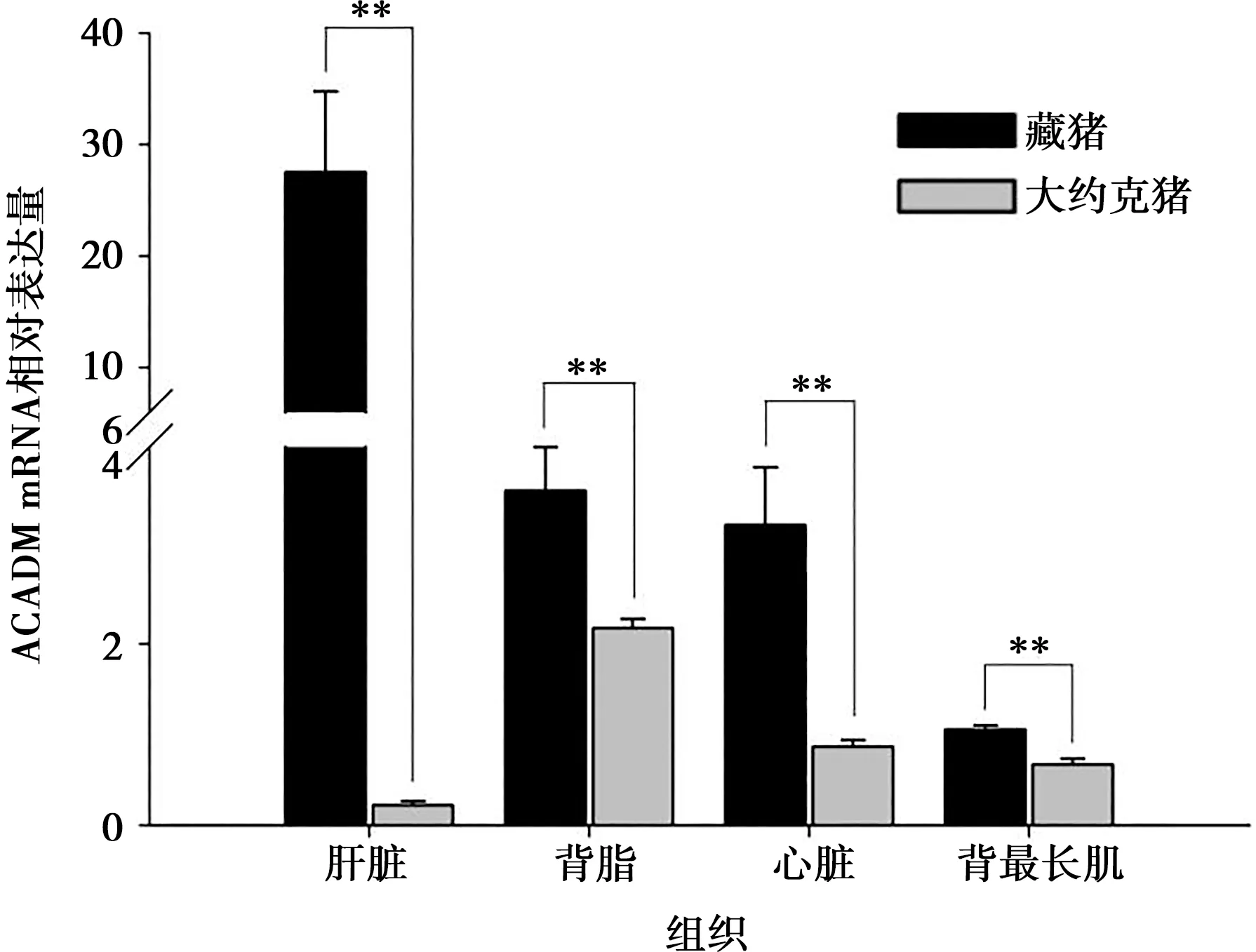
**表示P<0.01

表4 藏猪、大约克猪屠宰胴体重与背膘厚检测比较
2.5 藏猪、大约克猪肌内脂肪含量测定
由表5可见,180 日龄藏猪背最长肌肌内脂肪含量极显著高于大约克猪(P<0.01)。

表5 藏猪、大约克猪背最长肌肌内脂肪含量比较 %
2.6 背最长肌ACADM基因表达量与背膘厚、肌内脂肪含量相关性分析
ACADM基因在背最长肌中的mRNA相对表达量与背膘厚呈显著正相关(P<0.05),相关系数为0.92;与肌内脂肪含量呈显著正相关(P<0.05),相关系数为0.93。
3 讨论
ACADM 是中链脂肪酸(C4-C12直链)β-氧化的关键酶,在维持能量平衡中起着重要作用,通过将酰基辅酶A转化为乙酰辅酶A单元,以作为其他组织的能量来源[13]。现有研究发现,在藏猪与长白猪的背最长肌组织中,棕榈酸、棕榈油酸和花生酸具有显著的差异,同时饱和脂肪酸、单不饱和脂肪酸及多不饱和脂肪酸2个猪种也具有显著的差异,但是在中链脂肪酸上,现阶段并没有藏猪的相关报道[14-15]。有研究报道,ACADM基因在动物各个组织中均有表达,在肝脏、骨骼肌和心脏等组织中高表达[16],与本研究的结果基本一致。Ji等[17]通过检测延边黄牛和延黄牛ACADM基因在不同组织中的表达水平,发现其在牛的多个组织中均有表达,在肝脏中的表达水平显著高于其他组织,且在牛脂肪组织中表达水平显著高于背最长肌,与本试验中藏猪的结果趋于一致,而与大约克猪的表达模式在肝脏组织中略有差异。可能是由于大约克猪在人工高强度选育下,脂肪沉积能力明显下降[18]。藏猪是我国青藏高原特有的原始地方品种,至今还未开展系统的选育工作[19]。藏猪具有慢生长速度和高脂肪沉积能力的特点,大约克猪具有快生长速度和高瘦肉率的特性[20],两者具有明显的差异。通过对藏猪和大约克猪背膘厚和肌内脂肪含量测定发现,藏猪极显著高于大约克猪,完全符合其品种特性。Wang等[21]通过脂肪沉积相关蛋白互作网络图发现ACADM基因是导致藏猪高脂肪沉积能力的原因之一。本试验中,藏猪在肝脏、背脂、心脏和背最长肌组织中mRNA的表达水平均极显著高于大约克猪,说明ACADM基因的mRNA的表达量与脂肪沉积能力呈正相关,进一步证实了ACADM基因可能影响猪的脂肪沉积性状。
本试验在ACADM基因起始密码子上游1 kb区域发现了2个新的SNPs(C-101G和C-569G)位点,且在品种间C-101G和C-569G位点的基因型频率呈极显著差异。通过转录因子预测后发现在C-101G位点突变前后出现了新的转录因子KLF5编码的蛋白,该蛋白与机体的脂肪沉积有关,是脂肪细胞分化正转录调控的关键因子[22-23]。这可能是导致藏猪脂肪沉积能力强、肌内脂肪含量高的原因之一。在C-569G位点突变前后出现了新的CEBPA基因结合位点,该基因对动物脂肪细胞分化、发育和脂肪沉积有重要作用,是控制脂肪沉积和肌内脂肪生成的关键调节因子[24-25]。因此推测这2个SNPs位点可能是影响猪脂肪沉积能力的重要调控位点,但具体调控机制和功能尚需进一步研究,下一步将开展不同基因型个体和脂肪沉积性状的关联性分析。
4 结论
综上所述,本试验通过对藏猪和大约克猪ACADM基因起始密码子上游1 kb区域DNA序列的多态性和不同组织中ACADM基因mRNA表达量的检测,以及背膘厚和肌内脂肪含量测定分析,发现ACADM基因mRNA的表达量与背膘厚、肌内脂肪含量呈显著正相关,该基因可能是影响脂肪沉积性状及肉品质的重要候选基因,推测C-101G和C-569G这2个SNPs位点可能是影响猪脂肪沉积能力的重要调控位点,为进一步开展ACADM基因对猪脂肪沉积的调控机制研究提供了重要支撑。

