miR-1307在猪卵巢颗粒细胞周期中的作用
李建,姚望,杜星,潘增祥,李齐发
(南京农业大学动物科技学院,江苏 南京 210095)
微小RNAs(microRNAs,miRNAs)是一类长度20~22个核苷酸的非编码RNA分子(non-coding RNAs,ncRNAs)。研究发现,miRNAs主要通过转录后水平沉默靶基因表达,进而在各种组织和器官的多种细胞生理和病理过程中发挥至关重要的作用[1-2]。在哺乳动物卵巢组织中,miRNAs在卵母细胞、体细胞(如颗粒细胞)和卵泡液中广泛表达,并调控多种卵巢功能,从原始卵泡库的维持和起始,到排卵、黄体形成和卵巢老化[2-4]。在各种卵巢细胞中,卵巢颗粒细胞中miRNAs的研究最为深入,涉及各种颗粒细胞功能,如颗粒细胞增殖[5]、颗粒细胞凋亡[2]、颗粒细胞自噬[6]、类固醇激素分泌[7]和细胞周期等[8]。目前靶向卵巢颗粒细胞凋亡的miRNAs研究最多,如miR-26b[5]、miR-425[9]、miR-1306[10]和miR-204[11]等。基因内miR-126通过靶向抑制TGFB2基因,抑制卵巢颗粒细胞中TGF-β信号通路,进而促进颗粒细胞凋亡和卵泡闭锁,介导高繁殖力候选基因NORFA对猪繁殖性能的调控[2]。众所周知,芳香化酶P450arom是卵巢颗粒细胞中雌激素合成通路的限速酶,其编码基因CYP19A1被发现受多个miRNAs如miR-1275[5]、miR-10b[12]和miR-27a-3p[13]等的直接或间接调控,从而介导miRNAs对颗粒细胞雌激素分泌的调控。但目前关于靶向调控卵巢颗粒细胞周期的miRNAs研究较少[8,14]。本文以猪卵巢颗粒细胞为研究对象,利用流式细胞技术分析miR-1307在颗粒细胞周期中的作用,以期为解析哺乳动物细胞周期的miRNAs调控网络提供参考。
1 材料与方法
1.1 试验动物
试验用新鲜卵巢来自南京禄口机场屠宰场的成年杜长大商品母猪。用75%酒精消毒后的手术剪将刚屠宰的母猪输卵管末端的卵巢剪下,简单清洗后将卵巢浸泡在37 ℃的生理盐水中,尽快运送回实验室。
1.2 主要试剂
试验用主要试剂有:DMEM/F-12培养基、胎牛血清(FBS)、Opti-MEM培养基、青霉素/链霉素双抗(PS)(Gibco公司);磷酸盐缓冲液(PBS)(HyClone公司);胰蛋白酶-EDTA(0.05%)(Thermo公司)、Lipofectamine2000转染试剂(Invitrogen公司);细胞周期检测试剂盒(Vazyme 公司)。
1.3 试验仪器
试验所用仪器主要包括:二氧化碳培养箱(MCO-18AIC)(Panasonic公司)、离心机(TDZ4-WS)(长沙湘智公司)、超净工作台(苏净安泰公司)、流式细胞仪(Beckman Coulter公司)、光学显微镜(YSA100)(Nikon)和微量移液器(Thermo公司)等。
1.4试验方法
1.4.1 生物信息学分析
猪等哺乳动物miR-1307前体和成熟体序列下载自NCBI数据库(https://www.ncbi.nlm. nih.gov/)和miRBase数据库(http://www.mirbase.org/)。利用DNAMAN软件进行序列碱基组成和多重比对分析。利用在线软件RNA structure(http://rna.urmc.rochester.edu/RNA structureWeb/)预测miR-1307前体的二级结构。使用在线软件Targetscan(http://www.targetscan.org/)和miRWalk(http://mirwalk.umm.uni-heidelberg.de/)预测miR-1307的靶基因。利用在线软件DAVID(https://david-d.ncifcrf.gov/)进行GO分析和KEGG功能富集分析。
1.4.2 细胞培养
将采集的母猪卵巢放在37 ℃无菌生理盐水中,75%酒精和PBS清洗卵巢3~5次后,用10 mL注射器抽取直径为3~5 mm卵泡的卵泡液。1 000 r/min离心5 min,去除卵泡液;PBS清洗2遍颗粒细胞,1 000 r/min离心5 min后去除PBS;用DMEM/F-12培养基重悬混匀细胞。将细胞接种于T25培养瓶中,置于37 ℃、5% CO2细胞培养箱中培养;24 h后观察细胞贴壁情况,将未贴壁的细胞用移液枪吸弃;用PBS清洗细胞,更换新鲜培养基,待细胞长满培养瓶底部且状态良好时铺板。用5 mL PBS重复清洗细胞2遍,加入1 mL的胰酶孵育2 min以消化细胞,显微镜下观察到细胞状态,充分漂浮后立即加入等体积的培养基终止消化。1 000 r/min 离心5 min,去除胰酶和培养基混合液;加入DMEM/F-12培养基重悬混匀细胞,接种于12孔或6孔细胞培养板中,置于培养箱中培养。
1.4.3 小分子RNA合成
由上海吉玛公司设计合成猪miR-1307模拟物(mimics)、抑制剂(inhibitor)和相应的阴性对照(NC)等小分子RNA。详细序列见表1。

表1 小分子RNA序列
1.4.4 细胞转染
猪卵巢颗粒细胞在6孔板中进行培养。待每孔长到80%~90%时,利用Lipofectamine2000转染试剂将小分子RNA转染到细胞中。转染时的培养基是不含胎牛血清(FBS)的DMEM/F-12培养基,转染4 h后将培养基换成含有15% FBS和2% PS的DMEM/F-12培养基。详细的转染步骤参考文献[5]。
1.4.5 细胞周期分析
猪卵巢颗粒细胞转染36 h后弃掉培养基,用预热的PBS轻洗细胞,弃掉PBS,每孔细胞用1 mL预热的胰酶消化悬浮细胞,再用培养基终止消化。1 000 r/min离心5 min,吸弃液体;用500 μL预冷的PBS轻洗细胞2次,用细胞周期检测试剂盒中的RNase A溶液与碘化丙啶(PI)对细胞进行染色,利用细胞内DNA能够和PI结合的特性,通过流式细胞仪检测细胞各个时期的DNA含量。用Modifit软件(Verity Software House公司)对细胞周期结果进行分析。
1.4.6 统计与分析
利用SPSS v20.0(IBM公司)软件进行数据的统计分析,用t检验来评估统计学显著性。用GraphPad Prism 5软件 (GraphPad Software公司)制作柱形图。所有试验结果均以“平均值±标准误”表示。P<0.05表示差异显著。
2 结果与分析
2.1 猪miR-1307序列分析
猪miR-1307前体序列(cDNA)的长度为80 bp,其中碱基A、T、G和C的含量分别为16.25%、22.50%、30.00%和31.25%。序列分析发现猪miR-1307前体序列与人、牛、羊、黑猩猩和家犬等物种的一致性分别为53.02%、53.02%、53.2%、53.38%和75%(图1)。猪miR-1307成熟序列为5′-ACUCGGCGUGGCGUCGGUCGUG-3′,与人、牛、羊、黑猩猩和家犬等物种的一致性分别为100%、100%、95.65%、100%和100%。猪miR-1307种子序列(CUCGGCG)与哺乳动物其他物种完全一致,说明哺乳动物miR-1307序列高度保守。
染色体定位分析发现猪miR-1307定位于14号染色体,在基因组的114 325 624~114 325 703 nt之间,而人、牛、羊、黑猩猩和家犬等哺乳动物miR-1307则分别位于10、26、26、10和28号染色体上。进一步分析发现,哺乳动物miR-1307均位于编码基因ATP5MD的转录起始位点与第1外显子之间(图2),说明哺乳动物miR-1307基因定位也比较保守。
2.2 猪miR-1307 前体的二级结构分析
利用RNA structur在线软件对猪miR-1307前体的二级结构预测与分析,发现猪miR-1307前体序列的最小折叠自由能(minimum free energy,MFE)小于-20 kcal/mol,并且能够折叠形成典型的发夹结构。同时,结构预测发现miR-1307成熟序列位于发卡结构的臂上,符合miRNA的形成机制。
2.3 猪miR-1307功能预测
利用2种算法预测了miR-1307的靶基因,结果发现Targetscan预测的靶基因为1 693个,miRWalk预测的靶基因为6 924个,2种算法预测到的公共靶基因为567个共同的靶基因。利用DAVID软件对miR-1307的靶基因进行功能富集分析。GO分析结果显示,在生物学进程中,miR-1307的靶基因主要富集在rRNA分解代谢进程、炎症反应和白细胞趋化性等通路中;在细胞组成上,miR-1307的靶基因主要与内质网、基底膜以及溶酶体的组成有关;在分子功能方面,miR-1307的靶基因主要参与蛋白酪氨酸磷酸酶活性、转录因子活性和外核糖核酸酶活性等过程(图3)。KEGG通路分析显示,miR-1307靶基因与催产素信号通路显著相关(P<0.05),虽然也富集到关于RNA降解和趋化因子信号途径,但是相关性不显著(图4)。
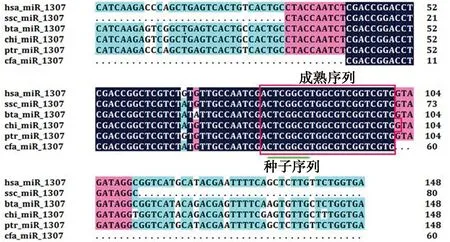
has. 人;ssc. 猪;bta. 牛;chi. 羊;ptr. 猩猩;cfa. 家犬。下同

图2 哺乳动物miR-1307染色体定位
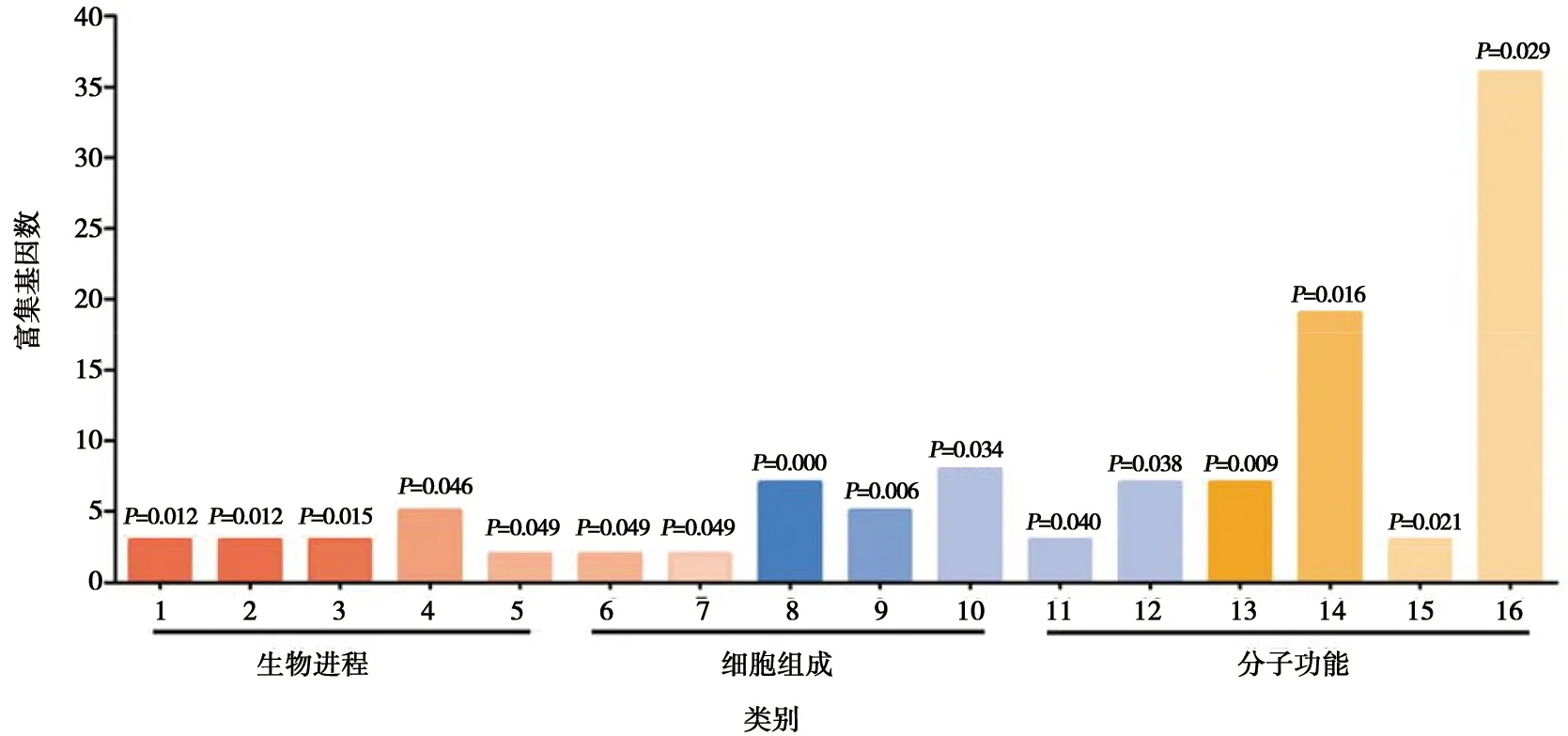
1.rRNA分解代谢进程;2. 抗原刺激的炎症反应;3. 白细胞趋化反应;4. 药物反应;5. 干细胞生长因子受体信号;6. 4型过敏反应;7. 树突状细胞分化;8. 内质网;9. 基底膜;10. 溶酶体;11. 核外泌体;12. 核膜;13. 蛋白酪氨酸磷酸酶活性;14. 转录因子活性;15. 核糖核酸外切酶活性;16. ATP结合
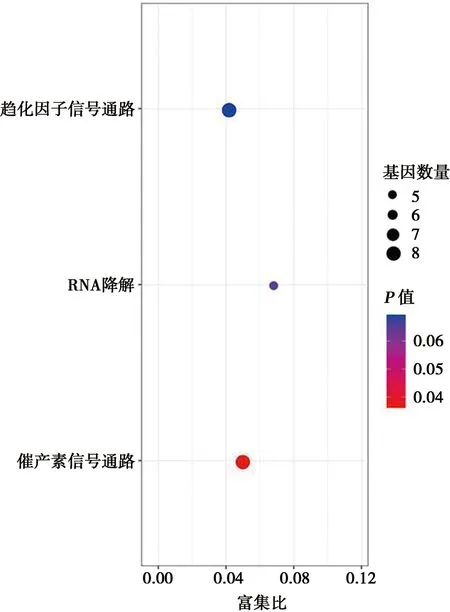
图4 miR-1307靶基因KEGG通路分析结果
2.4 过表达miR-1307对猪卵巢颗粒细胞周期的影响
为了分析miR-1307在卵巢颗粒细胞中的功能,将miR-1307 mimics转染到体外培养的猪卵巢颗粒细胞中,利用FACS技术检测颗粒细胞周期情况,结果如图5。miR-1307过表达后猪卵巢颗粒细胞中G0/G1期细胞比例增加,而S期细胞比例显著降低(P<0.05),说明miR-1307过表达可抑制细胞S期DNA合成过程,导致猪卵巢颗粒细胞的G0/G1期阻滞。
2.5 抑制miR-1307对猪卵巢颗粒细胞周期的影响
为了进一步研究miR-1307在猪卵巢颗粒细胞周期中的作用,将miR-1307 inhibitor转染到猪卵巢颗粒细胞中抑制miR-1307的表达,利用FACS技术检测颗粒细胞周期情况,结果如图6。抑制miR-1307后猪卵巢颗粒细胞中G0/G1期细胞比例减少(但未达显著水平),而S期细胞比例显著增加(P<0.05),说明抑制miR-1307可促进S期细胞DNA合成,预示猪卵巢颗粒细胞增殖水平增加。

A.对照组流式图;B. miR-1307过表达组流式图;C. 流式结果量化图。*表示P<0.05。下同

A.对照组流式图;B. miR-1307抑制组流式图;C.流式结果量化图
3 讨论
众所周知,miRNA是一类高度保守的内源性非编码RNA[15]。本文通过miRNA序列分析发现, miR-1307的序列(特别是成熟序列和种子序列)和基因组定位在哺乳动物中均高度保守。这与前人对其他miRNAs的研究是一致的[2,5]。Du等[2]研究发现脊椎动物miR-126基因前体序列高度保守,成熟序列(UCGUACCGUGAGUAAUAAUGCG)和种子序列(CGUACCG)完全一致,且都定位于表皮生长因子样结构域蛋白7(EGF like domain multiple 7,EGFL7)基因内含子区。Liu等[5]研究发现哺乳动物miR-26b基因前体序列高度一致(猪与小鼠、大鼠序列一致性为96.51%),成熟序列(UUCAAGUAAUUCAGGAUAGGU)和种子序列(UCAAGUA)则完全一致,且都定位于编码基因。另外,本文利用生物信息学软件预测结合前人研究发现miR-1307的潜在靶基因参与调控多个生物学过程,如ISM1(isthmin 1)基因、DAB2互作蛋白(DAB2 interacting protein,DAB2IP)基因和B淋巴细胞瘤-2(B-cell lymphoma-2,BCL2)基因等。在结肠癌细胞中,ISM1已被证实是miR-1307的功能靶基因,miR-1307可靶向调控ISM1基因进而影响凋亡相关基因如Caspase3、周期相关基因如细胞周期蛋白D1(cyclin D1,CCND1)以及增殖相关基因Ki67的蛋白水平,从而抑制细胞增殖,促进细胞凋亡,并使细胞周期阻滞在G1期[16]。在肝癌细胞中,显著上调的miR-1307能够靶向抑制DAB2IP来促进癌细胞的增殖、迁移和侵袭[17]。在我们预测的miR-1307潜在靶基因中,BCL2和X-连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)是细胞凋亡标志基因,是哺乳动物卵巢颗粒细胞凋亡的重要抑制因子[5,7,9,18-19]。另外,本文通过KEGG功能富集分析发现miR-1307靶基因还富集在催产素信号通路中,其中CD38是促进催产素分泌的关键因子[20-21];而原癌基因SRC的活化介导了表皮生长因子受体(epidermal growth factor receptor,EGFR)放大催产素信号溶解黄体的过程[22]。综上所述,猪miR-1307与其他哺乳动物高度保守,可能与其他哺乳动物miR-1307一样,在众多生物学进程中发挥着重要作用。
在真核生物中,细胞周期一般包括4个阶段,G1期、S期、G2期和M期(有丝分裂期)。miRNAs与细胞周期密切相关,研究证实miRNAs可通过调节各个阶段的关键细胞周期蛋白及其调节因子的表达来调节细胞周期进程[23]。例如,在人类乳腺癌细胞中,miR-17/20通过靶向抑制细胞周期蛋白CCND1来影响细胞周期进程[24]。Let-7的低表达通过直接或间接影响细胞周期调节因子如周期依赖性激酶4/6(cyclin dependent kinase 4/6,CDK4/6)和细胞分裂周期蛋白25A(cell division cycle 25A,CDC25A)的表达,改变肺癌细胞的细胞周期进程和增殖,进而诱导其有丝分裂[25]。miR-30a和miR-145通过作用于多种癌细胞中周期相关基因,影响多发癌患者的生存率[26]。在正常细胞如牛肌细胞中,肌肉特异性表达的miR-208b通过靶向抑制周期相关基因CDK抑制剂1A(CDK inhibitor 1A,CDKN1A),进而影响细胞周期和增殖[27]。在牛卵巢颗粒细胞中,miRNA-183-96-182簇通过靶向抑制叉头框蛋白O1(forkhead box O1,FOXO1)基因,调控细胞增殖和细胞周期[14]。本文研究发现,过表达或抑制miR-1307可影响猪卵巢颗粒细胞周期进程,首次证实miR-1307与哺乳动物卵巢颗粒细胞的细胞周期有关。研究发现,miR-1307是细胞周期的重要表观调节因子,在前列腺癌细胞中miR-1307通过靶向叉头框蛋白O3A(forkhead box O3A,FOXO3A)基因的3′-UTR抑制FOXO3A的表达水平,进而下调其下游基因即细胞周期抑制因子p21和p27的表达,从而影响细胞增殖与细胞周期[28]。总之,本文研究表明在猪卵巢颗粒细胞中,miR-1307是调控细胞周期的关键miRNA。但是,miR-1307通过调控下游靶基因影响猪卵巢颗粒细胞周期的分子机制还有待进一步研究。

