海参低温贮藏过程中品质与理化性质的变化
白 颖,冯丁丁,浦 源,申 平,时逸馨,奚 倩,董秀芳,启 航*
(1 大连工业大学食品学院 辽宁大连116034 2 国家海洋食品工程技术研究中心 辽宁大连116034 3 塔里木大学生命科学学院 新疆阿拉尔843300)
海参(Stichopus japonicus)是一种重要的海洋棘皮类动物,其体壁上含多种活性物质,如海参多糖和胶原蛋白等成分,具有多种生理及药理活性,是营养价值极高、具有保健作用的食品[1-3]。2018年我国的海参产量达到17.4 万t[4]。海参自身的内源酶使其具有较强的自溶现象,在贮藏过程中容易发生品质劣变,使得质构改变,营养价值降低。
近年来,内源酶中的组织蛋白酶(Cathepsin)家族和半胱氨酸蛋白酶(Caspase)家族成为研究重点。组织蛋白酶-L(Cathepsin-L)及半胱氨酸蛋白酶-3(Caspase-3)对于肉制品的品质变化有重要影响。2010年,Fontanesi 等[5]研究发现意大利白猪肉的品质与Cathepsin-L 和Cathepsin-S 相关联,这两种内源酶会对肉的嫩度、弹性产生影响。2011年,Huang 等[6]以鸡肌为原料提取肌原纤维蛋白,在25 ℃条件下,用EDTA 或EGTA 加Caspase-3 培养液培养16 h 后,检测肌肉蛋白降解和肌原纤维的超微结构,结果发现激活的Caspase-3能降解鸡肉肌原纤维蛋白,并破坏肌原纤维的结构。海参因含有丰富的内源酶而具有较强的自溶能力[7],因此对海参中内源酶的研究十分必要。
本研究以海参为原材料,考察其在4 ℃长期贮藏过程中理化性质的变化。通过可溶性胶原蛋白含量、硬度、咀嚼度、蛋白质降解、组织蛋白酶-L活性、Caspase-3 活性、结构蛋白表达量及自由基的生成等指标变化,从自由基层面、分子蛋白层面揭示海参品质的变化,为海参贮藏、保鲜提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料 鲜活的海参(Stichopus japonicus),质量约(140±10)g,大连市刘家桥市场。
1.1.2 主要试剂 Ac-DEVD-PNA、3-[(3-胆固醇氨丙基)二甲基氨基]-1-丙磺酸(CHAPS)、4-羟乙基哌嗪乙磺酸(HEPES)、苯甲基磺酰氟(PMSF),美国Sigma 公司;四甲基乙二胺(TEMED)、十二烷基硫酸钠(SDS)、聚丙烯酰胺(Acry)、过硫酸铵(APS)、二硫苏糖醇(DTT)、抑肽酶(Aprotinin)、亮抑肽酶(Leupeptin),上海生工生物工程有限公司;二甲基亚砜(DMSO),国药集团化学试剂有限公司;乙二胺四乙酸(EDTA),生工生物工程(上海)股份有限公司;β-actin 抗体,细胞信号技术公司;其它试剂均为国产分析纯级。
1.2 主要仪器及设备
TA.XT.plus 物性测试仪,英国SMS 公司;AE-6500 垂直电泳槽、AE-8135 电泳仪电源,日本ATTO 公司;MF-ChemiBIS 2.0 凝胶成像仪,以色列DNR 公司;ZKBTES-55 型真空冷冻干燥机,美国Virtis 公司;A200 型电子自旋共振波谱仪(ESR),德国BRUKER 公司;T25 数显匀浆机,德国IKA 集团;170-3940 半干转印槽,美国Bio-RAD 公司。
1.3 试验方法
1.3.1 原料预处理 将20 只新鲜的海参宰杀去脏、去筋,分割成块,每3~5 块分装于玻璃皿中置于4 ℃冰箱,分别放置1,5,10,15,25,30,60 d,没有经过任何处理的新鲜海参作为对照,-80 ℃冰箱中储存备用。另外,将预处理好的整只海参于相同条件下拍照,记录其形态变化。
1.3.2 可溶性胶原蛋白含量的测定 称取不同处理时间的海参各10 g,加入10 mL 蒸馏水,置于80 ℃水浴锅中水浴2 h(每隔30 min 摇匀1 次),于1 500×g 离心30 min,所得上清液用滤纸过滤,取0.5 mL 滤液加入水解管中,再加3 mL 3.5 mol/L 硫酸,于105 ℃烘箱中水解16 h,取出冷却至室温,加水定容至5 mL,混匀,取1 mL 上述溶液过滤,然后加入1 mL 3 mol/L 的NaOH 溶液,混匀,取0.5 mL 置于1.5 mL EP 管内,加入0.25 mL 氧化液(含50 mmol/L 氯胺T 水合物,156 mmol/L柠檬酸,375 mmol/L NaOH,661 mmol/L 乙酸钠,29%(体积分数)异丙醇,pH 6),混匀。室温放置20 min 后,加入0.25 mL 显色液〔含246 mmol/L对二甲氨基苯甲醛,35%(体积分数) 高氯酸,65%(体积分数)异丙醇〕,混匀后用锡纸包好置于60℃放置15 min,再用流水冷却3 min,取200 μL用酶标仪测定558 nm 波长下的吸光值,代入标准曲线(y=0.0721x+0.0591,R2=0.999)求含量。
1.3.3 质构的测定 不同处理时间的海参各取3~5 块(约1.5 cm×1.5 cm)进行TPA(Texture profile analysis)分析。样品置于测试平台上,于室温下测定。TPA 测试探头为P/50。测试条件:测前速率、测试速率与测后速率均为1 mm/s;压缩程度70%;停留间隔5 s;触发值5 g。
1.3.4 蛋白降解情况的测定 取不同处理时间的海参体壁组织适量,按照质量分数为33.3%的比例加入裂解液(含20 mmol/L pH 7.4 的Tris-HCl,150 mmol/L NaCl,2 mmol/L EDTA-2Na,10 mmol/L DTT,1%Triton X-100,0.1%SDS),冰浴条件下研磨,提取全蛋白,然后4 ℃,12 000×g 条件下离心15 min。根据样品的蛋白质浓度用SDSPAGE 的5×上样缓冲液(含0.25mol/L pH 7.5 的Tris-HCl,8 mol/L 尿素,5%SDS,5%β-巯基乙醇)按一定比例稀释,沸水浴煮5 min,冷却后离心。使用5%浓缩胶和10%分离胶跑电泳。电泳结束后将凝胶取出,切胶,用考马斯亮蓝R-250 染液染色过夜。脱色液脱色约1 h,倒入一半脱色液和一半水,脱色1 h,最后用凝胶成像仪的可见光成像系统成像。
1.3.5 组织蛋白酶-L(CL)活力的测定 取不同处理时间的海参体壁组织适量,按照1∶3 的质量比加入提取液(含50 mmol/L pH 7.0 的磷酸盐缓冲液,1 mmol/L EDTA,0.1%Triton X-100),冰浴条件下研磨,然后离心10 min(4 ℃,10 000×g),上清液即为待测样液。取待测样液50 μL,加入反应缓冲液(340 mmol/L 乙酸钠,60 mmol/L 乙酸,4 mmol/L 乙二胺四乙酸二钠,8 mmol/L DTT)25 μL和20 μmol/L 底物(Z-Phe-Arg-Mec)25 μL,混匀后37 ℃水浴15 min;设置空白对照组,取待测样液50 μL,加入100 μL 终止液(含0.1 mol/L 的乙酸-乙酸钠缓冲液,0.1 mol/L 氯乙酸) 和25 μL 20 μmol/L 底物,同样混匀后37 ℃水浴15 min;之后加100 μL 终止液于样品组终止反应,加25 μL 反应缓冲液于空白对照组,用荧光分光光度计(激发波长380 nm,发射波长460 nm)测定酶活力。以每mg 蛋白荧光值的差值比较组间CL 活力的变化。
1.3.6 Caspase-3 活力的测定 不同处理时间的海参体壁组织适量,将其与Caspase-3 提取液(含25 mmol/L pH 7.4 的HEPES,5 mmol/L EDTA,5 mmol/L EGTA,1 mmol/L MgCl2,5 mmol/L DTT,1 μmol/L 胃蛋白酶抑制剂,1 mmol/L PMSF) 按1∶3的质量比添加,冰浴条件下研磨,离心15 min(4℃,10 000 r/min),获得的上清液即所需酶液。在酶标板中加入10 μL 待测酶液,80 μL 分析液(含20 mmol/L pH 7.4 的HEPES,5 mmol/L EDTA,50 mmol/L DTT,1%CHAPS)和10 μL 底物(Ac-DEVD-PNA),对照组加入10 μL 待测酶液和90 μL 分析液,于37 ℃条件下,分别反应0 min 和30 min,并测定405 nm 波长处的吸光值。
1.3.7 Western 免疫印迹 取不同处理时间的海参体壁组织适量,按照1∶3 的质量比加入裂解液(含20 mmol/L pH 7.4 的Tris-HCl,2 mmol/L EGTA,2 mmol/L EDTA-2Na,150 mmol/L NaCl,1%Triton X-100,0.1%SDS,10 mmol/L DTT,1 mmol/L NaVO3,10 mmol/L NaF,10 μg/mL 抑肽酶,10 μg/mL 亮肽酶,1 mmol/L PMSF),冰浴条件下研磨,离心15 min(4 ℃,12 000×g),取上清液做SDS-PAGE 测定,结束后,组装转印系统(需排气泡),于10 V 恒压条件下转印35 min,转印后进行肌动蛋白(Actin)的一抗孵育,清洗,二抗孵育及显色反应。
1.3.8 自由基的测定 将低温处理后的海参直接冻干,制备冻干粉,然后将其填入石英样品管中,保证每个样品的填充量一致。通过ESR 检测自由基生成情况,检测条件:微波功率6.10 mW,中心磁场3.460 G,转换时间480 ms,扫描宽度200 G,调制幅度1 G,调制频率100 kHz,时间常数5 242.88 ms。
1.3.9 数据统计分析 试验数据以3 个平行组数据的平均值表示,并且计算标准差;用SPSS 软件对数据进行统计分析,采用单因素方差分析(ANOVA),P<0.05 差异显著。
2 结果与分析
2.1 海参形态的变化
海参在4 ℃处理条件下的形态变化如图1所示,处理1 d 时,海参体型明显增大;处理5 d 时,海参继续向外延伸,而形态完整。随着处理时间的延长,海参体壁开始鼓泡,出现化皮现象,瘫软变得明显,海参体壁上的刺不断分解。处理20 d 时,海参已经铺满整个平皿,海参体壁内皮组织向外翻,可明显看到白色内皮组织。20~25 d 处理期间,海参体壁组织变化不显著,化皮现象有轻微加重。30 d 之后的海参严重损伤,已经失去完整形态,刺完全消失,表皮变黏。

图1 在4 ℃贮藏条件下海参形态的变化Fig.1 Morphological changes of sea cucumber at 4 ℃storage conditions
2.2 可溶性胶原蛋白含量的变化
海参在4 ℃处理下的可溶性胶原蛋白含量变化如图2所示。可溶性胶原蛋白含量在前5 d 变化不显著,与图1海参形态的结果相符,海参在前期体壁保留完好,胶原蛋白未发生明显水解。随处理时间的延长,海参的可溶性胶原蛋白含量增加显著(P<0.05),之后呈不断上升趋势,表明海参胶原蛋白在不断水解。处理60 d 时,可溶性胶原蛋白含量已经达到(19.42 ± 0.82)mg/g,是对照组含量的5.53 倍。这与Zhu 等[8]研究鲍鱼肌肉的可溶性胶原蛋白含量变化趋势具有一定的相似性。可溶性胶原蛋白是胶原蛋白的一部分,是肌肉组织经加热或酶解后分解并溶于水的胶原[9]。
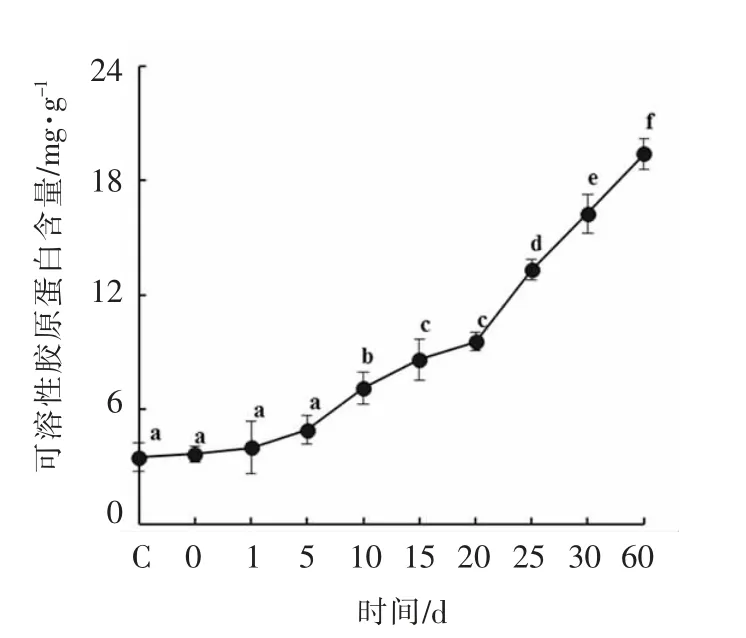
图2 海参在4 ℃贮藏条件下可溶性胶原蛋白含量的变化Fig.2 Soluble collagen content change of sea cucumber at 4 ℃storage conditions
2.3 质构的变化
海参自身的酶解和微生物作用使其变得更加柔软,弹性下降。海参的硬度、弹性、凝聚性、咀嚼性等与时间呈负相关。海参在4 ℃处理下的硬度及其咀嚼性变化如图3所示。前5 d,海参的硬度变化不显著;15~25 d 时,硬度下降显著(P<0.05);25 d 时,硬度已经降到(3 301.7±253.1)g,比对照组的硬度下降约9 倍多,比较海参在4 ℃处理条件下的形态变化(图1)发现处理25 d 时的海参损伤较为严重,表明低温处理时间过长对海参造成了负面影响。2015年,Lu 等[10]发现在4 ℃低温条件下处理后的鱼片硬度呈先增大后下降的趋势,与本试验结果呈相似的趋势。海参在4 ℃条件下的咀嚼性变化与硬度变化趋势略有不同,在处理15 d 之前,咀嚼性的变化均不显著,之后随着处理时间的延长,咀嚼性在15~25 d 时,与处理初期相比,明显下降(P<0.05),25 d 时,咀嚼性下降至(516.7±160.8)g,为未处理海参咀嚼性的4.6%,硬度和咀嚼性均在处理1 d 时出现最高值,而与未处理海参比均不显著,总体呈先增大后减小的变化趋势。此结果表明硬度和咀嚼性不是随处理时间的延长而逐渐下降,存在变硬过程,而后逐渐下降。
2.4 蛋白质的降解情况
海参在4 ℃处理条件下的蛋白变化如图4所示。前10 d 蛋白质变化不明显,处理15 d 时,200 ku 蛋白条带下面颜色加深,表明大分子蛋白开始出现降解,30 d 和60 d 时肌动蛋白条带完全消失,其它蛋白条带与对照组相比减少很多,表明在低温处理30 d 后,海参体壁组织结构几乎完全丧失,蛋白质发生了明显降解。这与Christensen等[11]发现鲱鱼和Thavaroj 等[12]研究发现的鲶鱼和罗非鱼经长时间低温处理后,其肌动蛋白会发生降解的结果相符。因此,海参长时间低温处理会引起蛋白质降解。
2.5 组织蛋白酶-L 活力的变化
海参在4 ℃贮藏条件下的酶活力变化如图5所示。整个处理期间,酶活力变化呈先升高到最大值后逐渐下降的趋势;处理15 d 时,组织蛋白酶-L 的酶活力虽有升高,但基本保持在较稳定的水平;处理20 d 时,组织蛋白酶-L 活力达到最大值(3 170.5±244.3) U/mg 蛋白(P<0.05);随后组织蛋白酶-L 活力开始下降,贮藏30 d 时降低至原来水平。2014年,Ge 等[13]报道组织蛋白酶-L 会间接影响蛋白降解。而本研究中组织蛋白酶-L没被激活前,从图4中未观察到蛋白降解,这也验证了组织蛋白酶-L 与蛋白降解有关。

图3 海参在4 ℃贮藏条件下质构的变化Fig.3 Changes in texture of sea cucumber at 4 ℃storage conditions
2.6 Caspase-3 活力的变化
海参在4 ℃处理下的Caspase-3 活力变化如图6所示。前期Caspase-3 未被激活,处理5 d仍保持较低活力;随低温处理时间的延长,酶活力开始升高,到25 d 时Caspase-3 的相对活力达到初始酶活力的2.53 倍(P<0.05),之后酶活力显著下降,而Caspase-3 的酶活力变化与内源酶中的组织蛋白酶-L 有一定的关联性,从而导致蛋白质降解。

图4 海参在4 ℃贮藏条件下的SDS-PAGEFig.4 SDS-PAGE pattern of sea cucumber at 4 ℃storage conditions

图5 海参在4 ℃贮藏条件下组织蛋白酶-L 活力变化Fig.5 Changes in the activity of cathepsin-L of sea cucumber at 4 ℃storage conditions

图6 海参在4 ℃贮藏条件下caspase-3 活力变化Fig.6 Changes in the activity of caspase-3 of sea cucumber at 4 ℃storage conditions
2.7 β-actin 表达量的变化
海参在4 ℃处理下的β-actin 蛋白表达量的情况如图7所示。β-actin 蛋白信号随时间延长呈逐渐降低的趋势,且在30~60 d 消失,与图4的电泳结果相符,同样表明蛋白质发生了明显降解。
2.8 ROS 生成量的变化
海参在4 ℃处理下的自由基生成情况如图8所示。ROS 信号强度随时间的延长,呈先上升后下降的趋势,于20 d 时达到最大值(1.08×105),约是对照组自由基生成量的2.3 倍(P<0.05)。ROS 可修饰蛋白质骨架肽链和氨基酸侧链,以改变蛋白的交联或降解,决定产品的风味、质构、颜色及蛋白质的组成,使正常蛋白质活性增强或减弱[14]。从上述结果可以看出,低温处理过程中,氧自由基显著提高,发生了氧化应激反应,而当ROS 的生成量增加到一定程度时,会对机体产生较大影响,使产品品质发生改变。

图7 海参在4 ℃贮藏条件下蛋白表达量的情况Fig.7 Protein expression in sea cucumber at 4 ℃storage conditions
3 结论
随着低温处理时间的延长,海参质构和理化性质发生改变,其中包括形态变化,质构变化(咀嚼度和硬度),内源酶活化,胶原溶出,蛋白降解。海参经低温处理后,将会产生ROS 并大量积累,使内源酶被激活,如Cathepsin-L 及Caspase-3,内源酶活力的升高使得后期蛋白质发生降解以及胶原溶出,最终使海参质构和形态发生改变。
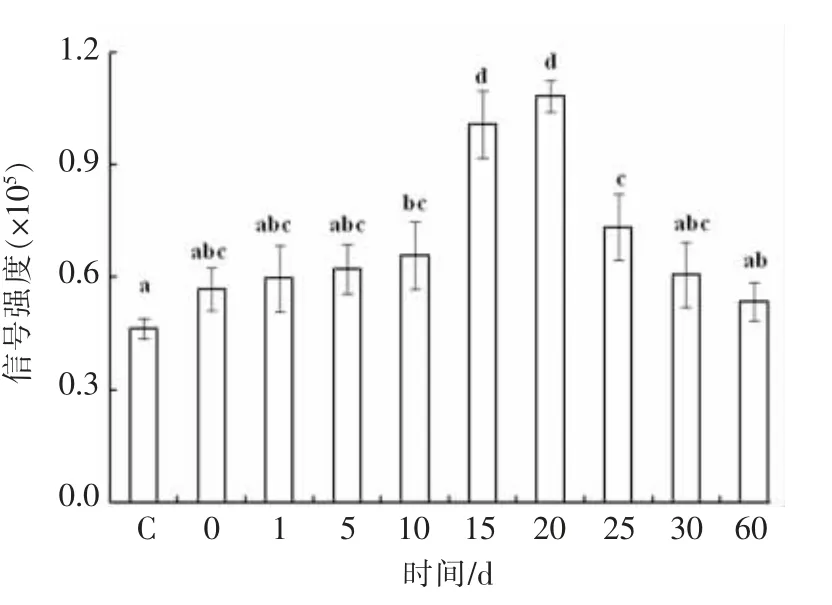
图8 海参在4 ℃贮藏下自由基生成情况Fig.8 Free radical production in sea cucumber at 4 ℃storage conditions

