Fe2O3纳米管的模拟酶活性研究及在H2O2检测中的应用
樊鹏飞,康心,程健琳,李菲菲,刘璨,胡聪聪,杨治凡,杨胜园
(1.南华大学 公共卫生学院,湖南 衡阳 421001;2.衡阳市健康危害因子检验检疫新技术研究重点实验室,湖南 衡阳 421001)
人造酶是一种非结构蛋白的合成催化剂,具有与天然酶类似的催化活性[1]。自2007年Yan等[2]发现Fe3O4纳米颗粒具有过氧化物模拟酶活性以来,多种纳米材料[3-7]被发现具有模拟酶活性。在这些纳米材料中,含铁材料由于具有优异的催化性能、低毒性、温和的反应条件而被称为绿色催化剂或载体[8-9]。Fe2O3是各铁氧化物中最稳定的材料[10],且来源丰富,价格低,抗腐蚀性强以及电、磁和催化性能优良[11]。本文通过水热法合成一种新型铁基纳米管-Fe2O3纳米管,研究其模拟酶活性,并应用于H2O2的检测。
1 实验部分
1.1 试剂与仪器
FeCl3、NaH2PO4、Na2SO4、3,3′,5,5′-四甲基联苯胺(TMB)、辣根过氧化物酶(HRP)、无水乙酸钠、冰醋酸、无水乙醇、H2O2均为分析纯;实验用水为超纯水(18.25 MΩ·cm)。
UV2550型紫外-可见分光光度计;PB-20(PB-S)型精密酸度计;FEI Tecnai G2 F20 S-TWIN场发透射电子显微镜;X射线光电子能谱仪。
1.2 Fe2O3纳米管的合成
将259.52 mg FeCl3、40 mL超纯水、2.00 mg NaH2PO4和12.49 mg Na2SO4加入100 mL平底烧瓶中,在室温下搅拌10 min。将混合物转移至 50 mL 聚四氟乙烯内衬的不锈钢高压釜中,220 ℃水热处理48 h,自然冷却至室温。离心,用去离子水和无水乙醇依次清洗,在80 ℃真空干燥12 h,得到红色粉末。
1.3 H2O2检测
TMB和HRP标准溶液的浓度分别为5.0 mmol/L 和2.0 mg/mL。在2.0 mL Ep管中,依次加入TMB(3.0 mmol)、HAc-NaAc缓冲液(pH 3.5)和不同量的H2O2溶液,混合后加入Fe2O3纳米管(4.0 mg/mL,10 μL)溶液,用超纯水稀释至 400 μL,在60 ℃下反应 25 min,同时做试剂空白。用紫外-可见分光光度计扫描,得到紫外可见吸收光谱。在最大吸收波长652 nm处测定体系吸光度(A)和试剂空白(A0),ΔA=A-A0。
2 结果与讨论
2.1 Fe2O3纳米管的表征
Fe2O3纳米管的表观形貌见图1。

图1 Fe2O3的透射电镜图Fig.1 Transmission electron microscope image ofFe2O3 nanotubes
由图1可知,所合成的纳米材料呈均匀管状,平均直径约140 nm,平均长度约180 nm。
用X射线光电子能谱(XPS)确认Fe2O3纳米管的结构,结果见图2。

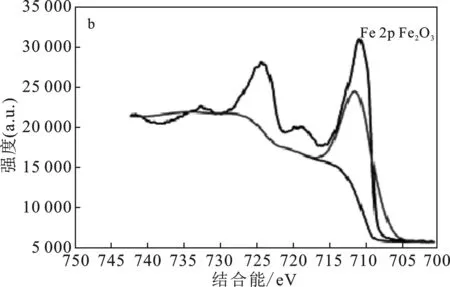

图2 Fe2O3的XPS图(a)、Fe 2p(b)、O 1s(c)的高分辨率光谱图Fig.2 XPS survey scan(a) and corresponding highresolution spectra of Fe 2p(b) and O 1s(c)
由图2可知,结合能530 eV和710 eV的光电子线分别归因于O 1s和Fe 2p。Fe 2p中位于 710.64 eV 的光电子峰(图2b)归因于Fe2O3的 Fe 2p3/2。O 1s光谱(图2c)在529.78 eV达到峰值,这归因于Fe—O的结合能。
通过TEM和XPS,确定了Fe2O3纳米管的成功合成[12]。
2.2 Fe2O3纳米管的过氧化物模拟酶活性研究
在H2O2的存在下测试了Fe2O3纳米管对过氧化物酶底物TMB的催化作用,结果见图3。
由图3可知,该体系在652 nm处有特征吸收,表明Fe2O3纳米管在H2O2存在下可以将TMB转化为oxTMB[13]。不同体系的显色反应不一样,管1为只有H2O2和TMB存在时溶液显色情况;管3为溶液中含有Fe2O3纳米管和TMB时的颜色,溶液呈现Fe2O3纳米管的颜色;只有在Fe2O3纳米管、H2O2和TMB共同存在的条件下,Fe2O3纳米管可以发生模拟过氧化物酶的催化反应,使溶液呈现蓝绿色(管2)。

图3 紫外可见吸收光谱图Fig.3 UV visible absorption spectra of the systema.TMB+H2O2;b.TMB+H2O2+Fe2O3纳米管
2.3 Fe2O3纳米管与其浸出液催化性能的比较
为了探究Fe2O3纳米管的过氧化物酶活性是由其自身而不是由浸出溶液中的金属离子引起,将Fe2O3纳米管浸入pH为3.5的HAc-NaAc缓冲溶液中2 h后离心分离,取上清液验证其过氧化物酶活性。结果表明,Fe2O3纳米管浸出溶液在H2O2存在下不能催化TMB氧化生成oxTMB。
2.4 稳态动力学研究
通过Fe2O3纳米管过氧化物模拟酶对于反应底物H2O2和TMB稳态动力学实验,研究Fe2O3纳米管过氧化物模拟酶催化活性,结果见图4。


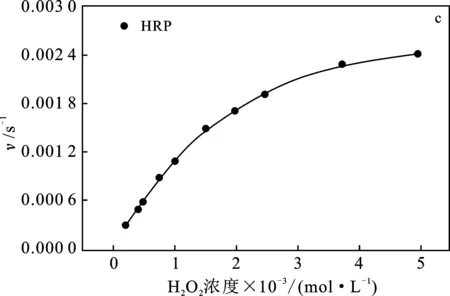


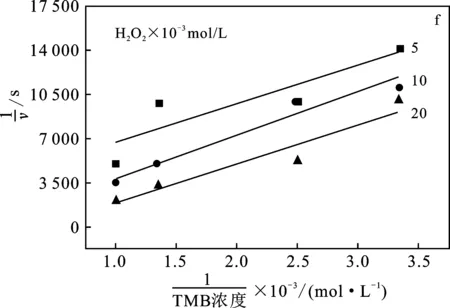
图4 稳态动力学测定及催化机理Fig.4 Steady-state kinetics assay and catalytic mechanism
由图4可知,Fe2O3纳米管催化H2O2氧化TMB的过程符合典型Michaelis-Menten方程。由图4a、4b可知,随底物H2O2和TMB浓度的增加,催化反应初速度逐渐增大,结果与HRP催化反应动力学一致(图4c、4d),进一步证明了Fe2O3纳米管具有酶的催化性能。
为了进一步研究Fe2O3纳米管模拟过氧化物酶的催化机理,通过改变H2O2和TMB的浓度,确定了Fe2O3纳米管-底物浓度的初始反应速度的双倒数曲线(图4e、4f)。从平行的双倒数曲线可以看出,以Fe2O3纳米管为基础的过氧化物酶催化机理与乒乓机理一致,即Fe2O3纳米管先与第一个底物结合,并发生反应,与第二个底物反应之前释放出第一个底物。
米氏常数(Km)是酶的特性常数,Km值越大,表明酶与底物的亲和力越小。利用Lineweaver-Burk双倒数关系曲线得到Fe2O3纳米管与HRP的Km和最大反应速率(Vmax),结果见表1。
由表1可知,Fe2O3纳米管对于底物H2O2的米氏常数小于HRP,表明Fe2O3纳米管对H2O2的亲和力高于HRP对H2O2的亲和力,这主要是由于Fe2O3纳米管的比表面积较大,且其表面对H2O2的静电相互作用,从而使得亲和力增强。而Fe2O3纳米管对于底物TMB的米氏常数大于HRP,表明Fe2O3纳米管对TMB的亲和力较HRP弱,但是Fe2O3纳米管对TMB的最大反应速率却明显优于HRP,说明Fe2O3纳米管的过氧化物模拟酶活性较HRP强。
2.5 Fe2O3纳米管和HRP的稳定性比较
为了考察Fe2O3纳米管在不同pH和温度下的稳定性,分别在pH 1~12和0~90 ℃下处理Fe2O3纳米管和HRP 2 h,根据其相对活性判断稳定性,结果见图5。


图5 Fe2O3纳米管和HRP的稳定性比较Fig.5 Comparison of stability of Fe2O3 nanotubes and HRP
由图5可知,Fe2O3纳米管在酸性条件下的稳定性明显优于HRP,且Fe2O3纳米管的温度稳定性优于HRP,在高温条件下仍能保持较高的活性。
2.6 Fe2O3纳米管可视化检测H2O2
2.6.1 H2O2检测条件的优化 H2O2和TMB作为酶促反应的底物,其浓度对Fe2O3纳米管的过氧化物酶催化活性有较大影响,同时,溶液酸碱度、温度也会对酶活性有影响。故本文对溶液pH、温度、反应时间、H2O2和TMB的浓度等实验参数进行了优化。结果表明,当Fe2O3在pH 3.5 NaAc-HAc缓冲液中,与0.2×10-3mol/L H2O2和3.0×10-3mol/L TMB在60 ℃条件下反应25 min时,相对活性达到最高。
2.6.2 线性范围、检出限及精密度 在优化的实验条件下,按照1.3节的实验方法分别测定不同浓度的H2O2溶液,结果表明,H2O2在1.07×10-6~1.00×10-4mol/L范围内具有良好的线性关系,线性回归方程为A=0.019 9+11.321c(×10-3mol/L),相关系数r=0.997 7。经11次空白平行测定,按照LOD=3Sb/k,计算出H2O2的检出限为3.22×10-7mol/L,相对标准偏差为0.12%,说明本方法具有较好的精密度。
2.7 样品分析及回收率测定
采集了新鲜的雨水和某品牌矿泉水,采用标准加入法向样品中加入H2O2标准溶液,测定加标样中的H2O2含量,计算加标回收率,结果见表2。

表2 水样中H2O2的检测结果(n=7)Table 2 Determination results of H2O2 in water samples
3 结论
合成的Fe2O3纳米管具有与辣根过氧化物酶相似的过氧化物酶活性。Fe2O3纳米管的催化活性依赖于溶液的pH、反应温度和H2O2的浓度。与HRP相比,Fe2O3纳米管对H2O2的亲和力更高,且有更强的化学稳定性。因此,建立了一种简单、廉价、灵敏的比色法测定H2O2方法。

