氟苯尼考对太平洋牡蛎(Crassostrea gigas)早期发育的影响
张莺脐, 张羡宇, 郭庆芳, 许文豪, 马 峥, 石 硕, 张 倩, 刘 鹰
氟苯尼考对太平洋牡蛎()早期发育的影响
张莺脐1, 2, 张羡宇1, 2, 郭庆芳1, 许文豪1, 马 峥1, 石 硕1, 张 倩1, 2, 刘 鹰1, 2
(1. 大连海洋大学, 海洋科技与环境学院, 辽宁 大连 116023; 2. 设施渔业教育部重点实验室, 大连海洋大学, 辽宁 大连 116023)
氟苯尼考作为氯霉素的替代物, 理化性质稳定, 在水产养殖业中被广泛使用, 致使其在多种水体环境中大量残留。本研究分析了氟苯尼考(0.1、1.0和10 mg/L)对牡蛎幼虫的生长发育、运动能力、免疫抗性的影响。结果表明, 氟苯尼考暴露24 h后, 随着暴露浓度的增加, 牡蛎幼虫的存活量呈升高趋势, 而幼虫壳高和壳宽显著降低; 氟苯尼考暴露不会引起牡蛎幼虫移动速度的变化, 1 mg/L氟苯尼考暴露后, 牡蛎幼虫移动距离呈显著性增加(<0.05)。氟苯尼考暴露浓度、牡蛎幼虫存活量及水体细菌总数之间呈显著性相关, 但水体细菌总数的变化并不是造成牡蛎幼虫发育、生长状态不同的主要原因。牡蛎幼虫在不同浓度氟苯尼考的暴露下,、和等生长发育相关基因的表达受到影响, 进而影响其生长发育、运动能力。另一方面, 高浓度氟苯尼考的暴露, 引起牡蛎幼虫和基因相对表达量上调, 积极地参与抵抗氟苯尼考暴露引起的应激反应。养殖水环境中抗生素残留可能会影响水生动物早期发育阶段的生长发育及免疫抗性, 需提高对养殖水体中抗生素残留危害的认识及监测, 进一步加强养殖水体水质的净化。
氟苯尼考; 牡蛎幼虫; 生长发育; 运动行为; 免疫抗性
随着抗生素的大量生产和广泛使用, 抗生素可通过多种途径进入环境, 包括制药和医疗废水的排放、畜牧和水产养殖过程中疫病的治疗和预防用药等[1]。因部分抗生素具有生物利用性低及不易降解的特性, 导致其常在多种类型的环境介质中被检测到[2-4]。水环境中残留的抗生素会对水生动物产生较大的影响, 包括生长发育异常、繁殖功能紊乱、生理功能和氧化应激水平变化等[5-6]。环境浓度的磺胺嘧啶暴露斑马鱼胚胎()96 h后, 会引起胚胎畸形率增多、心跳速率加快、自主运动增强等现象[7]。利用不同浓度(0、5、10 mg/L)的恩诺沙星浸泡眼斑双锯鱼幼鱼()发现, >5 mg/L的恩诺沙星浸泡24 h后, 对眼斑双锯鱼幼鱼的消化酶、免疫酶活性和氧化产物含量产生显著影响[8]。
氟苯尼考(Florfenicol, FFC)属于联合国粮农组织(FAO)批准可用于水产养殖的抗生素之一。作为动物专用的氯霉素类广谱抗生素[9], 氟苯尼考对气单孢菌()、链球菌()、弧菌()和爱德华氏菌()等病原菌引起的鱼类疾病有明显的防治效果[10-11], 其理化性质稳定、不易被水解和生物降解, 大量连续地向水环境中排放导致其在水生环境中呈“假”持久性存在, 常在多种水域生态环境中被检出。有调查显示, 我国江苏省某规模化水产养殖场和丹麦某渔场附近水域中氟苯尼考的残留量分别为937.21 ng/L和8 ng/L[12-13]。在沿海水域、沉积物及生物体内均检测到不同浓度的氟苯尼考残留[15], 在大连市的大连湾养殖场周边的水域检测到氟苯尼考残留浓度高达11 mg/L[14]。对长江下游的环太湖流域的养殖区域进行调查发现, 该流域内的养殖生物体内几乎均检测出氟苯尼考残留[16]。与早期的氯霉素类药物相比, 氟苯尼考不会引起再生障碍性贫血, 但能够可逆性地抑制红细胞生成, 且具有胚胎毒性[17]。氟苯尼考暴露会抑制虹鳟鱼()体内吞噬作用、淋巴细胞增殖等过程[18], 对南美白对虾()无节幼虫有较高的毒性[19]。
太平洋牡蛎()是我国重要的海水养殖经济贝类之一, 因其生长速度快、适应能力强、营养价值高等特点, 在我国乃至全球大量培育, 具有重要的经济价值[20]。水生生物的早期发育阶段对外源性污染物具有较高的敏感性[21-22], 被认为是指示各种污染物毒性的前哨生物[23]。低浓度的抗生素残留对成体生物未造成明显毒性作用时, 却可能会引起胚胎和幼虫的中毒反应[24]。
为探究养殖水环境中氟苯尼考残留对水生动物早期生命阶段的影响, 本研究以太平洋牡蛎受精卵为研究对象, 分析不同浓度的氟苯尼考(0.1、1.0和10 mg/L)对牡蛎幼虫生长发育、运动能力、免疫抗性等方面的影响, 进一步探讨氟苯尼考残留的潜在风险及其使用的安全浓度范围。本研究将为水产养殖过程中抗生素的科学合理使用提供理论依据。
1 材料与方法
1.1 牡蛎体外人工授精
太平洋牡蛎()于2019年6月购自大连市长兴海鲜市场, 低温运输至实验室, 于海水中暂养一天, 控制水温为(24 ± 1)℃。挑选健康性腺饱满的牡蛎用于实验, 使用无菌解剖针挑取牡蛎性腺进行涂片, 在光学显微镜(745T/SMZ1000, Nikon)下观察, 通过鉴定生殖细胞种类确定牡蛎性别, 选择生殖细胞活力较好的个体用于后续体外授精。
牡蛎亲本通过解剖取卵、人工授精的方法进行繁殖。取5只雌性牡蛎和3只雄性牡蛎, 分别剥离牡蛎性腺, 使其通过400目的筛绢以去除多余的生殖腺组织杂质, 再使用200目筛绢分别收集卵母细胞和精子, 于24℃海水中活化20 min, 使卵母细胞形体趋于饱满, 激活精子。将卵母细胞与精子以1︰10的比例混合受精, 保持较暗的光照条件, 不定时搅动水体, 受精15 min后, 利用光学显微镜观察, 确保受精成功。
1.2 实验设计
太平洋牡蛎受精卵胚胎毒性的测定参考Quiniou等人[25]方法。取约300个/mL受精卵于220×150× 180 mm的玻璃缸中孵化, 加入3 L相应浓度的氟苯尼考暴露溶液。受精卵于黑暗条件下培养24 h, 水温控制在(24 ± 0.5)℃, 持续微量曝气。参考氟苯尼考在环境中检出的浓度以及养殖过程中的投喂浓度[26], 设置氟苯尼考终浓度为0、0.1、1和10 mg/L, 每组设置三个重复。从牡蛎受精卵开始暴露24 h后, 收集样品, 进行下一步分析。
利用高效液相色谱仪(HPLC, SPD-20A, 岛津)测定10 mg/L氟苯尼考暴露液的实际浓度。流动相为乙腈(A)和超纯水(B), 流动相比例为40︰60(v︰v), 保留时间为4.2 min。检测暴露液中氟苯尼考实际浓度约为标称浓度的96.2%, 与标称浓度差异性较小, 因此将使用标称浓度进行实验计算。
1.3 水体中细菌总数的测定
测定不同浓度的氟苯尼考暴露24 h后养殖水体中的细菌总数[27]。取10 mL暴露组水样, 进行等比例稀释, 制成1︰1、1︰10、1︰100、1︰1 000的样品匀液。吸取1 mL样品匀液于琼脂培养平板中, 涂布均匀, 每个稀释度的样品匀液做三个平行。在37℃恒温培养箱内培养24 h后对菌落进行计数, 选取平板菌落个数在30~300个之间的平板进行计数, 并计算不同浓度处理组的菌落平均值。
1.4 牡蛎幼虫的生长发育
氟苯尼考暴露24 h后从各实验组随机收集1 mL暴露溶液, 置于细胞培养皿中于4倍光学显微镜(N-10E, Novel)下统计牡蛎幼虫存活量。从各实验组随机挑选20只D型幼虫, 加入2%的戊二醛进行固定, 在显微镜下观察牡蛎幼虫形态, 并利用NIS-Elements图像软件统计幼虫的壳高、壳宽。
1.5 牡蛎幼虫运动行为检测
对氟苯尼考暴露24 h后牡蛎D型幼虫的运动行为进行追踪分析。各实验组随机选取15只牡蛎幼虫置于48孔微板中, 适应5 min后, 使用体视显微镜(P-DSL32, Nikon)于16倍镜下进行垂直拍摄5 min。利用视频追踪系统(EthoVision XT, Nodus)对牡蛎幼虫运动行为轨迹进行分析, 计算幼虫游泳距离、移动速度。
1.6 荧光定量PCR基因表达
取氟苯尼考暴露24 h后的牡蛎D型幼虫置于液氮中冷冻, 于–80℃保存。使用RNA提取试剂盒(TIANGEN)提取牡蛎幼虫总RNA, 利用超微量核酸蛋白检测仪(IN0311, Monad)检查RNA浓度(260 nm)和纯度(260/280 nm)。使用Evo M-MLV 反转录试剂盒 (AG11705, 湖南艾科瑞生物工程有限公司)将RNA反转录为cDNA模板。使用TransStart TOP Green qPCR SuperMix试剂盒(Transgen Biotech)进行荧光定量PCR(Lightcycle 96, Roche)。选择与牡蛎幼虫生长发育相关的基因,和, 根据太平洋牡蛎幼虫基因组设计引物, 序列如表1所示[28]。qPCR反应参数设置为: 94℃预变性30 s, 94℃变性30 s, 退火30 s, 72℃延伸60 s, 共30个循环, 循环完成后72℃延伸5 min。各引物序列及优化的退火温度如表1所示。选择核糖体蛋白L7()为管家基因用于标准化其他目标基因的表达水平, 该基因在各处理组间未显示差异性, qRT-PCR数据采用2–ΔΔCt法进行分析。每个样品测量进行三次检测。

表1 引物序列
1.7 统计分析
使用SPSS18.0 统计软件和Origin Pro软件对测定结果进行统计分析, 实验数据采用平均值±标准误(Mean ± SE)表示。采用单因素方差分析(One-Way ANOVA)对对照组和处理组间进行统计学差异分析, 采用LSD检验或Duncan法进行事后检验。当<0.05时, 认为具有显著性差异, 当<0.01时, 认为具有极显著性差异。对氟苯尼考暴露浓度、牡蛎幼虫生存量和水体细菌总数进行相关性分析, 选择分别选择线性回归(2)和皮尔逊相关系数作为计算类型, 利用相关系数的大小判断变量间相关关系的密切程度。
2 实验结果
2.1 氟苯尼考对牡蛎幼虫的胚胎毒性
不同浓度氟苯尼考暴露24 h对牡蛎幼虫存活量的影响如图1所示。随着氟苯尼考暴露浓度的增加, 牡蛎幼虫的存活量呈上升趋势, 在10 mg/L的 FFC实验组中, 牡蛎幼虫的存活量达到最高, 约为(122.9± 5.3)个/mL, 显著高于对照组和0.1 mg/L氟苯尼考浓度组(109.9±3.8和101.1±3.6个/mL), 与1 mg/L氟苯尼考浓度组中的存活量无显著性差异。
进一步对氟苯尼考暴露24 h后各实验组养殖水体中的细菌总数进行检测。实验结果显示, 对照组水体中细菌总数为(214.2±35.3) CFU/mL, 1 mg/L和10 mg/L氟苯尼考的实验组水体内细菌总数分别为(304.2±58.7) CFU/mL、(296.8±50.4) CFU/mL, 各实验组与对照组水体中的细菌总数并无显著性差异。

图1 氟苯尼考对牡蛎幼虫存活量的影响
注: 不同上标字母表示处理组间具有差异性显著(<0.05)。
对氟苯尼考暴露浓度、牡蛎幼虫24 h存活量、水体细菌总数之间的相关性进行分析(表2)。统计结果显示, 氟苯尼考暴露浓度与牡蛎幼虫24 h存活量、水体细菌总数间具有线性关系, 且水体细菌总数与氟苯尼考暴露浓度、幼虫存活量之间显著性相关(0.5<||≤0.8), 氟苯尼考暴露浓度与幼虫存活量间呈高度相关性(0.8<||≤1)。

表2 氟苯尼考暴露浓度、牡蛎幼虫24 h存活量、水体细菌总数之间的相关性分析
2.2 氟苯尼考暴露对牡蛎幼虫生长的影响
太平洋牡蛎受精卵在培养24 h后, 进入D型幼虫期, 开始早期外壳的发育。与对照组相比, 高浓度氟苯尼考(≥1 mg/L)暴露24 h后, 牡蛎幼虫的大小显著性降低(图2)。在1 mg/L、10 mg/L氟苯尼考暴露后, D型幼虫的壳高显著降低(<0.05), 壳高的均值分别为(62.95 ± 0.19) μm、(52.83 ± 0.93) μm, 与对照组相比, 平均壳高分别减少5.50%、20.69%。不同浓度的氟苯尼考暴露24 h后, D型幼虫壳宽的变化程度较小, 其中10 mg/L氟苯尼考暴露组对壳宽(48.49 ± 0.76) μm的抑制作用显著高于其他实验组(<0.05), 与对照组相比降低16.55%。
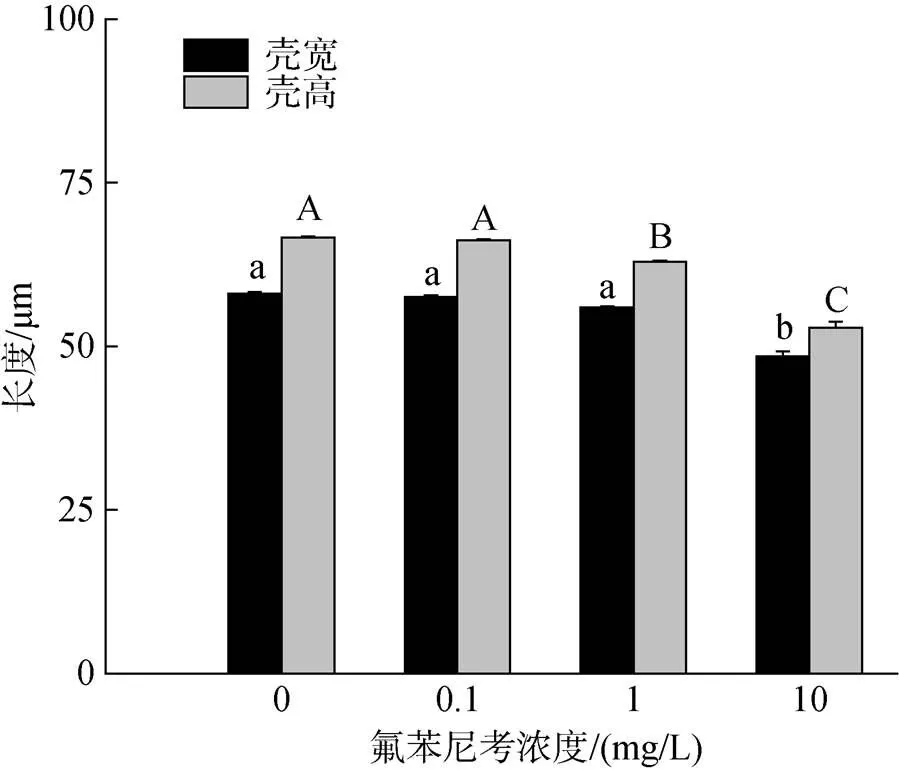
图2 氟苯尼考对牡蛎幼虫生长的影响
注: 不同小写字母表示不同处理组间壳宽具有差异性显著(<0.05), 不同大写字母表示不同处理组间壳高具有差异性显著(<0.05)。
2.3 氟苯尼考对牡蛎幼虫运动行为的影响
氟苯尼考对牡蛎幼虫自主运动行为的影响如图3所示。不同浓度的氟苯尼考暴露对D型幼虫的移动速度均未产生明显的影响, 但在1 mg/L氟苯尼考的暴露后, D型幼虫的移动速度呈上升趋势(图3a)。氟苯尼考对D型幼虫移动距离的影响如图3b所示, 低浓度氟苯尼考(<1 mg/L)暴露24 h后, 幼虫的移动距离并无明显变化, 在1 mg/L浓度组中D型幼虫的移动距离显著增加(<0.05), 相比于对照组(5.80 ± 0.53) cm, 1 mg/L组的移动距离增加了53.20%。10 mg/L氟苯尼考暴露后, 对牡蛎幼虫的移动距离、移动速度并未产生明显影响。
2.4 氟苯尼考对牡蛎幼虫生长发育相关基因表达的影响
、、和基因参与牡蛎的细胞发育和壳的生长过程。如图4所示,、基因的相对表达量出现明显变化(<0.05) (图4a, b), 而和的转录水平与对照组相似(图4c, d)。相较于1 mg/L浓度组, 在0.1 mg/L氟苯尼考暴露下, 牡蛎幼虫中的相对表达量显著增加1.13倍, 高于对照组、10 mg/L氟苯尼考浓度组, 但无显著性差异。各实验组中牡蛎幼虫基因的表达水平与对照组相似, 但1 mg/L浓度组中基因的表达水平显著低于0.1 mg/L和10 mg/L氟苯尼考浓度组(<0.05), 分别降低为0.47和0.38倍。基因和的基因表达水平随着氟苯尼考暴露浓度的增加而下调, 但无显著性差异。的表达水平在10 mg/L氟苯尼考暴露组出现上调现象, 高于其他实验组。

图3 氟苯尼考对牡蛎幼虫移动行为的影响
注: 不同上标字母表示不同处理组间差异性显著(<0.05)

图4 氟苯尼考对牡蛎幼虫生长发育相关基因表达的影响
注: 不同上标字母表示不同处理组间具有显著性差异(<0.05)。
、和基因与牡蛎的免疫功能相关。如图5所示, 氟苯尼考暴露组中基因表达水平与对照组相比呈升高趋势, 但无显著性差异。牡蛎幼虫体内基因表达水平随着氟苯尼考暴露浓度的增加而增加, 呈剂量依赖效应。与对照组相比, 1 mg/L和10 mg/L氟苯尼考暴露组中基因表达水平显著性升高, 分别增加1.41和0.90倍。低浓度氟苯尼考(<1 mg/L)对基因表达水平无明显影响, 1 mg/L和10 mg/L氟苯尼考暴露组中表达水平呈下降趋势。

图5 氟苯尼考对牡蛎幼虫免疫功能相关基因表达的影响
注: 不同上标字母表示不同处理组间具有显著性差异(<0.05)。
3 讨论
抗生素广泛应用于水生动物疾病的预防和治疗, 大量未被吸收利用的抗生素通过多种途径最终进入到水环境介质中。抗生素的残留不仅会引起耐药性的产生, 还会打破生态平衡, 影响生物多样性等。水生动植物对抗生素的富集现象会导致抗生素沿食物链进行传递并放大, 对人类健康造成影响。大量研究表明, 高浓度氟苯尼考暴露对微藻[29-31]、甲壳类水生动物[32]等的生长产生显著的抑制作用, 但较低浓度的氟苯尼考会对微藻生长产生刺激作用。已有研究利用牡蛎探究农药等污染物的毒性[33-34], 而关于抗生素对双壳类动物毒性作用的研究较少。本研究结果显示, 牡蛎幼虫的存活量随着氟苯尼考暴露浓度的增加而增大。然而, 高浓度的氟苯尼考(>1 mg/L)暴露对牡蛎幼虫的生长发育产生显著的抑制作用, 牡蛎D型幼虫的壳高和壳宽均显著降(<0.05)。牡蛎幼虫早期发育阶段对外源性化学污染物较为敏感, 与壳发育相关的生理、生化功能易受到影响, 进而影响牡蛎幼虫后期的附着变态发育等过程。
在水产动物人工育苗过程中, 水体中的细菌含量与养殖生物胚胎能否健康地生长和发育密切相关[35]。通常认为, 添加抗生素会抑制细菌病毒的繁殖, 促进养殖生物的生长。本研究中, 不同浓度的氟苯尼考暴露牡蛎幼虫24 h后, 各处理组的养殖水体中细菌总数无显著性差异。这可能由于牡蛎幼虫培育时间较短, 水体中细菌总数含量较低有关。本研究培育水体中细菌总数比其他鱼类、贝类养殖水体中细菌总数低2~3个数量级[36-37]。根据氟苯尼考暴露浓度、牡蛎幼虫存活量及水体细菌总数之间的相关性分析结果提示水体中氟苯尼考的添加会对水体中细菌的总数产生影响, 但并不是造成牡蛎幼虫发育、生长状态不同的主要原因, 可能还与抗生素种类、作用方式、暴露时间有关。
行为反应是水生动物对环境适应的直接结果, 行为学参数的研究是识别和评估环境压力的有效工具[>38]。牡蛎幼虫的泳动能力是贝类浮游幼虫阶段重要的行为表现。不同浓度的氟苯尼考暴露24 h均未引起牡蛎幼虫移动速度的显著性变化, 牡蛎幼虫的移动距离随着暴露浓度的增加呈倒“U”型, Guo等[39]研究发现氟苯尼考暴露会影响牙鲆初孵仔鱼()的自发性游泳能力, 与本研究结果相似。低浓度的氟苯尼考对牡蛎幼虫的移动距离无明显的影响, 1 mg/L氟苯尼考暴露会显著增加牡蛎幼虫的移动距离, 可能由于氟苯尼考会引起牡蛎幼虫的运动神经兴奋, 导致其静止的时间比例降低。而高浓度的氟苯尼考(10 mg/L)可能会对牡蛎幼虫产生神经毒性, 导致其自由泳动能力下降。Gamain等人[40]发现铜和S-异丙甲草胺暴露后, 牡蛎幼虫直线型运动轨迹与对照组无显著差异, 但圆形轨迹的百分比显著增加, 提示10 mg/L氟苯尼考暴露对牡蛎幼虫的移动能力产生胁迫, 可能导致其游泳多呈圆形轨迹, 使得移动距离出现下降趋势。
双壳贝类的早期发育时期对各种环境压力较为敏感, 不仅表现在形态、生理功能改变, 同时对细胞中基因和蛋白质水平产生影响。类胰岛素生长因子系统在无脊椎动物生长、发育、繁殖等过程中起着重要作用。胰岛素多肽受体基因()在贝类早期发育过程中表达量较高, 负责向细胞内传递不同配体的信号, 使贝类发育顺利进行[41]。本研究中随着氟苯尼考暴露浓度的升高表达水平呈先升高后降低趋势, 可能是由于低浓度的氟苯尼考会对牡蛎幼虫产生的毒性兴奋效应, 激活表达水平升高, 而高浓度的氟苯尼考暴露抑制表达, 影响细胞内配体的信号传递, 进而可能会影响牡蛎幼虫的生长发育。基因与软体动物的非钙化壳的形成有密切的关系, 参与贝壳角质层的形成[42], 在1 mg/L氟苯尼考的暴露下,基因水平出现显著性下降(0.05), 提示氟苯尼考暴露可能会抑制牡蛎幼虫壳的生成与钙化, 这与前文D型幼虫的生长结果相一致。基因参与细胞生长、细胞内稳态调节和细胞解毒等过程, 10 mg/L氟苯尼考的暴露引起基因表达水平的上调, 可能是氟苯尼考参与了细胞内催化氧化反应, 促进官能团与极性分子结合, 使得其水溶性增加进而促进排泄, 对氟苯尼考起到解毒的功能[43]。牡蛎幼虫内铁蛋白参与牡蛎幼虫纤毛功能的发育, 氟苯尼考暴露降低了基因的表达水平, 进而影响牡蛎幼虫的自主运动能力。
牡蛎在面对生物或非生物压力时, 可催化细胞内羟基自由基的形成, 细胞受到氧化胁迫的影响。在氟苯尼考的暴露下, 牡蛎幼虫的基因、免疫功能基因变化较小。参与保护细胞免受氧化应激[44]。随着氟苯尼考暴露浓度的增加,基因相对表达量出现上升趋势, 提示其可能参与机体抵御氟苯尼考暴露引起的氧化胁迫。在牡蛎血细胞内特异性表达, 与早期造血细胞的形成相关, 在诱导造血活性的双壳软体动物的免疫系统中起作用。Auffret等[45]人研究发现, 当多环芳烃暴露浓度超过100 μg/L时, 欧洲扇贝()血细胞数量增加, 这是面对环境胁迫时一种常见的反应。本研究中基因表达水平随着氟苯尼考暴露浓度的升高而显著上升, 说明基因积极参与氟苯尼考暴露引起的机体免疫排斥反应。家族在细胞凋亡途径中对凋亡信号的诱导、转导和增殖起着重要的作用, 通过对靶蛋白的水解, 导致程序性细胞死亡[46]。随着暴露浓度的升高,相对表达量无显著性变化, 提示氟苯尼考暴露虽然会对牡蛎幼虫产生氧化胁迫作用但不会引起牡蛎幼虫发生细胞凋亡现象。
综上, 本研究结果提示处理浓度的氟苯尼考虽然会提高牡蛎幼虫的存活量, 但对牡蛎幼虫的生长发育产生了显著的抑制作用, 随着暴露时间的延长, 可能会导致牡蛎幼虫外壳的畸形与钙化, 影响牡蛎幼虫后期变态发育及附着。此外, 高浓度的氟苯尼考(10 mg/L)暴露会造成纤毛功能的损伤, 影响牡蛎幼虫的自主运动能力, 可能会对其摄食产生影响。因此, 在养殖育苗过程中, 需密切注意养殖水体的水质状态, 提高对养殖水体中抗生素残留危害的认识及监测, 进一步加强养殖水体水质的净化。
4 结论
本实验以太平洋牡蛎幼虫为实验对象, 研究不同浓度的氟苯尼考暴露24 h后对牡蛎幼虫早期生命阶段生长发育的影响, 探讨氟苯尼考对牡蛎幼虫的作用机理, 得到以下结论:
1) 高浓度氟苯尼考(10 mg/L)暴露显著增加牡蛎幼虫的存活量。低浓度的氟苯尼考暴露(0.1 mg/L)对牡蛎幼虫的大小未产生显著性影响, 当暴露浓度高于1 mg/L时, 牡蛎幼虫的壳高、壳宽显著降低。
2) 氟苯尼考暴露对牡蛎D型幼虫的移动速度影响较小, 明显影响牡蛎幼虫的移动距离。1 mg/L氟苯尼考的暴露后, D型幼虫的移动速度有上升的趋势, 移动距离显著性增加(<0.05)。
3) 氟苯尼考通过影响牡蛎幼虫生长发育相关基因和的表达, 进而对牡蛎幼虫的生长发育、运动能力等产生影响;
4) 氟苯尼考暴露会对牡蛎幼虫产生氧化胁迫作用,和基因参与保护细胞免受氟苯尼考引起的氧化应激损伤。
[1] 王娜, 单正军, 葛峰, 等. 兽药的环境污染现状及管理建议[J]. 环境监测管理与技术, 2010, (5): 14-18. Wang Na, Shan Zhengjun, Ge Feng, et al. Environmental pollution situation and management suggestion of veterinary drugs[J]. The Administration and Technique of Environmental Monitoring, 2010, (5): 14-18.
[2] Leung H W, Minh T B, Murphy M B, et al. Distribution, fate and risk assessment of antibiotics in sewage treatment plants in Hong Kong, South China[J]. Environment International, 2012, 42: 1-9.
[3] Ayako M, Hideshige T, Kunihiro M, et al. Nationwide monitoring of selected antibiotics: Distribution and sources of sulfonamides, trimethoprim, and macrolides in Japanese rivers[J]. Science of The Total Environment, 2011, 409(24): 5305-5312.
[4] Mutiyar P K, Mittal A K. Risk assessment of antibiotic residues in different water matrices in India: key issues and challenges[J]. Environmental Science & Pollution Research, 2014, 21(12): 7723-7736.
[5] 王翔, 聂湘平, 李凯彬. 三氯异氰尿酸和环丙沙星对水生生物的急性毒性[J]. 生态科学, 2006, 25(2): 155-157. Wang Xiang, Nie Xiangping, Li Kaibin. Acute toxicity of CPFX and TCCA to Aquatic Organisms[J]. Ecological Science, 2006, 25(2): 155-157.
[6] Saglam N, Yonar M E. Effects of sulfamerazine on selected haematological and immunological parameters in rainbow trout (Onchorhynchus mykiss, Walbaum, 1792)[J]. Aquaculture Research, 2009, 40(4).
[7] 林涛, 陈燕秋, 陈卫. 水体中磺胺嘧啶对斑马鱼的生态毒性效应[J]. 安全与环境学报, 2014, 14(3): 324-327.Lin Tao, Chen Yanqiu, Chen Wei. Toxic effect of sulfadiazine on the growth of zebrafish embryos in the water body[J]. Journal of Safety and Environment, 2014, 14(3): 324-327.
[8] 高鸿伟, 胡静, 杨蕊, 等. 恩诺沙星对眼斑双锯鱼生理生化的影响[J]. 天津农学院学报, 2019, (3): 62-67. Gao Hongwei, Hu Jing, Yang Rui, et al. Effects of enrofloxacin on the physiology and biochemistry of Amphiprion ocellaris[J]. Journal of Tianjin Agricultural College, 2019, (3): 62-67.
[9] 刘蔚雯, 汪洋. 细菌对氟苯尼考的耐药机制研究进展[J]. 中国动物传染病学报, 2018, 26(1): 1-6.Liu Weiwen, Wang Yang. Mechanisms of bacterial resistance to florfenicol[J]. Chinese Journal of Veterinary Parasitology, 2018, 26(1): 1-6.
[10] 陈钊, 罗强, 常志强. 不同温度下氟苯尼考在大菱鲆体内的药代动力学研究[J]. 中国海洋大学学报, 2018, 48(12): 35-41. Chen Zhao, Luo Qiang, Chang Zhiqiang. Pharmacokinetics of Florfenicol in Turbot (Scophthalmus maximus) at two water temperatures[J]. Periodical of Ocean University of China, 2018, 48(12): 35-41.

[12] Srensen L K, Elbæk T H, 2004. Simultaneous determination of trimethoprim, sulfadiazine, florfenicol and oxolinic acid in surface water by liquid chromatography tandem mass spectrometry. Chromatographia, 60(5-6): 287- 291.
[13] 陈国鑫. 水产养殖水中抗生素的残留特性及其去除技术研究[D]. 广州: 广东工业大学, 2015: 1-2. Chen Guoxin. Study on residual characterizatjon of antibiotics in aquaculture wastewater and its removal technology[D]. Guangzhou: Guangdong Unicersity of Technology, 2015: 1-2.
[14] Zong H, Ma D, Wang J, et al. Research on florfenicol residue in coastal area of Dalian (Northern China) and analysis of functional diversity of the microbial community in marine sediment[J]. Bulletin of Environmental Contamination and Toxicology, 2010, 84(2): 245-249.
[15] Na G, Fang X, Cai Y, et al. Occurrence, distribution, and bioaccumulation of antibiotics in coastal environment of Dalian, China[J]. Marine Pollution Bulletin, 2013, 69(1-2): 233-237.
[16] 张聪, 宋超, 赵志祥, 等. 环太湖流域养殖水产品中氟苯尼考残留现状及风险评估[J]. 生态环境学报, 2017(5): 871-875. Zhang Cong, Song Chao, Zhao Zhixiang, et al. Residue and health risk assessment of florfenicol in aquaculture products around Tai Lake[J]. Ecology and Environment Sciences, 2017(5): 871-875.
[17] 张春晖, 邢广旭, 胡晓飞, 等. 动物专用药物氟苯尼考的研究进展[J]. 中兽医医药杂志, 2019, 38(5): 5-8.Zhang Chunhui, Xing Guangxu, Hu Xiaofei, et al. Reviewed on the animal medicine florfenicol[J]. Journal of Traditional Chinese Veterinary Medicine, 2019, 38(5): 5-8.
[18] Lundén T, Lilius E-M, Bylund G R. Respiratory burst activity of rainbow trout (Oncorhynchus mykiss) phagocytes is modulated by antimicrobial drugs[J]. Aquaculture, 2002, 207(3-4): 203-212.
[19] Williams R R, Bell T A, Lightner D V. Shrimp antimicrobial testing. II. toxicity testing and safety determination for twelve antimicrobials with penaeid shrimp larvae[J]. Journal of Aquatic Animal Health, 1992, 4(4): 262-270.
[20] 杨丙晔, 濮菲, 陈仲巍. 太平洋牡蛎幼体附着变态差异蛋白质组研究[J]. 应用海洋学学报, 2018, 37(3): 372-379. Yang Bingye, Pu Fei, Chen Zhongwei. Study on differentially expressed proteins related to larval settlement and metamorphosis in the Pacific oyster, Crassostrea gigas[J]. Journal of Applied Oceanography, 2018, 37(3): 372-379.
[21] Akcha F, Spagnol C, Rouxel J. Genotoxicity of diuron and glyphosate in oyster spermatozoa and embryos[J]. Aquatic Toxicology, 2012, 106-107: 104-113.
[22] Taylor A M, Maher W A. Establishing Metal exposure - dose-response relationships in marine organisms: Illustrated with a case study of cadmium toxicity in tellina deltoidalis[J]. New Oceanography Research Developments: Marine Chemistry, Ocean Floor Analyses and Marine Phytoplankton, 2010: 1-57.
[23] Mai H, Cachot J, Brune J, et al. Embryotoxic and genotoxic effects of heavy metals and pesticides on early life stages of Pacific oyster (Crassostrea gigas) [J]. Marine Pollution Bulletin, 2012, 64(12): 2663-2670.
[24] Gamain P, Gonzalez P, Cachot J, et al. Combined effects of pollutants and salinity on embryo-larval development of the Pacific oyster, Crassostrea gigas[J]. Marine Environmental Research, 2016, 113: 31-38.
[25] Quiniou F, Delesmont R, Caisey, X. Bio-indicateur de la toxicité potentielle de milieux aqueux: bio-essai: développement embryo-larvaire de bivalve[J]. Méthodes Danalyse En Milieu Marin, 2005: 24.
[26] 张莺脐, 张羡宇, 石硕, 等. 球等鞭金藻()对氟苯尼考胁迫的响应研究[J/OL]. 水生生物学报: 1-14[2020-07-29].http://kns.cnki.net/kcms/detail/42. 1230.Q.20200615.1333.004.html. Zhang Yingqi, Zhang Xianyu, Shi Shuo, et al. Effect of florfenicol on the growth of microalgae Isochrysis galbana[J/OL]. Acta Hydrobiologica Sinica: 1-14[2020-07-29]. http://kns.cnki.net/kcms/detail/42.1230.Q.20200615.1333. 004.html.
[27] 中华人民共和国卫生部. 生活饮用水标准检验方法-微生物指标: GB/T 5750.12-2006[S]. 北京: 中国标准出版社, 2006: 1-29. Minister of Health of the People’s Republic of China. Standard examination methods for drinking water- Microbiological parameters: GB/T 5750.12-2006[S]. Beijing: Standards Press of China, 2006: 1-29.
[28] Nogueira D J, Mattos, Jacó J. et al. Effects of phenanthrene on early development of the Pacific oyster Crassostrea gigas (Thunberg, 1789)[J]. Aquatic Toxicology, 2017: 50-61.
[29] Xia L I, Chen J F, Song-Hui L U, et al. Growth inhibition effect of phenicol antibiotics on Chlorella pyenoidosa[J]. Journal of Jinan University, 2012, 33(3): 294- 299.
[30] Liu W, Ming Y, Huang Z, et al. Impacts of florfenicol on marine diatom Skeletonema costatum through photosynthesis inhibition and oxidative damages[J]. Plant Physiology & Biochemistry, 2012, 60: 165-170.
[31] Wang M, Zhang Y, Guo P. Effect of florfenicol and thiamphenicol exposure on the photosynthesis and antioxidant system of, Microcystis flos-aquae[J]. Aquatic Toxicology, 2017, 186: 67-76.
[32] Ferreira C S G, Nunes B A, Henriques-Almeida J M D M, et al. Acute toxicity of oxytetracycline and florfenicol to the microalgae Tetraselmis chuii and to the crustacean Artemia parthenogenetica[J]. Ecotoxicol Environ Saf, 2007, 67(3): 452-458.
[33] Rouxel F A C S J. Genotoxicity of diuron and glyphosate in oyster spermatozoa and embryos[J]. Aquatic Toxicology, 2012, 106-107(15): 104-113.
[34] Mai H, Gonzalez P, Pardon P, et al. Comparative responses of sperm cells and embryos of Pacific oyster (Crassostrea gigas) to exposure to metolachlor and its degradation products[J]. Aquatic Toxicology, 2014, 147: 48-56.
[35] 孙雪莹. 虾夷扇贝幼体及育苗池水体细菌群落动态及潜在益生菌筛选[D]. 大连: 大连海洋大学, 2016. Sun Xueying. Thesis for the degree of Master of Science[D]. Dalian: Dalian Ocean University, 2016.
[36] 杨宝丽. 皱纹盘鲍养殖水体及其消化道中细菌动态变化特征研究[D]. 上海: 上海海洋大学, 2015, 24. Yang Baoli. Bacteria ecological characteristics in aquacultural water and digestive tract of Haliotis Discus Hannai[D]. Shanghai: Shanghai Ocean University, 2015, 24.
[37] 王顺奎, 李杰, 姜永新, 等. 大西洋鲑循环水养殖水体中细菌总数的动态监测[J]. 齐鲁渔业, 2017, 34(11): 16-18. Wang Shunkui, Li Jie, Jiang Yongxin, et al. Dynamic monitoring of total bacterial count in Atlantic Salmon recirculating aquaculture water[J]. Shandong Fisheries, 2017, 34(11): 16-18.
[38] Zhihan L, Alex T, Franck D S, et al. Game on, science - How video game technology may help biologists tackle visualization challenges[J]. PloS One, 2013, 8(3): e57990.
[39] Guo R, Zhang Y Q, Zhang X Y, et al. Effects of florfenicol exposure on growth, development and antioxidant capacity of flounder Paralichthys olivaceus larvae at different developmental stages[J]. Journal of Oceanology and Limnology, 2020, 38(2): 550-559.
[40] Gamain P, Roméro-Ramirez, Alicia, Gonzalez P, et al. Assessment of swimming behavior of the Pacific oyster D-larvae (Crassostrea gigas) following exposure to model pollutants[J]. Environmental Science & Pollution Research, 2019.
[41] Ji Q, Zixia H, Jun C, et al. Sequencing and de novo Analysis of Crassostrea angulata (Fujian Oyster) from 8 Different Developing Phases Using 454 GSFlx[J]. PLoS One, 2012, 7(8): e43653.
[42] Huan P, Liu G, Wang H, et al. Identification of a tyrosinase gene potentially involved in early larval shell biogenesis of the Pacific oyster Crassostrea gigas[J]. Development Genes and Evolution, 2013, 223(6): 389-394.
[43] Sharifian S, Homaei A, Kamrani E, et al. New insights on the marine cytochrome P450 enzymes and their biotechnological importance[J]. International Journal of Biological Macromolecules, 2020, 142(1): 811-821.
[44] 周璇, 阳学风. 神经酰胺诱导肿瘤细胞凋亡的机制研究进展[J]. 现代生物医学进展, 2015, 15(1): 174-177. Zhou Xuan, Yang Xuefeng. Progression of mechanism that ceramide-induced apoptosis of tumor cells[J]. Progress in Modern Biomedicine, 2015, 15(1): 174-177.
[45] Auffret M, Rousseau S, Boutet I, et al. A multiparametric approach for monitoring immunotoxic responses in mussels from contaminated sites in Western Mediterranea[J]. Ecotoxicology & Environmental Safety, 2006, 63(3): 393-405.
[46] Lee W K, Kim J S, Kang H G, et al. Polymorphisms in the Caspase7 gene and the risk of lung cancer[J]. Lung Cancer, 2009, 65(1): 19-24.
Effects of florfenicol on the development ofduring the early developmental stage
ZHANG Ying-qi1, 2, ZHANG Xian-yu1, 2, GUO Qing-fang1, XU Wen-hao1, MA Zheng1, SHI Shuo1, ZHANG Qian1, 2, LIU Ying1, 2
(1. College of Marine Science and Environment, Dalian Ocean University, Dalian 116023, China; 2. Key Laboratory of Environment Controlled Aquaculture, Ministry of Education, Dalian Ocean University, Dalian 116023, China)
Florfenicol, the alternative of chloramphenicol, is the most commonly used antibiotic in aquaculture. Its residues are widely distributed in the aquatic environment because of its low degradability. In the present research, the effects of florfenicol (0.1, 1.0, and 10mg/L) on the growth and development, motor behavior, and immunity oflarvae during the early developmental stage were investigated. The results showed that the survival of larvae increased with increasing florfenicol concentration, whereas the shell height and shell width of the larvae considerably decreased after exposure for 24h. Further, there was little effect on moving velocity, and the moving distance considerably increased when exposed to florfenicol at the concentration of 1mg/L.The correlations among the concentration of florfenicol, survival of the larvae, and total number of bacteria were observed, In contrast, the total numbers of bacteria may not be the main reason for the differences in growth and development. Florfenicol affected the mRNA expression of,and, which further influenced the growth and development as well as the motor ability of the larvae. On the other hand, the high concentration of florfenicol induced oxidative stress in the larvae, the levels ofandwere upregulated, and they participated in the immune stress response. The antibiotic residues in aquaculture may affect the growth and immunity of animals during the early developmental stage. Thus, it is necessary to improve the understanding and monitoring of antibiotic residues in the aquatic environment and to strengthen the water purification efforts.
florfenicol; oyster larvae; growth and development; motor behavior; immune resistance
Jun. 29, 2020
R994.6
A
1000-3096(2021)01-0100-10
10.11759/hykx20200629002
2020-06-29;
2020-08-01
广东省重点研发计划项目(2019B020215001); 辽宁省自然基金计划项目(2019-BS-035); 辽宁省高水平创新团队境外培养项目(201818); 工业生态与环境工程教育部重点实验室开放课题(KLIEEE-17-12)
[the Key R&D Program of Guangdong Province, No. 2019B020215001; the PhD Research Funds of Liaoning Province, No. 2019–BS-035; Overseas Training Program for Innovation Team of Liaoning Province, No. 201818; Foundation of Key Laboratory of Industrial Ecology and Environmental Engineering, Ministry of Education, No. KLIEEE-17-12]
张莺脐(1995‒), 女, 辽宁省盘锦, 学士学位, 在读研究生, 主要从事水产养殖中抗生素相关研究, 电话: 15504177520, E-mail: 1430152168@qq.com; 张倩,通信作者, 讲师, E-mail: qianzhang@ dlou.edu.cn
(本文编辑: 杨 悦)

