解淀粉芽孢杆菌化感作用对球等鞭金藻生长抑制效果
李晓英, 陈义华, 赵裕超, 冯森磊, 李雯倩, 朱 强, 董志国
解淀粉芽孢杆菌化感作用对球等鞭金藻生长抑制效果
李晓英1, 陈义华2, 赵裕超1, 冯森磊1, 李雯倩1, 朱 强1, 董志国1
(1. 江苏海洋大学 江苏省海洋生物技术重点实验室, 连云港 222005; 2. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 200090)
为探明解淀粉芽孢杆菌及其代谢物对海水养殖环境中微藻的化感作用, 本文以实验生态学方法研究了解淀粉芽孢杆菌对球等鞭金藻生长的生态作用。实验设计了不同剂量(100mL、500mL、1 000mL)的解淀粉芽孢杆菌纯菌液、解淀粉芽孢杆菌代谢产物、解淀粉芽孢杆菌及代谢产物混合液三种组合研究其对球等鞭金藻的培养影响。结果显示, 添加纯菌液组金藻在第1~2 d增长缓慢, 藻细胞数无显著差异, 但均低于对照组, 其中第3~4 d显著低于对照组(<0.05); 添加菌代谢产物组第1 d金藻细胞数与对照组相比无显著差异, 2~4 d显著低于对照组(<0.05); 添加菌液及代谢产物混合液组中100mL组金藻生长较缓慢, 500 µL和1 000 µL组藻细胞数呈下降趋势, 藻细胞数显著低于对照组(<0.05), 1 000 µL组金藻第2 d已全部死亡。各剂量组藻细胞数均呈现解淀粉芽孢杆纯菌液、解淀粉芽孢杆菌代谢产物、解淀粉芽孢杆菌及代谢产物混合液依次下降, 另外, 除菌代谢物1 000 µL剂量组藻细胞数大于500 µL剂量组外, 其余各组添加量越大藻细胞数越少, 呈现剂量效应关系。解淀粉芽孢杆纯菌液、解淀粉芽孢杆菌代谢产物、解淀粉芽孢杆菌及代谢产物混合液抑制率最高分别为35.84%、69.75%、100%, 表明解淀粉芽孢杆菌对球等鞭金藻的作用为化感抑制, 且抑制效果具有剂量效应。本研究为解淀粉芽孢杆菌在水产养殖中应用效果评价提供了科学依据, 同时为赤潮藻类治理提供新思路。
球等鞭金藻; 解淀粉芽孢杆菌; 化感作用; 生长性能
微藻作为优质饵料以及改善水质的首选生物一直在水产养殖中占据重要的地位。球等鞭金藻()无细胞壁, 粒径小, 营养丰富易吸收, 是多种海产动物喜食的饵料生物[1]。益生菌的使用在水产养殖中已经非常普遍, 其安全问题一直是人们关注的热点[2]。另外竞争抑制是益生菌的重要作用机制[3], 这也给水中微藻生长和繁殖造成很大的影响[4], 因此研究微生物对微藻的作用效果意义重大。
化感作用多指植物通过释放化学物质到环境中从而产生对其他植物直接或间接、有利或不利作用[5], 但化感作用同样普遍存在于微生物之间[6-7]。解淀粉芽孢杆菌()属芽孢杆菌属, 是广泛存在于自然界的一种非致病性细菌, 能够分泌抗生素、抗菌蛋白或多肽类物质, 对多种病原菌、真菌等具有良好的抑制作用[8], 如对烟草的促生长及抗烟草花叶病毒的作用[9], 抑制烟草青枯病菌()[10]、黄瓜花叶病毒的侵染[11]。目前, 大型水生植物以及微藻间的化感作用研究较多[12-15], 微生物对与藻类之间的相互作用也有研究。韩光耀等发现溶藻细菌DH-e代谢产物可以抑制东海原甲藻()的生长[16], Zheng等在河口土壤和海水中发现了多种杀藻细菌[17], Wang等在赤潮水体中分离出了一种可以使塔玛亚历山大藻()溶解的细菌分泌蛋白[18]。解淀粉芽孢杆菌已被作为水产养殖中常用水质改良剂或复合微生态制剂的主要有益菌之一被广泛开发应用[19], 但其对海洋微藻的作用究竟是化感促进还是化感抑制还有待探讨。因此, 本文首次以海水养殖池塘中常见的微藻饵料球等鞭金藻为试验材料, 探明解淀粉芽孢杆菌及其代谢物对这种海藻的化感作用, 从而为解淀粉芽孢杆菌在水产养殖中应用效果评价提供科学依据, 同时为赤潮藻类治理提供新思路。
1 材料与方法
1.1 解淀粉芽孢杆菌及其代谢物的制备
试验所用解淀粉芽孢杆菌B5从对虾养殖海水中直接分离、筛选、鉴定后通过培养而获得。将经培养后的解淀粉芽孢杆菌接种到种子培养基中制备种子液。种子培养基: 葡萄糖2.5 g, 氯化钠25 g, 胰蛋白胨17 g, 磷酸氢二钾2.5 g, 蒸馏水1000 mL, pH自然, 121℃, 灭菌25 min。将制备的种子液接种到发酵培养基中制备发酵液。发酵培养基: 玉米粉2.9 g, 豆饼粉12.5 g, 磷酸氢二钾1.5 g, 氯化钠27.6 g、蒸馏水1000 mL, pH自然, 121℃, 灭菌25 min。发酵采用16 L发酵罐。发酵条件: 装液系数0.75, 初始pH 7.5, 接种量3%, 发酵温度31℃, 机械搅拌转速180 r/min, 通气量1.2 V/(V·min), 发酵周期36 h。将一部分发酵产物用0.22mm的微孔过滤膜过滤, 获得不含解淀粉芽孢杆菌的发酵液(解淀粉芽孢杆菌代谢产物); 另一部分不经过滤, 为解淀粉芽孢杆菌液和发酵液混合液, 备用。
1.2 藻种及培养条件
球等鞭金藻藻种由上海海洋大学藻种室提供。活化后在光照培养箱中培养, 参数设定: 温度20℃, 光强60 μmol photons/(m2·s), 光周期12 L︰12 D。培养用海水为经0.45mm滤膜抽滤、灭菌处理的自然海水, 营养液为f/2培养液。每天定时摇动培养瓶两次, 防止其附壁生长, 期间维持藻液pH在7.9~8.1。
1.3 球等鞭金藻细胞数测定
取1 mL藻液, 用血球计数板在光学显微镜下计数, 计算出此藻液浓度。稀释藻液, 使其浓度分别为原来的20%、40%、60%、80%、100%, 在663 nm波长处分别测量吸光值, 绘制藻浓度与吸光度的线性标准曲线, 用于后续实验球等鞭金藻细胞数的计算。球等鞭金藻细胞密度与吸光值之间的线性回归方程及相关系数为:=104.97+0.153 9,=0.992 7, 线性曲线见图1。
1.4 菌藻作用试验设计
实验用三角瓶规格为250 mL, 均经反复冲洗及高压灭菌处理。将处于对数生长期的球等鞭金藻50 mL接种到三角瓶中, 瓶中海水体积为200 mL, 内含f/2培养液, 初始密度为1.83×106个/mL。实验进行4 d, 菌藻共培条件同1.2。
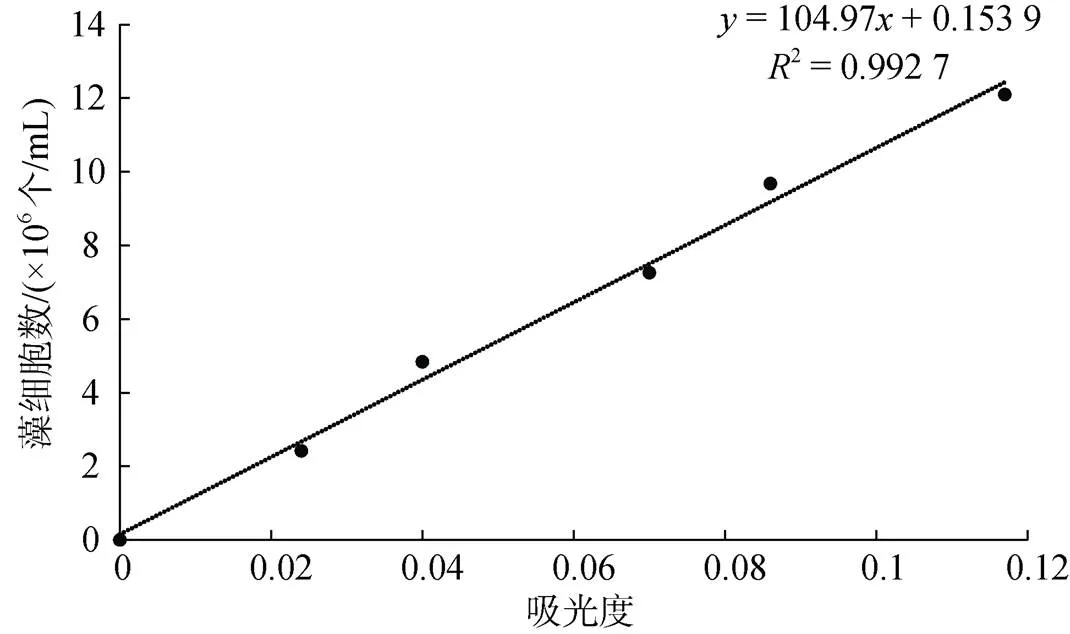
图1 球等鞭金藻细胞数与吸光值之间的线性曲线
将实验分为对照组、实验组和空白组, 每组均设置三个重复。对照组只接种50 mL球等鞭金藻(I组)。实验组分为三组, 每组先接种与对照组等量的球等鞭金藻, 第一组再接种不含发酵液的解淀粉芽孢杆菌纯菌液(纯菌液组, 密度为1.0×109个/mL), 第二组再接种解淀粉芽孢杆菌代谢产物(代谢物组), 第三组再接种解淀粉芽孢杆菌液和代谢产物的混合液(混合液组, 其中含解淀粉芽孢杆菌密度为1.0×109个/mL),剂量均分别为100 µL、500 µL、1000 µL, 相关表示方法见表1。空白组也分为三组, 不接藻种, 分别对应三个对照组添加相同剂量的三种解淀粉芽孢杆菌添加液。每天定时测量每组的吸光值, 计算球等鞭金藻细胞浓度, 其中实验组藻细胞浓度计算时, 最终吸光值为对照组吸光值减去对应空白组的吸光值。
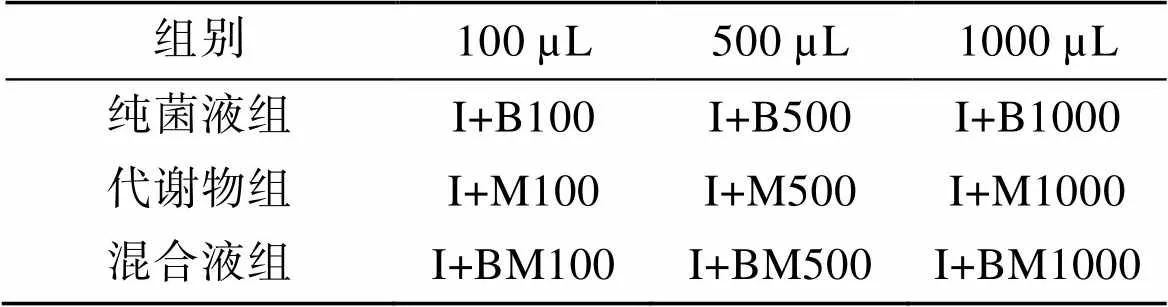
表1 解淀粉芽孢杆菌与球等鞭金藻共培养表示方法
注: I: 球等鞭金藻; B: 解淀粉芽孢杆菌; M: 菌代谢产物
1.5 数据处理
抑制率公式: PI(%)=(1–N/N0)×100%。其中, N0和N分别为对照组球等鞭金藻浓度和试验组球等鞭金藻浓度; PI为抑制比例, PI=50%时对应的浓度为EC50。
数据用Statistica 5.5软件做ANOVA分析, 并进行Duncan多重比较, 以<0.05作为差异显著水平。
2 结果与讨论
2.1 解淀粉芽孢杆菌对球等鞭金藻生长的影响
与对照组相比, I+B100、I+B500、I+B1000三组球等鞭金藻在第1~3 d增长缓慢, 藻细胞数无显著差异, 但均低于对照组, 其中第3~4 d三组均显著低于对照组(<0.05, 图2a)。各组抑制率均没有超过50%(图2b)。前3 d, I+B1000组抑制率持续增加, I+B100、I+B500两组抑制率在第1 d时增加明显且高于I+B1000组, 在第2 d时下降。第3 d后I+B100和I+B500两组抑制率开始下降, 其藻细胞数也开始明显增加, 但仍显著低于对照组(<0.05), I+B1000组抑制率高于另外两组, 藻细胞数最低。实验结束, I+B100、I+B500、I+B1000三组中的球等鞭金藻藻细胞数分别比对照组低了7.95%、23.77%、35.80%。
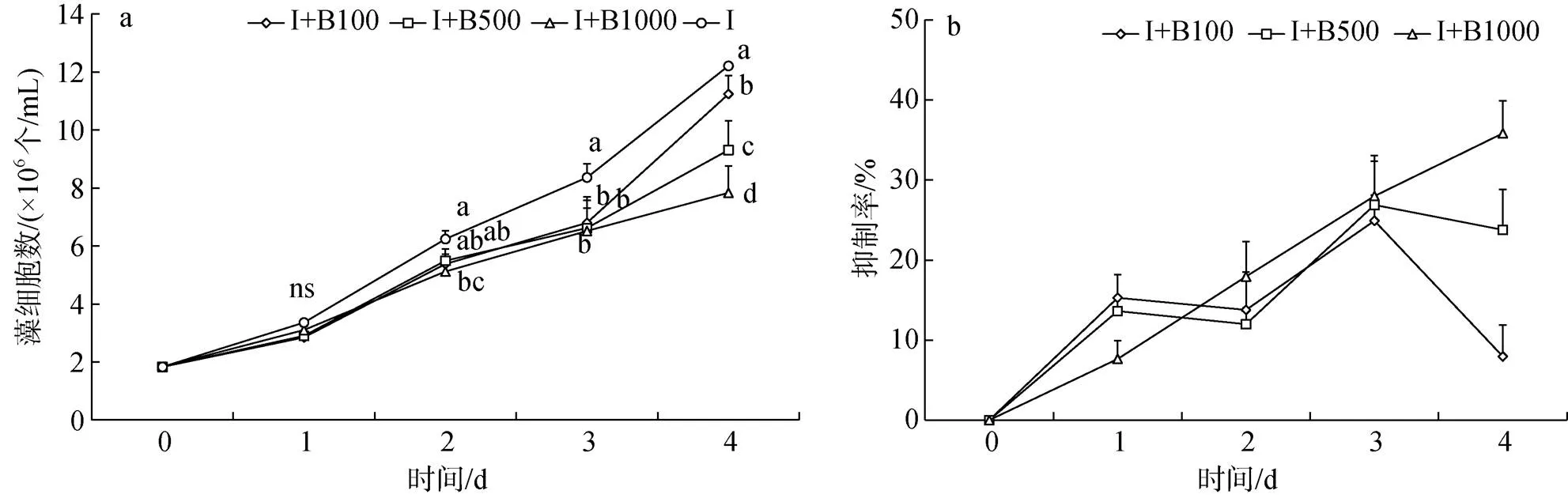
图2 添加解淀粉芽孢杆菌纯菌液组球等鞭金藻生长曲线和抑制率
注: 图2a中相同时间不同添加量间字母不同表示藻细胞数存在显著差异(<0.05), ns表示不存在显著差异。
2.2 解淀粉芽孢杆菌代谢产物对球等鞭金藻生长的影响
第1 d, I+M100、I+M500、I+M1000三组球等鞭金藻细胞数与对照组相比无显著差异(>0.05, 图3a), 第2 d和第3 d三组均显著低于对照组(<0.05), 其中I+M500和I+M1000两组差异不显著(>0.05), 第4 d四组均存在显著差异(<0.05), 添加代谢物量越多, 藻细胞数越低。抑制率在第1 d后明显增加(图3b), 第3 d后抑制率增加减缓, I+M1000组抑制率下降。实验结束, I+M100、I+M500、I+M1000三组中的球等鞭金藻藻细胞数分别比对照组下降了45.16%、69.67%、53.52%。

图3 添加解淀粉芽孢杆菌代谢产物组球等鞭金藻生长曲线和抑制率
注: 图3a中相同时间不同添加量间字母不同表示藻细胞数存在显著差异(<0.05), ns表示不存在显著差异。
2.3 解淀粉芽孢杆菌及代谢产物混合液对球等鞭金藻生长的影响
与对照组相比, I+BM100组球等鞭金藻生长较缓慢, I+BM500、I+BM1000两组藻细胞数呈下降趋势(图4a), 藻细胞数显著低于对照组(<0.05), 其中I+BM1000组球等鞭金藻第2 d已经全部死亡。实验开始后三组抑制率增加明显(图4b), 1 d后缓慢增加, I+BM1000组抑制率第2 d已经为100%。实验结束, I+M100、I+M500、I+M1000三组中的球等鞭金藻藻细胞数分别比对照组下降了57.54%、94.19%、100%。
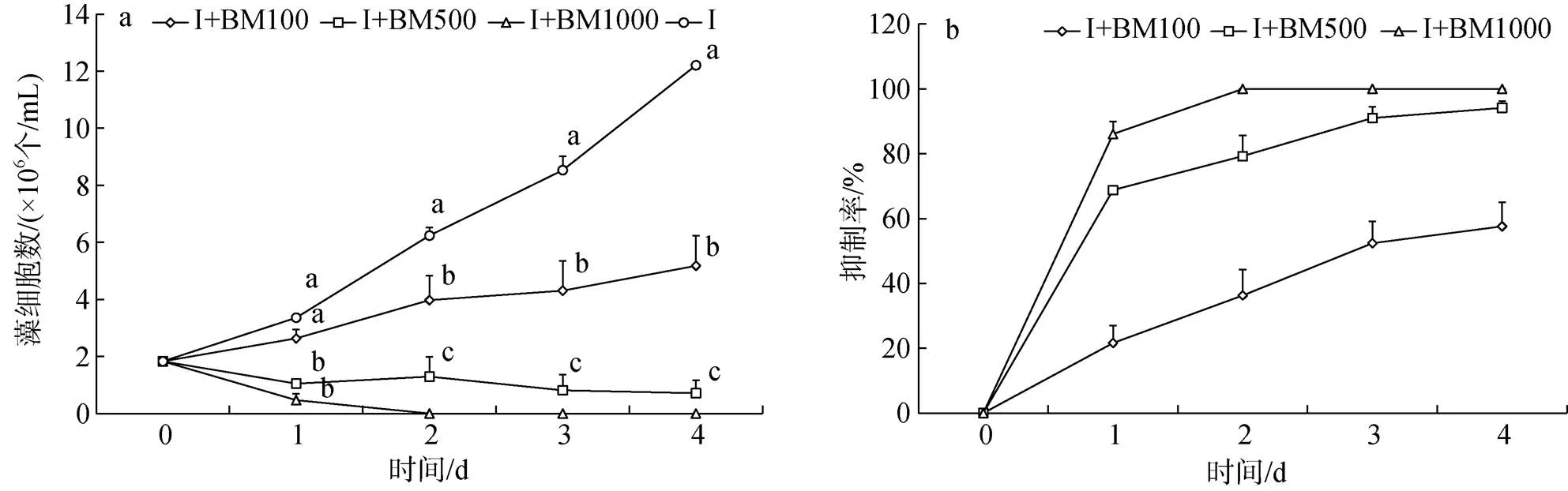
图4 添加混合液组球等鞭金藻生长曲线和抑制率
注: 图4a中相同时间不同添加量间字母不同表示藻细胞数存在显著差异(<0.05)
2.4 相同条件下不同添加物对球等鞭金藻生长的影响
为便于分析三种不同解淀粉芽孢杆菌添加物对球等鞭金藻影响的差异, 图5为实验结束后球等鞭金藻细胞数和抑制率。添加解淀粉芽孢杆菌纯菌液、代谢物以及混合物球等鞭金藻细胞数均低于对照组。添加不同浓度藻细胞数也有差异(图5a), 各浓度组藻细胞数均呈现解淀粉芽孢杆菌纯菌液、代谢物以及混合物依次下降, 另外除I+M1000组藻细胞数大于I+M500外, 其余各组添加剂量越大藻细胞数越少。抑制率则与藻细胞数相反(图5b), 各浓度组抑制率均呈现解淀粉芽孢杆纯菌液、代谢物以及混合物依次上升, 除I+M1000组抑制率小于I+M500外, 其余各组添加剂量越大抑制率越高。

图5 添加不同物质组球等鞭金藻细胞数和抑制率对比
3 讨论
益生菌因具有提高水产动物免疫力, 改善水质等优点在水产养殖中被大量使用, 但是部分益生菌可以对水产动物甚至人体造成损害, 例如芽孢杆菌属[20-21]。解淀粉芽孢杆菌属于芽孢杆菌属, 但是已有研究表明该种菌的微胶囊对水产动物没有毒性[19]。微藻是水产贝类以及其他经济动物常用的生物饵料, 解淀粉芽孢杆菌对有益微藻的作用效果研究相对较少。球等鞭金藻是水产中常用的微藻饵料, 本实验目的就是探明解淀粉芽孢杆菌及其代谢产物能否对球等鞭金藻生长造成影响, 进而探究这种影响是正面的还是负面的。
化感作用多被用于植物之间的相关研究, 微生物与微藻之间的化感作用对水产养殖生产具有很好的指导作用。抑藻细菌的作用方式可分为直接接触抑制和释放抑制物质的间接抑制[22-23], 解淀粉芽孢杆菌在生长繁殖过程中会产生一些代谢产物, 这些代谢产中含有抑藻物质, 从而起到间接的抑藻作用。许波在对解淀粉芽孢杆菌的研究中发现其代谢产物中含有的赖氨酸和苯丙氨酸, 二者可共同对微藻水华起到抑制作用[24]。本研究发现, 解淀粉芽孢杆菌对球等鞭金藻同样具有抑制效果, 添加纯菌液组、代谢物组和混合液组均表现出了较强的抑制作用, 球等鞭金藻细胞数显著低于未添加组。其中纯菌液组抑制率最低, 抑制率最高35.84%, 100 µL剂量组3 d后抑制率下降, 球等鞭金藻还可以继续恢复增长, 可以用于减缓球等鞭金藻老化; 混合液组抑制效果最为显著, 抑制率最高可达到100%, 100 µL剂量组球等鞭金藻生长极为缓慢, 可用于球等鞭金藻的长期保存。Li等[25]发现菌藻之间是通过化学信号交流的, 而在植物化感作用研究中, 多为植物的提取液或者研磨液[26-27], 可以推测这种化学物质是存在于植物体内, 需要对其处理后才能大量释放, 从而对其他物种起到化感抑制作用, 而本身具有的抑制作用较小, 这可能是添加纯菌液组抑制效果最差的原因。抑藻细菌可通过产生抗生素、肽类化合物、氨基酸及小分子化合物等对微藻起到抑制作用[23], 但是本文结果显示添加混合液组的抑制作用远强于其他两组并能产生致死效果, 这也说明可能存在接触抑制或者直接溶藻的方式[23]。因此解淀粉芽孢杆菌具体的作用机理将是本研究后续的主要方目标。
微生物对微藻的化感作用除了抑制还有促进作用, 有些细菌可以产生植物细胞分类素和茁壮素等植物激素起到促进生长的作用[28], Dimitrieva等也发现柠檬假交替单胞菌()可以促进海带()的生长[29], 本研究对解淀粉芽孢杆菌的三种添加物分别设置了100、500 µL、1000 µL三种浓度, 发现对球等鞭金藻均是抑制作用, 而且后续又做了10 µL、30 µL的添加实验, 同样没有发现促进效果, 说明解淀粉芽孢杆菌对球等鞭金藻的生长确实存在抑制效应。沙俊涛等研究发现化感作用存在浓度效应[30], 且呈现低促高抑的规律。本研究中三种添加解淀粉芽孢杆菌添加液明显对球等鞭金藻产生了抑制, 并随浓度的升高效果更明显, 表明解淀粉芽孢杆菌化感作用存在浓度效应。添加纯菌液组和混合液组抑制率均随解淀粉芽孢杆菌添加剂量的增加而增加, 但是添加代谢物组在3 d后500 µL剂量组的抑制率超过了1000 µL剂量组, 说明解淀粉芽孢杆菌代谢物抑制作用并不是浓度越高越好, 这其中原因还需要进一步的实验研究。当抑制物浓度达到一定阈值才出现明显的化感抑制作用, 在阈值之上浓度越高抑制作用越显著[31]。在同等的浓度下, 添加代谢产物组不能致死, 而添加混合液组所显示出的抑制作用远强于其他两组并能产生致死效果, 其抑制效果大于其他两组的叠加。可能是由于解淀粉芽孢杆菌的直接溶藻作用增加了混合液对球等鞭金藻的抑制效果, 这也能解释为什么代谢物1000 µL剂量组抑制率低, 而组混合液1000 µL剂量组抑制率提高的原因。赤潮藻治理问题成为近几年的研究热点, 本研究发现添加混合液组对球等鞭金藻有致死效果, 并且正在进行的解淀粉芽孢杆菌对赤潮藻——三角褐指藻()的影响实验中也发现了很好的抑制效果, 这也为赤潮藻的治理提供了新思路。
4 结论
解淀粉芽孢杆菌及其代谢产物可抑制球等鞭金藻细胞的生长, 其中代谢产物的抑制作用优于解淀粉芽孢杆纯菌液, 而两种混合后的抑制作用最显著, 具有致死效果。抑制效果具有剂量效应, 基本呈现抑制效果与添加剂量成正相关。另外, 解淀粉芽孢杆菌纯菌液100 µL球等鞭金藻还可以继续恢复增长, 可用于减缓球等鞭金藻老化; 混合液100 µL剂量组球等鞭金藻生长极为缓慢, 可用于球等鞭金藻的长期保存。
[1] 孔周雁, 张羽帆, 凌婷, 等. 球等鞭金藻三级培养过程中细菌群落多样性分析[J]. 核农学报, 2020, 34(3): 506-514. Kong Zhouyan, Zhang Yufan, Ling Ting, et al. Analysis of bacterial community diversity in tertiary culture of[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(3): 506-514.
[2] 玄振盈, 于洋. 水产动物饲料中益生菌作用机制的研究进展[J]. 山东畜牧兽医, 2017, 38(7): 79.Xuan Zhenying, Yu Yang. Research progress on the mechanism of probiotics in aquatic animal feeds[J]. Shandong Vocational Animal Science and Veterinary, 2017, 38(7): 79.
[3] 李海兵, 宋晓玲, 李赟, 等. 水产动物益生菌研究进展[J]. 动物医学进展, 2008, 29(5): 94-99. Li Haibing, Song Xiaoling, Li Yun, et al. Progress on probiotic bacteria in aquiculture[J]. Progress in Veterinary Medicine, 2008, 29(5): 94-99.
[4] 刘君, 宋晓玲, 陈志鑫. 益生菌对水产动物的作用研究进展[J]. 动物医学进展, 2009, 30(9): 78-81. Liu Jun, Song Xiaoling, Chen Zhixin. Progress on the function of probiotics in aquaculture[J]. Progress in Veterinary Medicine, 2009, 30(9): 78-81.
[5] 袁美丽, 李韶霞, 王宁. 5种外来入侵植物对小麦的化感作用[J]. 贵州农业科学, 2016, 44(12): 58-62.Yuan Meili, Li Shaoxia, Wang Ning. Allelopathic effects of five invasive plants species on wheat[J]. Guizhou Agricultural Sciences, 2016, 44(12): 58-62.
[6] 宋文娟, 张昊. 植物他感作用的研究进展[J]. 内蒙古林业科技, 2013, 39(1): 54-57. Song Wenjuan, Zhang Hao. Research progress on allopathy of plants[J]. Journal of Inner Mongolia Forestry Science and Technology, 2013, 39(1): 54-57.
[7] Rice E L. Allelopathy (2nd ed) [M]. New York: Academic Press Inc, 1984: 1-5, 309-315.
[8] 王鹏, 郭丽, 孔璐, 等. 碱浸提和纤维素酶辅助提取蓝莓多糖及其抗氧化能力的对比研究[J]. 粮食与油脂, 2017, 30(4): 94-97. Wang Peng, Guo Li, Kong Lu, et al. Comparison of antioxidant capacity of blueberry polysaccharide by alkali extraction and cellulose assisted treatment[J]. Cereals & Oils, 2017, 30(4): 94-97.
[9] 申莉莉, 王凤龙, 钱玉梅, 等. 解淀粉芽孢杆菌Ba33对烟草的促生及抗TMV作用[J]. 吉林农业大学学报, 2010, 32(4): 383-386. Shen Lili, Wang Fenglong, Qian Yumei, et al. Tobacco growth-promotion effect and TMV resistance ofBa33[J]. Journal of Jilin Agricultural University, 2010, 32(4): 383-386.
[10] Soad A Algam, Xie Guan lin, Li Bin. Comparat ive performance ofspp. in growth promotion and suppression of tomato bacterial wilt caused by[J]. Journal of Zhejiang University (Agriculture & Life Science), 2004, 30(6): 603-610.
[11] Murphy J F, Reddy M S, Ryu C M, et al. Rhizobacteria-Mediated growth promotion of tomato leads to protection against[J]. Phytopathology, 2003, 93: 1301-1307.
[12] Idriss E E, Makarew icz O, Farouk A, et al. Extracellular phytase activity ofFZB45 contributes to its plant growth promoting effect[J]. Microbiology, 2002, 148: 2097-2109.
[13] Felpeto A B, Śliwińska-Wilczewska, Sylwia, Klin M, et al. Temperature-dependent impacts of allopathy on growth, pigment, and lipid content between a subpolar strain ofsp. CCBA MA-01 and coexisting microalgae[J]. Hydrobiologia, 2019, 835: 117-128.
[14] 巨颖琳, 李小明. 南四湖3种沉水植物对铜绿微囊藻化感作用研究[J]. 山东大学学报(理学版), 2011, 46(3): 1-8. Ju Yinglin, Li Xiaoming. Allelopathic effects of three submerged macrophytes in the Nansi Lake on[J]. Journal of Shandong University (Natural Science), 2011, 46(3): 1-8.
[15] 张议文, 王江涛, 谭丽菊. 旋链角毛藻对中肋骨条藻化感作用的影响因素及化感物质性质初探[J]. 海洋学报, 2014, 36(2): 123-129. Zhang Yiwen, Wang Jangtao, Tan Liju. The study on the influencing factors ofallelopathic effect onthe primary research on the properties ofallelochemical[J]. Acta Oceanologica Sinica, 2014, 36(2): 123-129.
[16] 韩光耀, 谢丽玲, 毕潇, 等. 溶藻细菌DH-e代谢产物对东海原甲藻的抑制作用[J]. 应用海洋学学报, 2017, 36(2): 151-157.Han Guangyao, Xie Liling, Bi Xiao, et al. Inhibitory effect of metabolites from algicidal bacterium DH-e on[J]. Journal of Applied Oceanography, 2017, 36(2): 151-157.
[17] Zheng N N, Ding N, Gao P K, et al. Diverse algicidal bacteria associated with harmful bloom-formingin estuarine soil and seawater[J]. Science of the Total Environment, 2018, 631-632: 1415-1420.
[18] Wang B, Yang X R, Lu J, et al. A marine bacterium producing protein with algicidal activity against[J]. Harmful Algae, 2012, 13(1): 69-88.
[19] 曹海鹏, 卫若鹏, 何珊, 等. 水产养殖用解淀粉芽孢杆菌微胶囊的安全性评价[J]. 中国生物工程杂志, 2012, 32(5): 58-65. Cao Haipeng, Wei Ruopeng, He Shan, et al. Safety evaluation ofmicrocapsules used for aquaculture[J]. China Biotechnology, 2012, 32(5): 58-65.
[20] Cho H, Liu L, Liu K, et al. Phenotypic characterization and phylogenetic analysis of a virulentstrain from the Tiger frog,Wiegmann[J]. African Journal of Microbiology Research, 2010, 4(24): 2780-2786.
[21] 陈玉梅, 程茜. 益生菌的安全性[J]. 中国微生态学杂志, 2010, 22(9): 851-853. Chen Yumei, Cheng Xi. Safety of probiotics[J]. Chinese Journal of Microecology, 2010, 22(9): 851-853.
[22] Li Y, Lei XQ, Zhu H, et al. Chitinase producing bacteria with direct algicidal activity on marine diatoms[J]. Scientific Reports, 2016, 6(1): 21984.
[23] 焦彦凯, 严小军, 李小兵. 溶藻细菌及溶藻化合物研究进展[J]. 工业微生物, 2018, 48(4): 56-62. Jiao Yankai, Yan Xiaojun, Li Xiaobing. Advances in research of algicidal bacteria and algae-lysing compounds[J]. Industrial Microbiology, 2018, 48(4): 56-62.
[24] 许波. 一株芽孢杆菌溶藻活性物质的分离及其结构分析[D]. 湖北武汉: 武汉工业学院, 2012.Xu Bo. The separation and structure analysis of algicidal active substances in a strain of Bacillus[D]. Wuhan, Hubei Province: Wuhan Polytechnic University, 2012.
[25] Li J, Fergola P, Ma Z. Effects of allelochemicals produced by one population in a chemostat-like environment[J]. Journal of Theoretical Biology, 2011, 284(1), 99-105.
[26] 刘序, 张如义, 杨小建, 等. 核桃叶水浸液对萝卜种子萌发的化感作用[J]. 江苏农业科学, 2020, 48(3): 146-151. Liu Xu, Zhang Ruyi, Yang Xiaojian, et al. Allelopathic effect of water extracts from walnut leaves on seed germination of radish[J]. Jiangsu Agricultural Sciences, 2020, 48(3): 146-151.
[27] 常孟阳, 董静, 李晨露, 等. 菹草对小球藻和卵囊藻的形态化感效应研究[J]. 水生态学杂志, 2020, 41(2): 91-97. Chang Mengyang, Dong Jing, Li Chenlu, et al. Allelopathic effect of the macrophyteon colony formation ofandsp[J]. Journal of Hydroecology, 2020, 41(2): 91-97.
[28] Maruyama A, Maeda M, Simidu U. Distribution and classification of marine bacteria with the ability of cytokinin and auxin production[J]. Bulletin of Japanese Society of Microbial Ecology, 1990, 5(1): 1-8.
[29] Dimitrieva G Y, Crawford R L, Yüksel G U. The nature of plant growth-promoting effects of a pseudoalteromonad associated with the marine algaeand linked to catalase excretion[J]. Journal of Applied Microbiology, 2006, 100(5): 1159-1169.
[30] 沙俊涛, 陈青青, 缪雨静, 等. 茶树凋落叶浸提液对菘蓝生理生化的化感效应[J]. 核农学报, 2020, 34(6): 1327-1336. Sha Juntao, Chen Qingqing, Miu Yujing, et al. Allelopathic effect of leaf litter extracts ofon the physiology and biochemistry ofFort[J]. Journal of Nuclear Agricultural Sciences, 2020, 34(6): 1327-1336.
[31] 霍元子, 田千桃, 徐栅楠, 等. 浒苔对米氏凯伦藻生长的克生作用[J]. 海洋环境科学, 2010, 29(4): 496-499, 508. Huo Yuanzi, Tian Qiantao, Xu Shannan, et al. Allelopathic effects ofon growth of[J]. Marine Environmental Science, 2010, 29(4): 496-499, 508.
Allelopathic effect ofon the growth of
LI Xiao-ying1, CHEN Yi-hua2, ZHAO Yu-chao1, FENG Sen-lei1, LI Wen-qian1, ZHU Qiang1, DONG Zhi-guo1
(1. Jiangsu Key Laboratory of Marine Biotechnology, Jiangsu Ocean University, Lianyungang 222005, China; 2. Shang Hai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 200090, China)
To investigate the allelopathic effects ofand its metabolites on microalgae in the marine aquaculture environment, we studied the ecological functions ofon the growth ofby using experimental ecological methods. We used three combinations of,metabolites, and a mixture ofand its metabolites at different doses (100 μL, 500 μL, and 1000 μL) to study their effects on the cultivation of. The results showed that in the group with, the algae cell number ofgrew slowly in the first two days with no significant difference, but was lower than that in the control group (>0.05). In 3~4 days, the algal cell number of three groups with different doses was significantly lower than that of the control group (<0.05). In the group with metabolites of, the algal cell number of three groups with different doses had no significant difference with the control group, but it was significantly lower than that of the control group in 2~4 days (<0.05). In the group with the mixture ofand its metabolites, the growth of 100 μL group was slower than that of the other groups. The algae cell number of the 500 μL group and 1000 μL group showed a downward trend, and was significantly lower than that of the control group (<0.05). In the 1000 μL group, the mortality of 100% was achieved on the second day after treatment. In general, studies have shown that the algae cell number in each dose group showed a sequential decrease in,metabolites, and the mixture ofand its metabolites. Moreover, the algae cell number of 1000 μL group ofmetabolites was larger than that in the 500 μL group. The larger dose would indicate a fewer number of algae cells, thus showing a dose effect. The inhibition rates of,metabolites, and the mixture ofand its metabolites were 35.84%, 69.75%, and 100%, respectively. The study showed that the allelopathy ofonshowed an inhibition effect, which further showed a dose effect. This study provided a scientific basis for the evaluation of the effect ofin aquaculture. It also provided a new idea for the management of algae in the red tide.
;; allelopathic effect; growth performance
Jun. 6, 2020
Q789, S917
A
1000-3096(2021)01-0062-08
10.11759/hykx20200606001
2020-06-06;
2020-07-13
江苏省自然资源发展专项资金海洋科技创新项目(JSZRHYKJ202008);江苏省农业自主创新项目(CX(20)3150);国家贝类产业技术体系(CARS-49); 江苏省高等学校自然科学研究重大项目(18KJA240001); 江苏省渔业科技类项目(Y2018-27)
[Marine Science and Technology Innovation Project of Jiangsu Province Natural Resources Development Special Fund, No. JSZRHYKJ202008; The independent Agricultural Innovation Project of Jiangsu Province, No. CX(20)3150;Modern Agro-industry Technology Research System, No. CARS-49; the Natural Science Foundation of the Jiangsu Higher Education Institutions of China, No. 18KJA240001; Jiangsu Fisheries Science and Technology Project, Y2018-27]
李晓英(1975-), 女(汉族), 黑龙江海伦县人, 硕士, 实验师, 研究方向为水产种苗工程, E-mail: 327085439@qq.com; 董志国,通信作者, 教授, E-mail: dzg7712@163.com
(本文编辑: 赵卫红)

