多肽18F标记方法研究进展
杨鸿章,牟钊彪,李子婧
(厦门大学公共卫生学院,分子影像暨转化医学研究中心,福建厦门361102)
分子影像技术能反映机体组织、细胞及分子水平的代谢和功能状态变化,是疾病早期诊断的利器,可为个体化治疗提供指导,在新药研发领域也有着很好的应用前景[1-2].其中,正电子发射断层成像(PET)具有高灵敏度、无创、高穿透深度等优势,已广泛用于肿瘤、神经系统及心血管系统等疾病的诊断和研究.
表征特定生理功能或靶向病理标志物的正电子发射分子探针是PET成像的基础,通常由正电子发射核素和高亲和性的配体组成[3].在能够发射正电子的放射性核素中,氟-18(18F)具有优良的核素性质,适用于医学成像,如:1) 最大正电子能量(635 keV)较低,使得正电子湮没前在组织中穿行距离较短,从而提供较高分辨率的图像[4-5];2) 半衰期(109.8 min)适中,可避免受试者长时间照射,但仍满足标记化学、体内显像和远程配送的需求,广泛用于PET探针合成[6].
多肽作为靶向特定受体的优良配体,因具有多种优势而受到广泛的关注:1) 特异性高,组织穿透能力强;2) 分子量低,有利于多肽从血液和非靶组织中被快速清除,使得显像有较高的靶与非靶比值;3) 由于生物同源性,多肽一般不具有免疫原性,安全性较高[7].因此,如何用放射性核素标记种类繁多的多肽进而制备多肽探针,逐渐成为疾病精准诊断和个性化治疗领域的研究热点.目前,放射性标记多肽主要通过99mTc、68Ga和177Lu等放射性金属标记,但螯合基团相对庞大可能影响多肽的靶向性,不适用于多肽放射性标记[8-10].近年来报道了许多新型18F标记多肽的方法,并在温和标记方面有重要发展.根据标记过程的复杂程度可系统地分为一步标记法、多步标记法和固相标记法.本文将分别对这些标记方法进行阐述.
1 一步18F标记多肽策略
1.1 基于生成C—18F键的一步标记方法
基于生成C—18F键的一步18F标记法按机理可分为亲电取代反应、亲核取代反应和自由基反应.其中,基于生成C—18F键的亲电取代和亲核取代反应已被广泛应用于小分子标记,但标记条件较苛刻,且多肽对高温、有机溶剂、强酸等反应条件较敏感,因此相关报道相对较少;而近年来开发的基于C—18F键生成的自由基反应,标记条件较温和,区域选择性好,应用前景广阔.
1.1.1 基于芳香环亲电反应的一步18F标记多肽方法
2003年,Ogawa等[11]利用氟乙酰亲电取代的方式,在水相室温条件下成功实现了西仑吉肽c(RGDfMeV)的一步18F标记(图1).该标记方法对多肽结构改变较小,因此对多肽活性影响较小,但反应需要在三氟乙酸溶液中进行,不适合pH敏感的多肽18F标记.此外,该反应的化学选择性较差,在没有定位基团的情况下可出现多个标记产物,且比活度较低(3.28×10-2GBq/μmol),不适用于对比活度要求较高的受体显像.
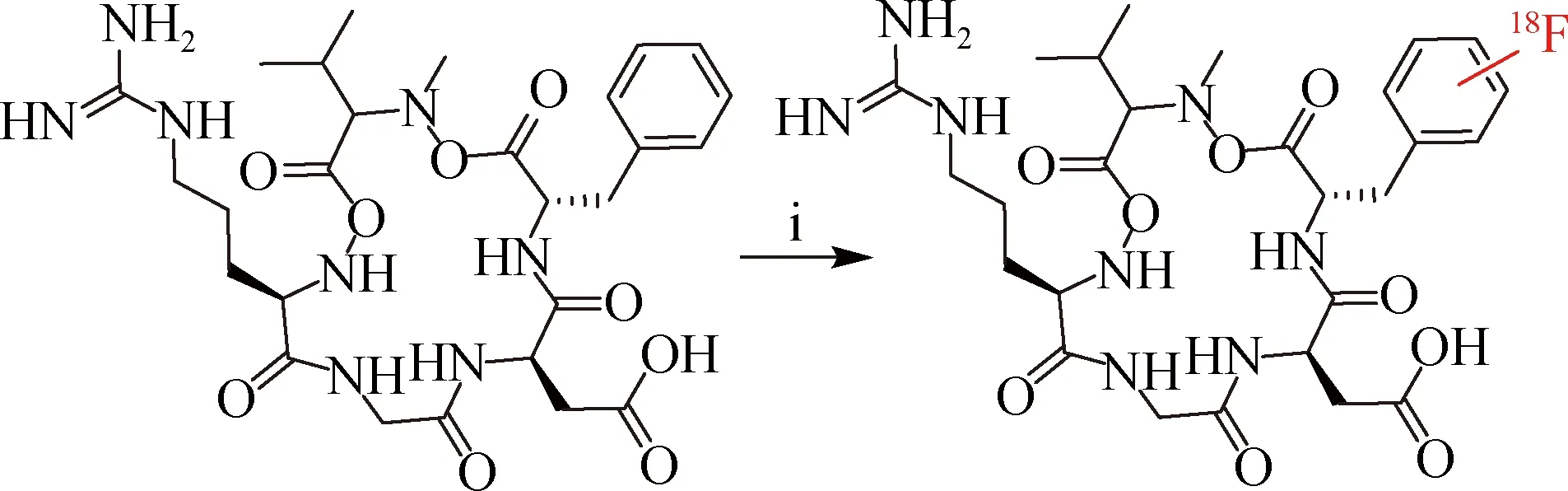
(i)[18F]AcOF,三氟乙酸,乙腈,室温.图1 基于芳香环亲电反应的一步18F标记多肽Fig.1One-step 18F-labeling of peptides based on aromatic ring electrophilic reaction
1.1.2 基于亲核反应的一步18F标记多肽方法

(i)[18F]KF,DMSO,50 ℃,15 min[12];(ii)[18F]KF,DMSO,130 ℃,3.5 min[13].图2 基于亲核反应的一步18F标记多肽Fig.2One-step 18F-labeling of peptides based on nucleophilic reaction
[18F]F-的芳香亲核取代反应(SNAr)是直接形成C(sp2)—18F键常用的标记方法,前体通常包含离去基团,并在离去基团的对位或邻位带有活化基团(通常为强吸电子基团).Becaud等[12]以三甲基铵作为离去基团、二甲基亚砜(DMSO)为反应溶剂,在50 ℃下反应15 min,通过[18F]F-的SNAr实现了多肽的一步18F 标记(图2(a)),经放射性高效液相色谱(radio-HPLC)测定放射化学产率(RCY)为19%~92%.Jacobson等[13]通过4-硝基-3-三氟甲基苯甲酰氯与环肽c(RGDfK)和二聚RGD肽E[c(RGDfK)]2偶联,利用微波反应在DMSO溶剂中130 ℃下加热反应3.5 min,实现了以硝基为离去基团的多肽一步18F标记(图2(b)),其RCY为7%~23%.基于SNAr的一步18F标记往往需要在无水、高温和有机溶剂等苛刻的条件下进行,因此不适用于敏感多肽的标记.
1.1.3 基于自由基反应的一步18F标记多肽方法

(i)[18F]NFSI,NaDT,乙腈,水,室温,40 min.图3 基于自由基反应的一步18F标记多肽Fig.3One-step 18F-labeling of peptides based on free radical reaction
2018年Yuan等[14]报道了在紫外光(365 nm)照射下,以十聚钨酸钠(NaDT)为催化剂、[18F]N-氟苯磺酰亚胺([18F]NFSI)为放射性氟源,进行含亮氨酸多肽的18F标记(图3),其RCY为16%~35%.亮氨酸残基中的异丙基在光照及催化条件下倾向于生成稳定的三级碳自由基,在链转移过程中结合[18F]NFSI中的18F 得到标记产物.该方法标记可以耐受水相介质,反应条件较温和,区域选择性好,其多肽中氨基、羧基等活性基团不需要提前保护,不需要借助标记辅助基团,对多肽结构改变较小;但这种标记方法只适用于含有亮氨酸的多肽,且反应时间相对较长,比活度较低(1.3×10-3~5.3×10-3GBq/μmol),不适用于对比活度要求较高的受体显像.
1.2 基于生成Si—18F键的一步标记方法
与C—F键的键能(480 kJ/mol)相比,Si—F键的键能(>570 kJ/mol)更高、更稳定,于是基于生成Si—18F键的标记方法引起了广泛关注.1985年,Rosenthal等[15]将Si—18F键引入到标记化学中,在乙腈水溶液(V乙腈∶V水=13∶7)中,[18F]四甲基氟化铵与三甲基氯硅烷反应得到[18F]三甲基氟硅烷,经过衰减校正后产率为80%;大鼠吸入[18F]三甲基氟硅烷后,骨骼中有明显的氟离子富集,表明[18F]三甲基氟硅烷在体内稳定性较差,该研究首次证明了在含水介质亦可形成Si—18F键,打开了温和18F 标记的大门.之后,Höhne等[16-17]通过密度泛函理论建立了有机氟硅烷水解的理论模型,发现通过增加围绕硅原子的空间位阻能提高Si—18F键的稳定性;以DMSO为反应溶剂、羟基或氢为离去基团,在30~90 ℃条件下经[18F]F-亲核取代反应合成了含有双功能官能团18F标记的有机氟硅烷,RCY为25%~90%,并将其进一步与蛙皮素肽偶联,实现了多肽的18F标记.该法标记的多肽在体内外均有较好的稳定性,首次实现了基于生成Si—18F键的多肽18F标记,但需通过两步实现且标记条件相对苛刻.Schirrmacher等[18]以叔丁基大位阻保护的叔丁基氟硅烷(SiFA)和奥曲肽通过肟键相连形成的“SiFA-多肽”作为标记前体,通过18F/19F同位素交换法在无水乙腈中室温下反应15 min,实现了SiFA-多肽的一步18F标记(图4),RCY为95%~97%;但当乙腈水溶液(V乙腈∶V水=1∶4)作为反应溶剂,该反应在室温下RCY仅为5%,而在95 ℃下RCY高达70%~90%.该方法需要过量的标记前体才能获得较高的RCY,而标记产物无法通过化学方法与前体分离,因此比活度较低.
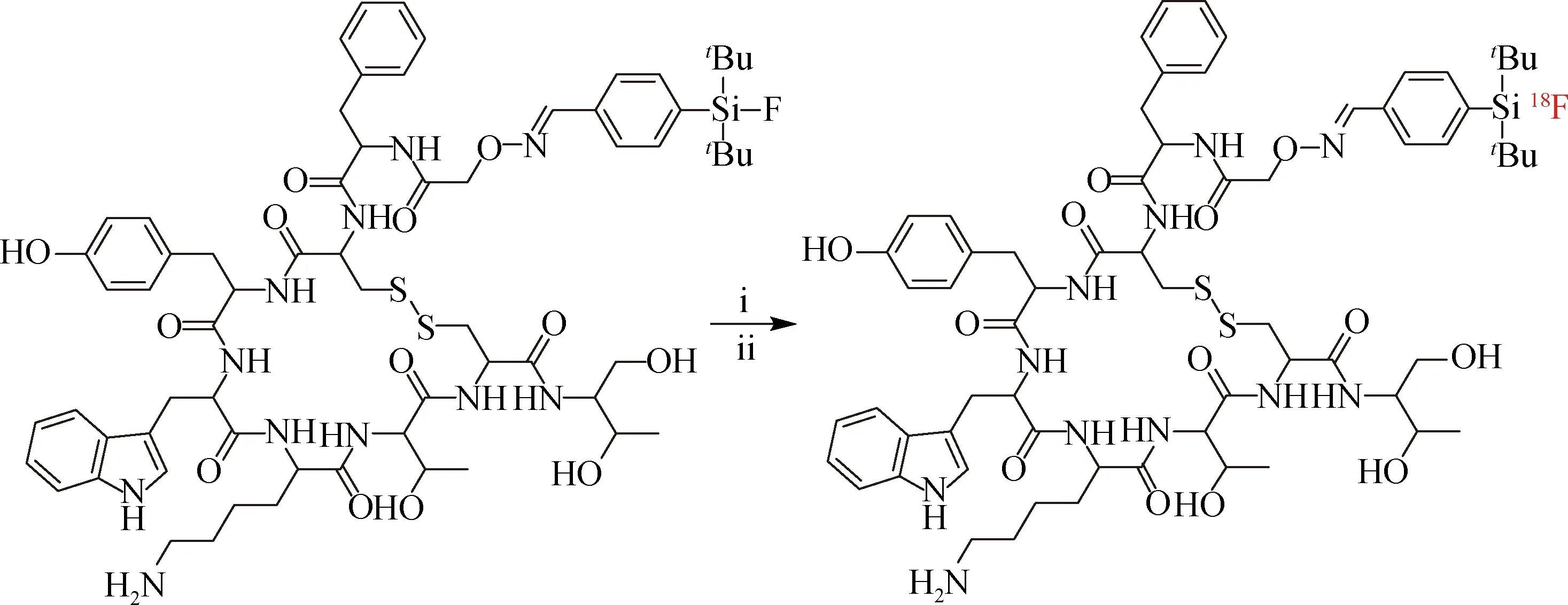
(i)[18F]KF,乙腈,室温,10~15 min;(ii)[18F]KF,乙腈,水,95 ℃,30 min.图4 基于Si—18F键的一步18F标记多肽Fig.4One-step 18F-labeled peptides based on Si—18F bond
Si—F键的水解是该结构固有的问题,但可以使用大位阻保护的方法来适当提高体内Si—18F键的稳定性,从而达到PET显像的要求.总之,Si—F键为实现在部分水相溶剂中进行多肽的一步18F标记提供了一种可行策略.
1.3 基于生成B—18F键的一步标记方法
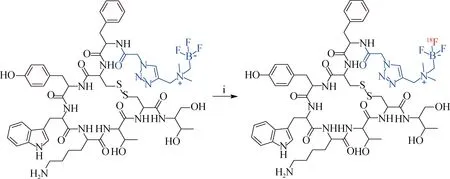
B—F键(键能>730 kJ/mol)是已知热力学最稳定的共价键之一.Ting等[19]以三氟硼酸盐为标记前体,利用同位素交换法获得[18F]芳基三氟硼酸盐,通过在芳基环上引入吸电子基团或利用缺电子杂环取代苯环[18F]芳基三氟硼酸盐的其提高水解稳定性.该方法的最大优点是能够在水相介质中进行一步18F标记,从而避免了耗时且相对复杂的氟离子共沸干燥步骤.Liu等[20]设计出一系列三氟硼酸盐共轭物作为放射性药物标记前体,以pH=2.0的50%(体积分数)二甲基甲酰胺(DMF)水溶液为反应溶剂,在45 ℃的条件下反应15 min(图5),实现了环肽c(RGD)等多肽的一步18F标记[21].
(i)[18F]KF,DMF,水,45 ℃,15 min.图5 [18F]芳基三氟硼酸盐标记多肽的合成路线Fig.5Synthetic route of [18F]aryl trifluoroborate labeled peptides
(i)[18F]KF,DMF,水,80 ℃,12 min.图6 [18F]烷基氨甲基三氟硼酸盐标记多肽的合成路线Fig.6Synthetic route of [18F]AMBF3 labeled peptides
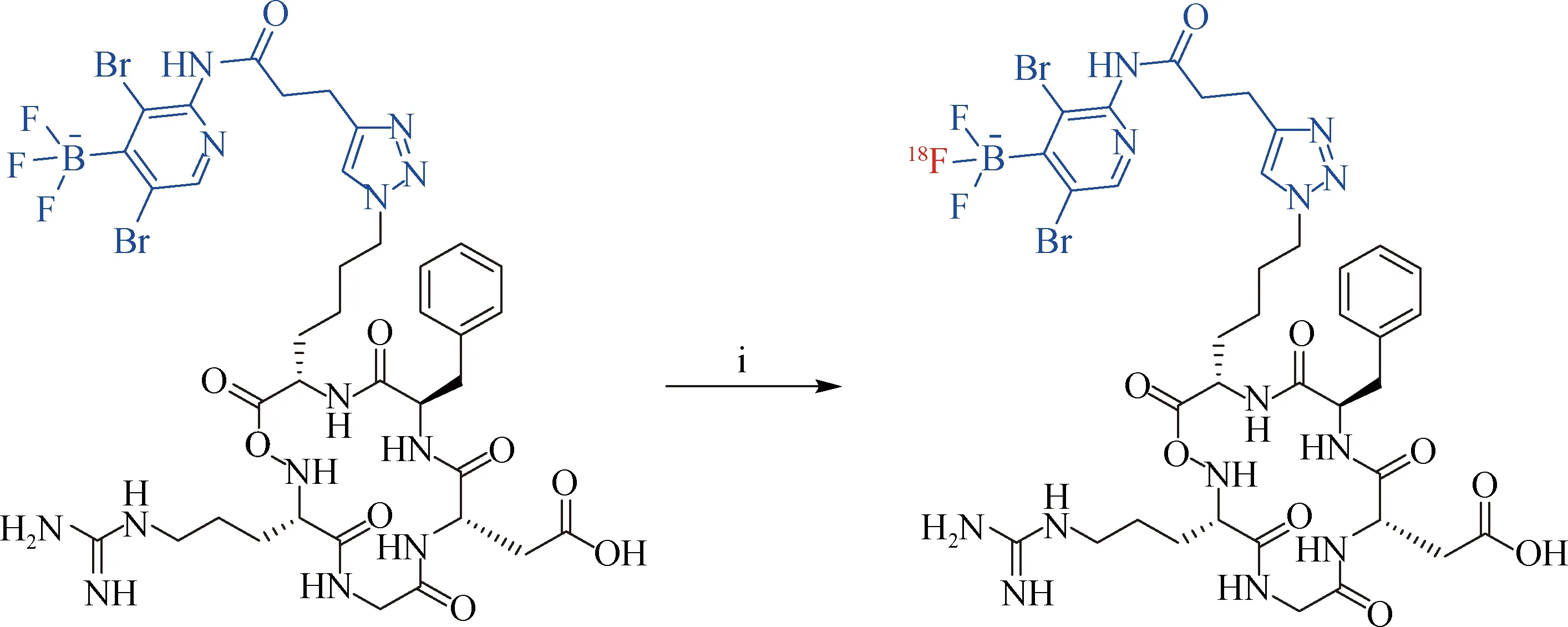
尽管基于生成B—18F键的一步标记方法获得了初步成功,但标记多肽的稳定性有限,在体外仍会缓慢水解(脱氟).Liu等[21]用烷基氨甲基三氟硼酸盐(AMBF3)基团代替芳基三氟硼酸盐,改善了B—F键的体内稳定性并优化了反应条件.以AMBF3修饰的奥曲肽为前体,利用无载体添加的[18F]KF在pH=2.0的DMF/水溶液中加热80 ℃反应12 min,通过18F/19F同位素交换法实现了多肽的18F标记(图6),经C18柱纯化后RCY为20%~25%,比活度为111 GBq/μmol,且[18F]AMBF3标记的奥曲肽在体外和体内实验中均显示出较高稳定性,具有广阔的应用前景.
1.4 基于生成Al—18F键的一步标记法
氟离子可以与众多金属阳离子形成较强的配位键,与Al3+的相互作用(>670 kJ/mol)比大多数金属强.在水相条件下,金属氟化物能与螯合基团配位,因此有望利用[18F]AlF2+与螯合基团修饰的多肽螯合,实现多肽的一步18F标记(图7).

图7 放射性合成含[18F]AlF2+-多肽偶联物的一般方法Fig.7General methodology for the radiosynthesis of [18F]AlF2+-peptides conjugates
利用这种标记策略,二亚乙基三胺五乙酸(DTPA)-、1,4,7-三氮杂环壬烷-1,4,7-三乙酸(NOTA)-、S-2-(4-异硫氰酸根合苄基)-1,4,7-三氮杂环壬烷-1,4,7-三乙酸(p-SCN-Bn-NOTA)-、1,4,7-三氮杂环壬烷-1,4-二乙酸酯(NODA)-和(±)H3RESCA-肽缀合物(图8)均通过与[18F]AlF2+配位进行了放射性标记.

图8 常用的[18F]AlF2+螯合基团Fig.8Commonly used [18F]AlF2+ chelating groups
[18F]AlF2+-DTPA-多肽在血清中表现出较差的稳定性(脱氟),而[18F]AlF2+-NOTA-多肽在37 ℃的血清中4 h内表现出较好的体外稳定性.[18F]AlF2+-NOTA-多肽在LS174T荷瘤裸鼠体内也表现出较好的稳定性.此外,在注射放射性药物30 min后分析裸鼠的尿液,结果表明[18F]AlF2+-NOTA-肽缀合物主要以原药形式存在,这种稳定性的差别是由于[18F]AlF2+-NOTA的结构刚性明显强于[18F]AlF2+-DTPA;在NOTA结构的基础上通过在大环上修饰苄基,得到S-2-(4-异硫氰酸根合苄基)-1,4,7-三氮杂环壬烷-1,4,7-三乙酸,可阻止NOTA和[18F]AlF2+螯合后结构的翻转,一定程度上增加了结构刚性,从而使得络合物的水解常数降低一个数量级,并阻止了螯合基团与其他竞争性金属离子的络合[22].Mcbride等[23]通过p-SCN-Bn-NOTA与多肽偶联得到IMP449(NOTA-p-Bn-CS-D-Ala-D-Lys(HSG)-D-Tyr-D-Lys(HSG)-NH2),以pH=4.0的乙酸钠缓冲液为溶剂,在100 ℃条件下反应15 min获得Al18F-IMP449.pH值对AlF2+-螯合物的合成极为重要,高pH值会形成不溶性氢氧化铝,低pH值则会导致[18F]F-质子化而阻止氟离子与铝原子配位,最佳的pH值约为4.0.[18F]AlF2+-NOTA-多肽与[18F]AlF2+-NODA-多肽的合成大致相同,但在相同条件下[18F]AlF2+-NODA-多肽的RCY更高.2012年,Mcbride等[24]实现了NODA-甲基苯基乙酸(MPAA)-di-HSG(组胺-琥珀酰-甘氨酸)半抗原肽的标记试剂盒化,以乙醇/生理盐水(体积比1∶1)为溶剂,在108 ℃下反应15 min后用Alumina N柱纯化,标记产物的RCY为45.6%.
基于生成Al—18F键的多肽一步标记方法取得了较大的进展,并逐渐试剂盒化.美中不足的是,铝螯合步骤需要在高温条件下(100 ℃)进行,不利于对温度敏感的多肽标记.Cleeren等[25]以(±)H3RESCA作为[18F]AlF2+的新型螯合基团,通过适当减小螯合基团的结构刚性优化[18F]AlF2+与配体螯合的标记条件,在室温下反应35 min内实现了人血清白蛋白、NbV4m119、纳米抗体等生物分子的18F一步标记和纯化,且获得了较满意的RCY(35%~63%).
1.5 基于P—18F键的一步标记法
P—F键的键能(490 kJ/mol)与C—F键的相近,因此在体内外可能具有较好的稳定性.此外,氟化碳、氟化硼和氟化硅和氟化磷的自由基生成热能分别为(255.0±8.4)kJ/mol、(-115.8±13.8)kJ/mol、(-20.1±12.5)kJ/mol和(-52.3±20.9)kJ/mol,说明磷氟化物、硅氟化物、硼氟化物比碳氟化物更容易形成.Studenov等[26]首次利用磷酰氯和[18F]F-在室温条件下通过SNAr将P—18F键引入18F标记化学中,反应5 min后,其RCY可达96%(图9(a));但该化合物在体外的稳定性较差,在水溶液中30 min便出现明显分解(脱氟).Vabre等[27]以N-杂环卡宾-王氟化磷([18F]NHC-PF5)为标记前体,在路易斯酸SnCl4催化的条件下,通过18F/19F同位素交换法与[18F]F-在60 ℃反应10 min,成功标记了[18F]NHC-PF5(图9(b)),但RCY仅为4%~6%.虽然[18F]NHC-PF5在体内外具有较好的稳定性,但是该标记方法的RCY太低,不适合临床应用.2019年,Hong等[28]设计了以氟代氧化膦(DBPOF)作为氟受体的18F标记方法,通过大位阻保护策略提高P—F键在体内外的稳定性,将DBPOF与生物分子如c(RGDyK)和人血清白蛋白(HAS)偶联后,首次在室温、中性纯水相的条件下,通过18F/19F同位素交换法实现了温和的多肽一步18F标记(图9(c)),RCY高达(50±5)%.该标记方法解决了对溶剂、温度、pH敏感的多肽一步18F标记,但由于标记采取同位素交换法,其比活度较低(0.22~0.37 GBq/μmol),往往需要使用较高比活度的[18F]F-才能满足受体成像要求(37 GBq/μmol).

(i)[18F]KF,乙腈,室温,5 min[26];(ii)[18F]四丁基氯化铵(TBAF),SnCl4,60 ℃,10 min[27];(iii)[18F]KF,水,DMSO,室温,25 min[28].图9 基于P—18F键多肽的一步18F标记Fig.9One-step 18F-labeling of peptides based on P—18F bond
2 多步18F标记多肽策略
多步18F标记多肽方法通常先对结构相对简单的标记辅助基团进行18F标记,再在温和条件下与多肽进行偶联,利用HPLC或固相萃取(SPE)分离未标记的多肽和副产物,使得18F标记的多肽具有较高的放射化学纯度和比活度.
已开发的此种标记辅助基团大致可分为5类:1) 以羧基活化酯为基础的胺反应性标记辅助基团,2) 以醛基为基础的氨氧基或联氨基反应性标记辅助基团,3) 以马来酰亚胺或六氟苯为基础的巯基反应性标记辅助基团,4) 通过“点击化学”实现叠氮或炔基修饰多肽的18F标记辅助基团,5) 基于三氟甲基化的多肽18F标记辅助基团.多步18F标记方法可避免将多肽直接暴露于苛刻的标记条件下,实现了多肽的温和标记.
2.1 基于胺反应性标记辅助基团的多步标记方法
羧基活化酯主要有4-硝基苯基2-[18F]氟丙酸酯([18F]NFP)、2,4-二硝基苯基2-[18F]氟丙酸酯、[18F]2,3,5,6-四氟苯基6-氟烟酸酯([18F]F-Py-TFP)、[18F]氟苯甲酸酯-琥珀酰亚胺基([18F]SFB)、[18F]N-琥珀酰亚胺基4-氟甲基苯甲酸酯([18F]SFMB)和[18F]N-琥珀酰亚胺8-[(4′-氟苄基)氨基]辛酸酯(SFBS)等(图10)可用于多肽偶联.2,4-二硝基苯基2-[18F] 氟丙酸酯因易爆炸而较少使用[29-30],胺反应性羧基活化酯标记辅助基团以[18F]NFP、[18F]SFB、[18F]F-Py-TFP为主,广泛应用于18F标记多肽的合成.
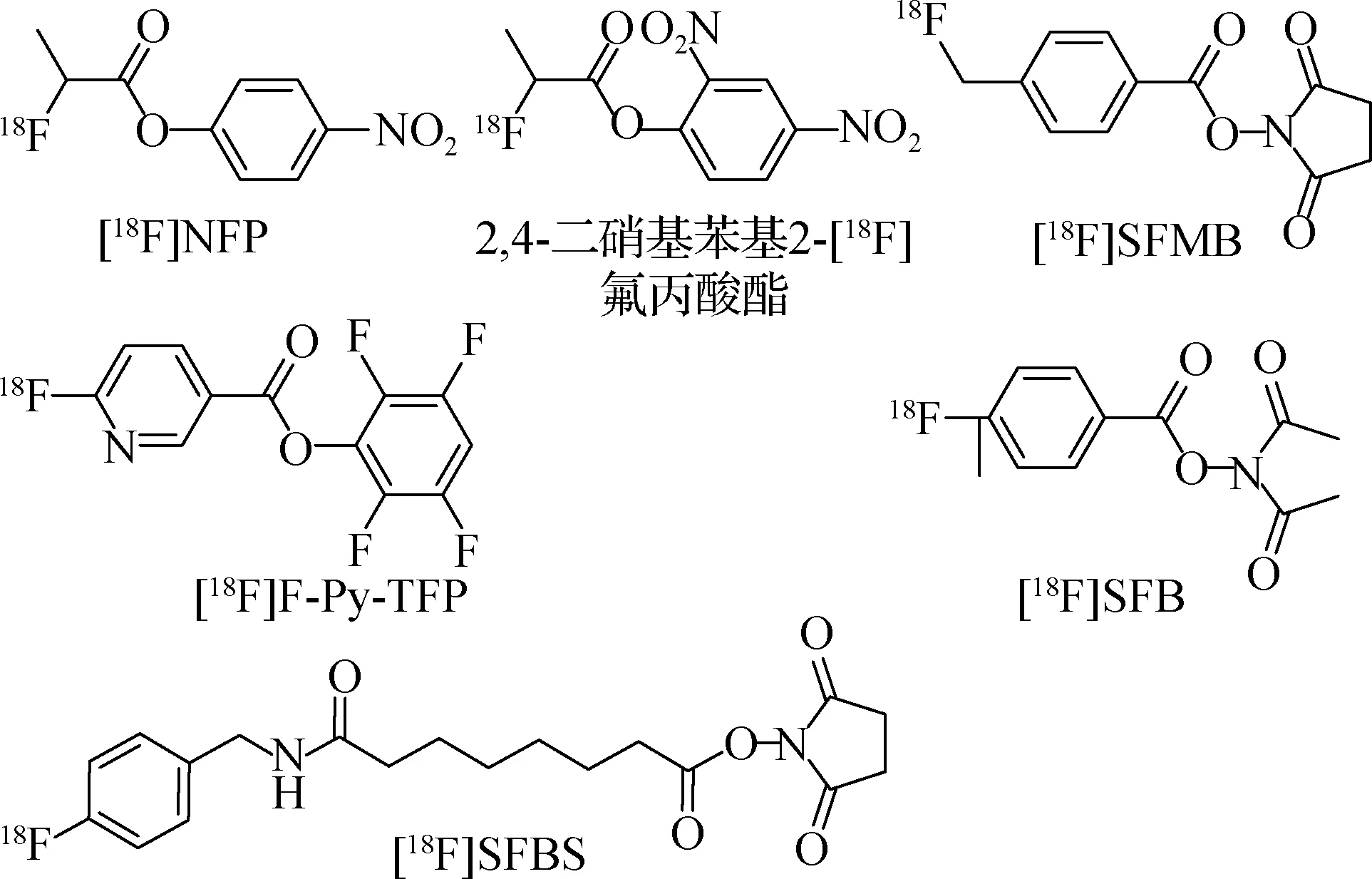
图10 活化羧基18F标记辅助基因结构Fig.10Auxiliary group structure of 18F-labeled activated esters
Haubner等[31]利用[18F]NFP以DMSO为反应溶剂在70 ℃下与c(RGD-D18F]NFP偶联,RCY约为50%.与[18F]NFP相比,辅基[18F]SFB的特征是芳香族[18F]氟苯甲酰基残基,[18F]SFB优先与肽主链中存在的伯胺偶联.Vaidyanathan等[32]于1992年首次报道了[18F]SFB的合成,即以三甲酸酯4-甲酰基-N,N,N-三甲基苯胺为标记前体进行18F标记,再氧化形成4-[18F]氟苯甲酸,随后在缩合剂二环己基碳二亚胺(DCC)存在条件下,与N-羟基琥珀酰亚胺反应生成[18F]SFB,总合成时间为100 min,RCY约为25%.Thonon等[33]通过[18F]SFB实现了PEG-E[c(RGDyK)]2的自动化合成,总合成时间约为130 min,RCY为(13±3)%,经纯化后放射化学纯度达98%以上,比活度为(140±40) GBq/μmol.Kapty等[34]利用[18F]SFB以混合溶液(V乙腈∶V柯耳蜀夫缓冲液=1∶3,pH=8.4)为反应液,在40 ℃的条件下反应40 min,实现了[18F]SFB与LIKKPF多肽的偶联,RCY约为75%.[18F]SFB是目前最重要且常用的18F标记多肽的标记辅助基团.
Basuli等[30]通过N,N,N-三甲基-5-((2,3,5,6-四氟苯氧基)羰基)吡啶-2-铵三氟甲磺酸盐的[18F]TBAF亲核取代,在40 ℃下搅拌10 min获得[18F]F-Py-TFP,RCY为(50±10)%;以磷酸盐缓冲液(pH=9.0)为反应溶剂,在40 ℃下反应15 min实现了[18F]F-Py-TFP与HSA偶联,RCY高达97%.
基于羧基活化酯标记辅助基团的多步18F标记多肽的反应条件比较温和,偶联过程可在水相室温条件下进行,但反应步骤过多且总RCY较低.近年来,随着标记辅助基团总RCY的明显提高和多肽标记步骤的逐渐简化,该方法有望广泛应用于多肽温和标记.
2.2 基于醛基辅助基团的多步标记方法
醛基与氨氧基和联氨基具有较高的反应活性,因此含醛基的标记辅助基团可用于氨氧基和联氨基修饰多肽的18F标记,其中[18F]对氟苯甲醛([18F]FBA)和[18F]氟代脱氧葡萄糖([18F]FDG)应用最广泛.

(i)[18F]F-,DMSO,60 ℃,15 min;(ii)三氟乙酸,甲醇,水,60 ℃,15 min.图11 [18F]FB-CHO标记多肽的合成路线Fig.11Synthetic route of [18F]FB-CHO labeled peptides
Poethko等[35]以[18F]对氟苯甲醛为标记辅助基团在混合溶液(V甲醇∶V水=4∶1)中通过三氟乙酸调节pH至2.5,反应15 min实现了氨基氧乙酸修饰的小胃泌素、RGD和奥曲肽的18F标记(图11).该标记方法对pH、温度和多肽浓度有明显的依赖性,60 ℃下反应15 min且多肽浓度大于0.5 mmol/L为最佳标记条件,RCY可达80%以上.
Hultsch等[36]利用[18F]FDG在130 ℃、pH=2.5条件下实现了与氨氧基修饰的c(RGD)偶联(图12),RCY为56%~93%.另外,除了[18F]FDG获取相对容易、标记步骤简单外,多肽与[18F]FDG偶联后有利于增强多肽的水溶性,可改善其体内的药代动力学特征[37].

(i)[18F]FDG,三氟乙酸,DMSO,水,130 ℃,20 min.图12 [18F]FDG标记多肽的合成路线Fig.12Synthetic route of [18F]FDG labeled peptides
基于醛基辅助基团的多步法对多肽进行18F标记,其反应选择性高,副反应较少,但需要对多肽进行氨氧基或联氨基提前修饰,并且反应具有pH依赖性,需在酸性溶液(pH=2.5)中进行,不适用于对酸敏感的多肽标记.
2.3 基于巯基反应性标记辅助基团的多步标记方法
巯基-迈克尔加成反应具有反应条件温和、反应迅速、化学选择性高等优势,因此研究者开发了一系列基于马来酰亚胺的巯基反应性标记辅助基团的18F标记,如N-[6-(4-[18F]氟-亚苄基)氨基氧基己基]马来酰亚胺([18F]FBAM)、N-[2-(4-[18F]氟苯甲酰胺基)乙基]马来酰亚胺([18F]FBEM)和[18F]FDG-马来酰亚胺己基肟([18F]FDG-MHO)等,以解决多肽的化学选择性标记.
Berndt等[38]利用[18F]对氟苯甲醛与N-(6-氨基羟己基)马来酰亚胺反应得到[18F]FBAM(图13),RCY约为29%.将[18F]FBAM溶解在少量乙醇中,加入含有还原型谷胱甘肽(GSH,质量浓度为0.01~1.0 mg/mL)或低密度脂蛋白(质量浓度为1.006~1.063 mg/mL)的磷酸盐缓冲液(PBS,pH=7.2)中,在室温条件下反应20 min,RCY大于95%.

(i)[18F]F-,DMF,120 ℃,15 min;(ii)MeOH, HCl,50 ℃,15 min;(iii)GSH,PBS,20 ℃,5 min.图13[18F]FBAM合成子的合成路线Fig.13Synthetic route of [18F]FBAM synthon

(i)[18F]KF,乙腈,90 ℃,20 min;(ii)NaOH,乙腈,120 ℃,3 min;(iii)HSTU,乙腈,120 ℃,5 min;(iv)N-(2-氨基乙基)马来酰亚胺,DIPEA,乙腈,40 ℃,20 min;(v)[18F]KF,乙腈,120 ℃,10 min;(vi)三氟乙酸,PBS,20 ℃,10 min;(vii)N-(2-氨基乙基)马来酰亚胺,氰基膦酸二乙酯,二异丙基乙胺,乙腈,75 ℃,7 min.图14 [18F]FBEM合成子的合成路线Fig.14Synthetic route of [18F]FBEM synthon
Cai等[39]通过[18F]SFB与N-(2-氨基乙基)马来酰亚胺偶联获得[18F]FBEM(图14(a)),反应总时间为(150±20) min,RCY为(5±2)%,比活度为150~200 GBq/μmol.在三(2-羧乙基)膦盐酸盐(TCEP·HCl)存在的条件下,[18F]FBEM与巯基-RGD在PBS中室温下孵育20 min,经HPLC纯化后获得[18F]FBEM-SRGD,未经衰减校正的RCY约为80%.[18F]FBEM合成步骤过多,反应时间过长且产率较低,不适合临床研究应用.Kiesewetter等[40]改进了合成方法,经三步反应获得[18F]FBEM,提高了RCY,缩短了反应时间.该反应以五甲基苄基4-(N,N,N-三甲基铵)苯甲酸酯三氟甲磺酸盐为标记前体,通过[18F]F-亲核取代反应获得五甲基苄基4-[18F]氟苯甲酸酯,将其在酸性条件下水解得4-[18F]氟苯甲酸,最后在二乙基氰基磷酸酯和二异丙基乙胺存在条件下4-[18F]氟苯甲酸与N-(2-氨基乙基)马来酰亚胺偶联(图14(b)),经过HPLC分离纯化后,在约95 min内获得[18F]FBEM,RCY为(17.3±7.1)%.
Wuest等[41]利用[18F]FDG标记蛋白和多肽,在100 ℃加热15 min条件下将[18F]FDG转化为[18F]FDG-马来酰亚胺己基肟([18F]FDG-MHO),经HPLC纯化后RCY为45%~69%.以PBS为反应溶剂在20 ℃ 条件下反应10 min,实现[18F]FDG-MHO与GSH和anxA5偶联(图15),RCY约为92%.

(i)[18F]FDG,乙醇,水,100 ℃,15 min;(ii)GSH,PBS,20 ℃,10 min.图15 [18F]FDG-MHO标记多肽的合成路线Fig.15Synthetic route of [18F]FDG-MHO labeled peptides
2013年,Spokoyny等[42]报道了以六氟苯(HFB)钉合肽/小蛋白的策略,即HFB通过1,4-二取代与巯基反应.2015年,Jacobson等[43]利用该方法通过两步法实现了生物分子的18F标记,在室温下以DMSO为反应溶剂,使用[18F]F-通过氟交换以(25±3)%的RCY制备得[18F]HFB.以DMF为反应溶剂在过量的三羟甲基氨基甲烷(TRIS,24当量)和过量的还原剂三(2-羧乙基)膦盐酸盐,2.5当量)条件下,1当量的[18/19F]HFB与2当量的硫醇化c(RGDfK)在室温下反应20~25 min实现偶联(图16),RCY为(40±2)%.HFB与生物分子的钉合具有较好的选择性且产物较为稳定,此外不需要对生物分子进行提前修饰和保护.
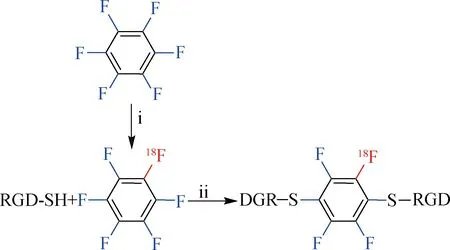
(i)[18F]F-,DMSO,室温,15 min;(ii)TRIS,TCEP,DMF,20 ℃,20~25 min.图16[18F]HFB标记多肽的合成路线Fig.16Synthetic route of [18F]HFB labeled peptides
基于巯基反应性标记辅助基团的多肽多步18F标记反应条件温和,可在中性或偏碱性(pH=7.0~8.0)水溶液中进行,化学选择性较好,多肽用量少,偶联效率高,并且天然的多肽和蛋白中往往含有半胱氨酸残基,通常不需要对多肽和蛋白进行基团修饰.然而,基于马来酰亚胺的巯基反应性标记辅助基团与多肽偶联时,由于存在竞争性的反迈克尔加成和巯基交换反应,其偶联产物在体内或含有巯基的体系中稳定性有限,限制了该方法的应用.
2.4 基于“点击化学”的多步标记方法
“点击化学”是2001年由Sharpless引入的概念,即通过1,3-偶极Huisgen环加成反应,其特征是通过炔烃与叠氮化物利用Cu(Ⅰ)催化反应形成三唑[44].在过去的10年中,“点击化学”已成为放射性药物化学中一个强大合成方法[45-46].最初Cu(Ⅰ)催化剂是通过CuSO4(Ⅱ)原位还原生成,后来直接使用Cu(Ⅰ)盐,如CuI或CuBr.该反应具有在水相中反应快速、化学和区域选择性高等优势,已广泛应用于多肽的放射性标记.2006年,Marik等[47]在放射性药物领域率先提出了这一反应,通过ω-[18F]氟炔烃与叠氮丙酸修饰的模型肽,在10 min内以55%~99%的RCY实现了Cu(Ⅰ)介导的“点击化学”反应[46].2011年,Gill等[48]设计和合成了[18F]F-PEG3-叠氮化物,以Cu(Ⅰ)作为催化剂、双菲咯啉二磺酸盐(BPDS)作为亚铜螯合配体,在60 ℃条件下与炔基修饰多肽反应10 min,实现了炔基修饰多肽与[18F]F-PEG3-叠氮化物的偶联(图17),且RCY为(62±4)%.与ω-[18F]氟炔烃相比,18F-PEG3-叠氮化物不易挥发,有利于产物的后处理,并且通过PEG修饰后可改善多肽的药代动力学特征,有利于体内成像研究.

(i)[18F]F-,TBAHCO3,乙腈,100 ℃,10 min;(ii) 炔基修饰的多肽,CuSO4,BPDS,抗坏血酸钠,100 ℃,10 min.图17 [18F]F-PEG3-叠氮化物标记多肽的合成路线Fig.17Synthetic route of [18F]F-PEG3-azide labeled peptides
2009年,Maschauer等[49]以1,3,4,6-四-O-乙酰基-2-O-三氟甲基磺酰基-β-D-甘露吡喃糖基叠氮化物为标记前体,在85 ℃下与[18F]F-反应15 min后,通过NaOH脱保护得到[18F]2-脱氧-2-氟-甘露吡喃糖基叠氮化物,RCY为(71±10)%.以CuSO4作为铜源、抗坏血酸钠作为还原剂、水和叔丁醇的混合溶液作为反应液,在60 ℃下[18F]2-脱氧-2-氟-β-D-甘露吡喃糖基叠氮化物与炔基修饰的多肽反应10 min,实现了[18F]2-脱氧-2-氟-β-D-甘露吡喃糖基叠氮化物与炔基修饰多肽的偶联(图18),RCY>90%.由于甘露糖具有较好的亲水性,因此多肽与[18F]2-脱氧-2-氟-β-D-甘露吡喃糖基叠氮化物偶联后有利于增强多肽的水溶性,可改善其体内的药代动力学特征.

(i)1) [18F]F-,乙腈,85 ℃,15 min,2) NaOH,60 ℃,55 min;(ii) 炔基修饰的多肽,CuSO4,抗坏血酸钠,60 ℃,10 min.图18 [18F]2-脱氧-2-氟-β-D-甘露吡喃糖基叠氮化物标记多肽的合成路线Fig.18Synthetic route of [18F]2-deoxy-2-fluoro-β-D-glucopyranosyl azide labeled peptides
Ramenda等[50]通过引入芳香族18F标记的炔烃,解决了18F标记的脂肪族炔烃在体内稳定性较低的问题.Thonon等[51]开发了1-(叠氮甲基)-4-[18F]氟苯作为标记辅助基团用于多肽的18F标记,其在体内具有较高的稳定性;以炔烃修饰的[Leu5]脑啡肽为模型肽,在室温下15 min内以95%的RCY合成了18F标记的三唑肽衍生物(图19).
然而上述点击化学反应需要以Cu(Ⅰ)作为催化剂,但Cu(Ⅰ)离子通常具有细胞毒性,在体内可通过形成羟基自由基导致DNA分子和蛋白质的氧化降解,限制了该方法的实用性.为此研究者们开发了通过叠氮化物与环辛炔的弯曲三键反应,以及四嗪与反式环辛烯的逆电子需求的Diels-Alder反应,实现了无铜催化的“点击化学”反应.2011年,Arumugam等[52]利用[18F]氮杂二苯并环辛炔([18F]ADIBO)通过无铜催化的叠氮化物-炔烃[3+2]-偶极环加成,以乙腈水溶液为反应溶剂,在室温条件下反应5~10 min,实现了叠氮修饰的多肽标记(图20),RCY>90%.Carpenter等[53]通过上述方法,在生理条件下以几乎定量的RCY,通过[18F]叠氮化物合成子实现了ADIBO修饰的肽的18F标记.在该研究中使用一种独特的含叠氮化物清除剂树脂代替HPLC纯化,有效地从所需的放射性标记的三唑产物中除去了未反应的ADIBO肽前体,使得该方法易于实现临床转化.

(i)[18F]F-,DMSO,130 ℃,5 min;(ii)NaBH4,水,室温;(iii)48%(质量分数)HBr水溶液,室温;(iv)叠氮化物交换树脂,DMF,室温,15 min;(v)CuI,DMF,室温,15 min.图19 1-(叠氮甲基)-4-[18F]氟苯标记多肽的合成路线Fig.19Synthetic route of 1-(azidomethyl)-4-[18F] fluorobenzene labeled peptides
2014年,Liu等[54]利用四嗪基-马来酰亚胺(TM),以85%的RCY与环肽c(RGDyC)缀合得到四嗪基-马来酰亚胺-RGD共轭物(TM-RGD),在40 ℃条件下以DMSO为反应溶剂,使用极少量的TM-RGD (80~100 μmol/L)与反式-环辛烯([18F]TCO)共孵育5 min,实现了多肽的18F标记(图21),RCY>95%.该方法具有化学选择性好、反应速度快、偶联产率高、多肽量少、无催化剂等优势.

(i)[18F]F-,乙腈,100 ℃,5~10 min;(ii) 乙腈,水,室温,20~25 min.图20 [18F]ADIBO标记多肽的合成路线Fig.20Synthetic route of [18F]ADIBO labeled peptides

(i)[18F]TBAF,乙腈,75 ℃,15 min;(ii) DMSO,40 ℃,5 min.图21 [18F]TCO标记多肽的合成路线Fig.21Synthetic route of [18F]TCO labeled peptides
2.5 基于三氟甲基化反应的多步标记方法
基于三氟甲基化的多肽多步18F标记,主要通过合成18F标记的三氟甲基化试剂,再用于标记多肽.2018年,Verhoog等[55]以[1,1′-联苯]-4-基(溴二氟甲基)-硫烷为标记前体,在三氟甲烷磺酸银(AgOTf)存在下与[18F]F-通过卤素交换获得[18F][1,1′-联苯]-2-基(三氟甲基)硫烷,进而在三氟甲磺酸酐存在下经间氯过氧苯甲酸(mCPBA)氧化成环,得到18F标记的三氟甲基化试剂[18F]5-(三氟甲基)二苯并噻吩三氟甲磺酸盐(图22),利用(三氟甲基)二苯并噻吩三氟甲磺酸盐提供的碱性条件,在半胱氨酸残基位点实现了多肽的三氟甲基化,该方法的RCY为(19±5)%.
2020年,Kee等[56]报道了以2,2-二氟-2-(三苯基膦酸)乙酸酯(PDFA)和N-甲基吗啉·二氧化硫(NMM·SO2)为原料,与[18F]F-反应得到18F标记的三氟甲基化试剂[18F]三氟甲烷亚磺酸铵(图23).以叔丁基过氧化氢(TBHP)作为氧化剂,在Fe(NO3)3存在条件下,[18F]三氟甲烷亚磺酸铵与含有色氨酸和(或)酪氨酸残基的模型肽在HCO2NH4/DMSO混合溶液中反应20 min,实现了多肽的[18F]三氟甲基化,RCY为14%~29%.

(i)[18F]F-,AgOTf,二氯甲烷,60 ℃,20 min;(ii) 间氯过氧苯甲酸,三氟甲磺酸酐,二氯甲烷,45 ℃,20 min;(iii) Et4NHCO3,DMSO/H2O, 40 ℃,20 min.图22 [18F]5-(三氟甲基)二苯并噻吩三氟甲磺酸盐标记多肽的合成路线Fig.22Synthetic route of [18F]5-(trifluoromethyl) dibenzothiophenium trifluoromethanesulfonate labeled peptides
基于三氟甲基化的多肽多步18F标记具有标记条件温和、化学选择性高、对多肽结构改变小等优势,但18F标记的三氟甲基化试剂制备过程较为复杂且总RCY较低,不适合临床应用.
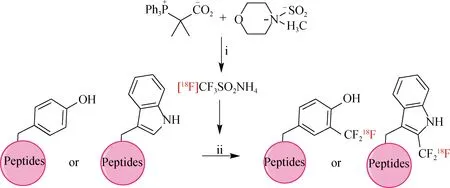
(i)[18F]F-,PDFA,NMM·SO2,DMF,100 ℃,20 min;(ii)TBHP,Fe(NO3)3,HCO2NH4/DMSO,40 ℃,20 min.图23 [18F]三氟甲烷亚磺酸铵标记多肽的合成路线Fig.23Synthetic route of [18F]trifluoromethanesulfinate labeled peptides
3 固相18F标记多肽策略
在固相18F标记策略中,2-氟丙酸([18F]FPA)和[18F]对氟苯甲酸([18F]FBA)是最常用的标记辅助基团.2006年,Marik等[57]以[18F]FPA为标记辅助基团,在活化剂2-(7-氮苯并三氮唑)-N,N,N′,N′-四甲基脲六氟磷酸酯(HATU)和N,N-二异丙基乙胺(DIPEA)提供的碱性条件下反应30 min,实现了[18F]FPA与肽基树脂偶联(图24(a)),RCY约为10%.2002年,Sutcliffe-Goulden等[58]利用5-((9H-黄原-2-基)氧基)戊酸将线性多肽组装在固相聚乙二醇-聚苯乙烯载体上,在HATU和DIPEA存在的条件下2 min内实现了[18F]FBA与多肽(以KPQVTRGDVFTEG-NH2为例)的偶联,并在三氟乙酸、苯酚、水、三异丙基硅烷的混合溶液中裂解得到[18F]FBA-KPQVTRGDVFTEG-NH2(图24(b)),RCY为80%~90%,未经HPLC纯化的粗产物的放射化学纯度>95%.2016年,Davis等[59]利用[18F]FBA作为标记辅助基团,实现了以c(RGDyK) 为例的环肽固相标记,通过多肽固相合成法实现了c(RGDyK) 从头到尾环化,在HATU和DIPEA存在的条件下将[18F]FBA与肽基树脂反应并偶联到多肽上,再通过三氟乙酸-三异丙基硅烷(TFA-TIPS)混合溶液裂解和脱保护获得cRGDyK([18F]FBA)(图24(c)),RCY为(14±2)%.
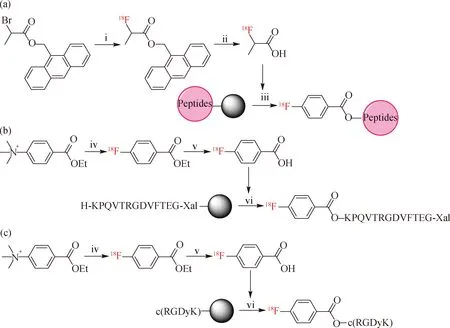
(i)[18F]F-,乙腈,100 ℃,15 min;(ii)三乙胺,DMF,水,100 ℃,10 min;(iii) 1) HATU,DPIEA,DMF,30 ℃,30 min,2) TFA;(iv)[18F]F-,DMF,90 ℃,3 min;(v)NaOH,90 ℃,3 min;(vi) 1) HATU,DPIEA,DMF, 2) TFA,TIPS.图24 固相18F标记多肽的合成路线Fig.24Synthetic route of solid-phase 18F-labeled peptides
4 总结与展望
PET技术可无创地实现活体生理、病理、生化过程的实时监测,是目前影像学的前沿技术之一.与近年来我国PET中心的迅速增加相比,18F标记的放射性药物的临床应用显得滞后,正电子发射探针的缺乏限制了我国PET的进一步发展.多肽由于其优异的靶向性、代谢性质和安全性可作为分子探针先导化合物.多肽对环境的敏感为其18F标记带来了一定挑战,但同时促进了多肽18F标记方法的发展.以碳原子作为氟受体核心的一步18F标记方法一般具有反应时间短、操作简单、易于实现自动化生产等优势,但标记条件相对苛刻,不适用于对强酸、强碱、高温、有机溶剂等敏感的多肽18F标记.以杂原子(B、Al、Si和P)作为氟受体核心原子的一步18F标记方法,其条件比以碳原子为核心的一步18F标记方法要温和得多,因而近年来逐渐兴起;但其18F标记产物在体内容易出现脱氟现象,故需要引入多种策略(如引入吸电子基团、使用缺电子杂环、增强螯合基团结构刚性和引入大位阻基团等)以增强其体内稳定性.目前多肽的18F标记仍主要采用多步法标记策略,其满足在水相、中性、室温等温和的标记条件下标记多肽,但反应步骤多、时间长、总RCY低等缺点限制了其临床应用.固相标记法具有标记条件温和、区域选择性好等优势,但需要对多肽保护和脱保护,且环肽标记较复杂,因此固相标记法往往适用于直链短肽的18F标记.
综上,18F标记多肽的方法众多,但各有优缺点,因此需要研究者根据多肽性质、PET要求等,结合不同方法的优缺点选择合适的标记方法.对于新型标记方法的研究,探寻RCY高(一般要求>25%)、比活度高(一般要求>37 GBq/μmol)、区域选择性好、标记过程简单(尽可能一步标记)、标记条件温和的理想多肽18F标记方法仍具有重大意义和广阔前景.

