磁共振弥散信号强度对结肠腺癌肝脏转移的化疗早期疗效评价的价值*
四川省肿瘤医院·研究所/四川省癌症防治中心/电子科技大学医学院影像诊断部(四川 成都 610041)
王晓东 周 鹏 任 静 许国辉 刘圆圆*
实体肿瘤反应评价(response evaluation criteria in solid tumors,RECIST)是目前广泛应用于临床、判断肿瘤化疗疗效的标准[1],主要通过观察化疗前后肿瘤大小的改变作为评价疗效的依据,但肿瘤大小的改变发生较缓慢。鉴于此,能早期、敏感地反映肿瘤对治疗反应的检查方法,是临床肿瘤治疗工作中所迫切需要的,且根据临床实际应用及伦理道德要求,所用的检查方法还应满足无创伤或创伤小,可重复性高。磁共振弥散加权成像(diffusion-weighted imaging,DWI)可以敏感检测组织中水分子的弥散运动信息,间接反映组织的微观结构,且无需使用造影剂。以往很多研究通过表观弥散系数值(apparent diffusion coefficient, ADC)来进行肝内病灶的定性诊断[2]及肝内病灶疗效的预测及早期监测[3],但ADC图伪影较重,当肝内恶性病灶较小时,其在ADC图上呈低信号,不易与邻近肝实质区分。对肝脏病灶弥散信号强度变化,国内外研究多局限于主观评估,有研究发现通过弥散信号强度定量指标对比噪声比(contrast-to-noise ratio,CNR)可以实现肝内良恶性肿瘤的鉴别[4]。本研究通过观察1组结肠腺癌肝脏转移瘤化疗前后的病灶信号噪声比(signal-to-noise ratio,SNR)、病灶-肝脏对比噪声比(CNR)及相应的变化趋势,探讨DWI上述定量指标早期评价肝脏转移瘤化疗疗效的效能。
1 资料与方法
1.1 一般资料 收集因结肠腺癌肝脏转移瘤来我院行化疗的患者27例,在患者知情同意的情况下采取以下随访措施:化疗前2~3d、化疗后14d及化疗后2个月共行三次上腹部MRI扫描。男性12例,女性15例,年龄为27~78岁,中位年龄51.3岁。
排除标准:患者既往进行过化学药物治疗或介入治疗;肝实质内弥漫分布结节;肝实质弥漫纤维化;肝内最大病灶直径<1cm。
1.2 检查方法 采用Siemens Magmentom TrioTim 3.0T超导型磁共振扫描仪,体部相控阵列线圈。扫描前进行屏气训练,吸气末屏气,屏气时间约14~18s。扫描范围从膈顶至双肾下极,包括全肝。DWI采用EPI序列,选取3个扩散系数(b值分别为0、50、600s/mm2),扫描参数如下:TR1200ms,TE73ms,层厚5mm,层间距1mm,FOV 393mm,矩阵115×192,翻转角90°,激励次数3。所有扫描序列均在屏气状态下完成。数据处理及图像分析采用Siemens SyngoMMWP 工作站。
1.3 图像分析
1.3.1 数据测量 病灶信号强度:在b=600s/mm2图像,在病灶的最大层面测量病灶信号强度(signal intensity,SI)。感兴趣区域(region of interesting,ROI)面积约0.36cm2,像素18。对于较大的病灶,在病灶的上、下、左、右四个区域取4个ROI并将测得的SI取平均值;对于较小的病灶连续测量4次取平均值。测量时尽量避开肉眼可见坏死区域。
肝脏信号强度:在病灶信号强度测量层面,测量病灶周围1cm(上、下、左、右四个区域)正常肝实质SI取平均值。测量时尽量避开血管及胆管。噪声:在病灶信号强度测量层面腹壁左前方测量噪声标准差两次取平均值。病灶大小:在b=50s/mm2图像上,测量病灶病灶最大层面的最大长径。两个或多个病灶融合则测量融合后病灶的最大长径。
1.3.2 观察指标 信号噪声比SNR病灶=SI病灶/SDnoise;对比噪声比CNR=(SI病灶-SI肝脏)/SDnoise;SNR变化率=(SNRday14-SNRpre)/SNRpre;CNR变化率=(CNRday14-CNRpre)/ CNRpre;肿瘤大小变化率:(amon2-apre)/ apre。
上述公式中,SI病灶、SI肝脏分别表示病灶及正常肝脏实质的信号强度;SDnoise指背景噪声信号强度的标准差;SNRpre、SNRday14分别表示化疗前及化疗后14天病灶SNR;CNRpre、CNRday14分别表示化疗前及化疗后14d病灶CNR;apre、amon2分别表示化疗前及化疗后2个月靶病灶最大长径之和。
1.4 统计学方法 采用SPSS 17.0软件包进行数据处理,采用配对设计秩和检验分析肝脏转移瘤治疗前、治疗后14d的SNR、CNR的差异;使用成组设计秩和检验分析治疗有效组、无效组SNR、CNR之间的差异;用ROC曲线得到预测转移瘤化疗是否有效的临界值。
2 结 果
2.1 肝转移瘤化疗疗效的临床评价 本研究中,化疗后完成随访27例,共72个目标转移灶(病灶最大层面长径>1cm)。根据RECIST评价标准,至化疗2月时,其中6例因病灶增大或出现新病灶临床评价为PD,共17个目标转移灶; 4例评价为PR,17例评价为SD。
2.2 有效组与无效组化疗前后肝转移瘤信号强度的组间比较 由表1可知,治疗有效组与无效组化疗前病灶的SNR组间差异无统计学意义,但CNR组间差异有统计学意义(P=0.019);化疗后14d,除了无效组的CNR略有升高,有效组的SNR及CNR、无效组SNR均呈降低趋势,但化疗后SNR、CNR的组间差异均无统计学意义。
应用受试者工作特征曲线(receiver operating characteristic,ROC)分析显示当b=600s/mm2、CNR45.6为阈值时,其预测化疗有效的灵敏度为89%、特异度为53%,曲线下面积0.71,P=0.009(图1)。
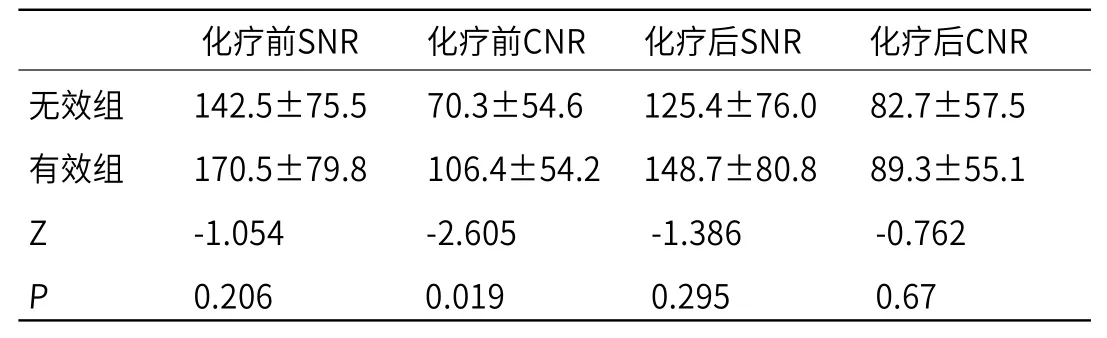
表1 有效组与无效组化疗前、后肝转移瘤SNR及CNR(b=600 s/mm2 )的组间比较
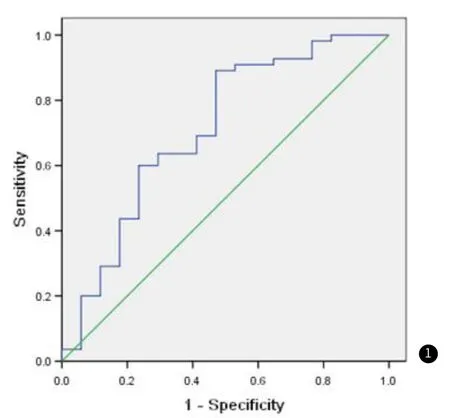
图1 化疗前CNR预测化疗有效与无效的ROC曲线
2.3 有效组与无效组肝转移瘤化疗前后的自身对照及相应变化率的组间比较 对于治疗有效组,化疗后14d与化疗前对比,病灶的SNR及CNR均有降低,且差异均有统计学意义;无效组化疗前后病灶SNR及CNR的差异均无统计学意义(表2)进一步计算有效组及无效组肝转移瘤SNR及CNR化疗前后的变化率,并进行组间比较,发现组间差异均无统计学意义。

表2 有效组及无效组肝转移瘤SNR、CNR的化疗前后自身对照
3 讨 论
3.1 磁共振DWI的原理及本研究中b值选择 DWI序列基于Stejskal 和 Tanner[5]提出来的模式,即在自旋回波T2加权序列180°脉冲前后加上一对对称弥散敏感梯度脉冲。弥散低的水分子,在第一个梯度脉冲所致的质子自旋去相位会被第二个梯度脉冲再聚焦,信号不降低;而对于弥散强的水分子,第一个梯度脉冲所致的质子自旋去相位离开了原来的位置,不能被第二个梯度脉冲再聚焦,信号降低。弥散加权的程度由弥散梯度因子(b值)决定,把敏感磁场的振幅、持续时间和两个反相位梯度场的间隔时间考虑在内,单位为s/mm2[6]。
本研究中,在b=50s/mm2图像进行病灶大小测量,在b=600s/mm2图像进行病灶信号强度定量测量。原因为低b值(50~100s/mm2)时,图像质量最好、病灶检出率最高[7]。随着b值增加,灌注对弥散运动的影响减弱,当b>500s/mm2时基本消除灌注效应的影响[8]。但在高b值(500~1000s/mm2)时,随b值增加,图像变形增加,产生伪影增加[9]。所以选择b=600s/mm2,既实现了较高的图像质量,也保证图像失真最小。
3.2 化疗前病灶信号强度预测肝转移瘤化疗疗效的价值及可能原因分析 本研究结果表明,在化疗前有效组SNR、CNR较无效组高,分析原因如下:DWI的信号强度能反映肿瘤的微观结构,客观反映肿瘤细胞处于活性、坏死或损伤的状态[10],有效组病灶化疗前SNR、CNR值较大,意味着微观层面肿瘤细胞坏死或损伤少,细胞结构密集,因而限制了水的弥散,所以弥散信号强度高。而化疗前肿瘤坏死细胞少,意味着血供较丰富,肿瘤内化疗药物高度浓聚,且活性细胞比坏死组织及细胞间质更敏感,肿瘤增值受抑制,所以治疗有效。相反化疗前肿瘤内坏死细胞多则意味着血供较差,化疗药物灌注较差;同时局部缺氧以及继发性酸中毒,促进肿瘤细胞剧烈增值,诱发细胞抵抗机制[11],均导致治疗无效。
3.3 化疗后时间界点的选择及病灶化疗前后信号强度变化监测肝转移瘤化疗疗效的评价 本研究选择14d作为早期随访界点,是因为研究表明有效的化疗药物输入后2~3d细胞首先出现水肿[12],导致细胞间隙缩小,继而导致水弥散受限增加,病灶信号强度增高;7~9d后细胞出现明显的凋亡,11d达到高峰[13],完整的细胞膜崩解,细胞溶解消散,细胞外空间增大,水弥散增加[14],此时弥散信号强度降低。另外也基于化疗周期考虑,在下一化疗周期开始前完成疗效评估,可以为临床提供信息以利于制定与修改化疗方案,且不增加患者的经济与精神负担。
本研究中发现,有效组在化疗后14d SNR、CNR较化疗前降低,且二者化疗前后差异均有统计学意义;无效组化疗后病灶SNR较前有降低趋势、CNR较化疗前增高,但差异均无统计学意义。进一步将SNR、CNR前后变化率进行组间比较,发现组间差异均无统计学意义。推测这可能与本研究病例中临床评价为SD所占比重较大有关,占63%(17/27),PR与PD组占比较小(各4、6例)。在后续研究中将增大样本量,分析化疗后早期信号强度变化与化疗疗效的相关性。
本研究也存在一些不足:首先,病变样本量较小,并且没有将原发肿瘤的分化程度纳入分析,而肿瘤病理分级会影响弥散信号强度及ADC值[15];其次,在肝转移瘤化疗疗效评价方面,化疗方案没有统一,对结果造成一定的影响;最后,在随访时间界点的选择上比较局限,在将来的研究中,希望在不违背伦理道德的情况下,进行多时间界点的研究,完善化疗周期内不同时间点的信号改变,确立最佳随访界点。
本研究结果表明,病灶DWI信号强度定量指标,可以早期反映肿瘤微观结构并预测化疗后疗效,可以达到基于ADC的研究[16]类似的效能,同时弥补了ADC图像质量差及不利于肝内小病灶检出及测量的缺点。

