超声引导下乳腺肿物体表标记联合染色与金属丝定位辅助切除不可触及乳腺病变的效果比较
杨晓冬 郑玥欣 张夕凉
解放军总医院第六医学中心普通外科,北京 100048
乳腺癌严重影响女性的身体健康,在中国女性恶性肿瘤发病率中居首位[1],随着女性健康意识的提高和体检项目乳腺超声检查的普及,发现临床触诊阴性的乳腺肿块越来越多,即临床不可触及乳腺病变(non-palpable breast lesions,NPBL)[2]。而这些病变中有9%~42%是乳腺癌,其中0%~38%有转移[3-4]。早期诊断治疗可提高患者的生存率和生活质量[5-6]。因此,精准地切除NPBL 至关重要[7]。病变过小、位于腺体深层的NPBL,在没有任何辅助的情况下手术极易造成漏切或不必要的乳腺区段切除。影像学辅助定位方法有超声定位[8]、钼靶X线定位[9-10]、磁共振定位[11]、乳管镜下定位[12-13]、放射性粒子定位[14]。由于费用和技术条件的限制,目前应用较多的方法是超声引导下导丝定位后手术切除,但存在定位准备工作繁琐、一旦导丝脱落无法找到病灶需要扩切的问题。为解决此问题,达到精准定位、手术高效确切的效果,解放军总医院第六医学中心应用超声引导下乳腺肿物体表标记联合染色技术来切除NPBL。本研究对超声引导下乳腺肿物体表标记联合染色与金属丝定位协助切除的手术指标进行对比,分析优缺点,在临床中为NPBL患者选择最佳手术方法提供参考,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2016年7月~2019年7月于解放军总医院第六医学中心行手术治疗的102例NPBL患者的临床资料,均为女性,均为临床触诊阴性、超声下发现的乳腺肿物,其中51例行超声引导下乳腺肿物体表标记联合染色法作为观察组,51例行超声引导下导丝定位术作为对照组。观察组中,年龄18~55岁,平均(32.23±7.70)岁;肿块均为单发,平均直径(1.39±0.91)cm;上象限28例,下象限23例。对照组中,年龄19~56岁,平均(31.12±7.85)岁;肿块均为单发,平均直径(1.47±0.78)cm;上象限31例,下象限20例。两组患者的年龄、肿块直径等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。纳入标准:①女性患者;②乳腺肿物在临床查体肿物触诊阴性;③乳腺超声检查可发现,Birads分级1、2、3、4a 类。排除标准:①既往恶性肿瘤病史;②妊娠或哺乳期;③因重大疾病难以耐受麻醉及手术,如心肌梗死、脑梗死、凝血功能障碍、精神疾病等。本研究经解放军总医院第六医学中心医学伦理委员会批准。
1.2 仪器
仪器采用迈瑞牌MINDRAY DC-38 全数字超声诊断系统,探头频率为7.5 MHz。
1.3 手术方法
1.3.1 观察组 麻醉后先摆好体位,平卧位、上肢外展90度,再行超声检查,乳腺皮肤涂耦合剂,探头完全垂直皮肤,找到病灶后,减小对乳腺的挤压,尽量保持皮肤的正常高度,再次对病灶行水平、垂直位探查,测量NPBL 距体表的距离并记录病变在腺体的浅层还是深层。固定探头,在水平及垂直位十字相交处的皮肤以指甲盖按出一个“十”字,擦掉耦合剂,用专用黑色标记笔在指甲印处画圈(图1a)。再次超声检查确认位置无误后结束体表定位。常规消毒铺巾,超声探头套上无菌保护套,助手双手固定乳腺腺体,超声观察到肿物后固定不动,1 mL 注射器抽0.1~0.2 mL 美兰,换5 mL 注射器针头,在超声实时引导下将针尖斜向刺到病灶表面(图1b),注射美兰后保持回抽状态退出注射器。根据肿瘤位置深浅及大小做2~3 cm 弧形切口,垂直向下用弯钳分离皮下组织及腺体组织,小拉钩拉开切口,如为腺体浅层肿物,将正下方浅层直径1 cm 之内的腺体切除;如为深层肿物,需一直向下切到肌肉筋膜表面。标本切除后切开检视,发现蓝染则表明乳腺肿物已确实切除(图1c)。
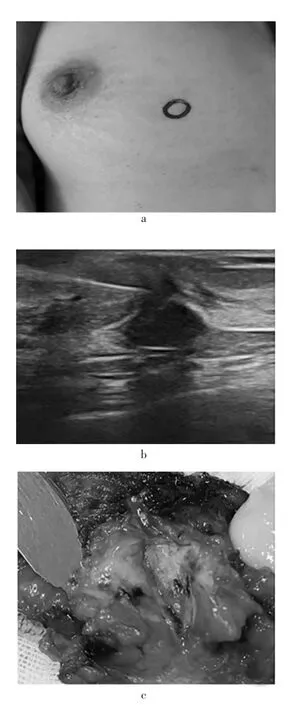
图1 观察组手术流程
1.3.2 对照组 定位于术前1 d 在超声室进行,定位导丝使用LW0107 乳腺穿刺定位针,先嘱患者取适当体位,良好暴露乳腺,常规消毒皮肤后铺无菌巾,无菌塑料膜包裹探头,皮肤表面涂适量碘伏,先行常规超声检查,发现病灶,显示最大径线并寻找合适角度,在病灶最大径线处固定探头。在拟穿入导丝处皮下注射局麻药,在超声影像的实时引导下,缓慢将定位针刺入病灶,确认针尖位于病灶内无误再推出定位导丝,最后缓慢退出定位针鞘。伤口以纱布适当压迫避免出血,将过长的定位导丝尾端剪掉。皮肤外留出3~5 cm即可,无菌辅料覆盖后再以胶布固定避免导丝脱出。次日患者入手术室,患者取仰卧位,患肢外展,麻醉后根据BPBL位置深浅及大小做2~4 cm 弧形切口,分离皮下组织,找到定位导丝后用弯钳夹住,将体外导丝剪断,将剩余导丝拉入切口,沿定位导丝继续向下分离乳腺组织,找到倒钩定位的病灶,完整切除导丝及病灶,随后即行病理诊断。
1.4 观察指标及评价标准
比较两组患者的相关手术指标(切口长度、术中出血量、手术时间)、术后并发症发生情况、总满意率。两组患者对手术治疗后的满意率采取问卷调查的方式,由解放军总医院第六医学中心自行设计手术满意度调查表,该量表Cronbach′s α 系数为0.829,评分为0~100 分。<60分为不满意,60~89分为满意,≥90分为非常满意。总满意率=(非常满意+满意)例数/总例数×100%。
1.5 随访
全部患者均出院后于门诊随访,行超声检查复查,随访时间1~6个月。观察患者肿瘤有无残留或复发等。
1.6 统计学方法
采用SPSS 19.0 统计学软件进行数据分析,符合正态分布的计量资料采用均数±标准差(±s)表示,两组间比较采用t 检验,不符合正态分布者转换为正态分布后行统计学分析;计数资料用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 病理结果
最后的病理结果显示,纤维腺瘤51例,乳腺增生26例,导管内乳头状瘤10例,导管扩张4例,叶状肿瘤3例,导管原位癌3例,浸润性导管癌5例。恶性肿瘤占比8.0%(8/102)。
2.2 两组患者手术指标的比较
两组患者的乳腺肿物均完整切除,手术成功率为100%。观察组患者的切口长度和手术时间均短于对照组,术中出血量少于对照组,差异有统计学意义(P<0.05)(表1)。
表1 两组患者手术指标的比较(±s)
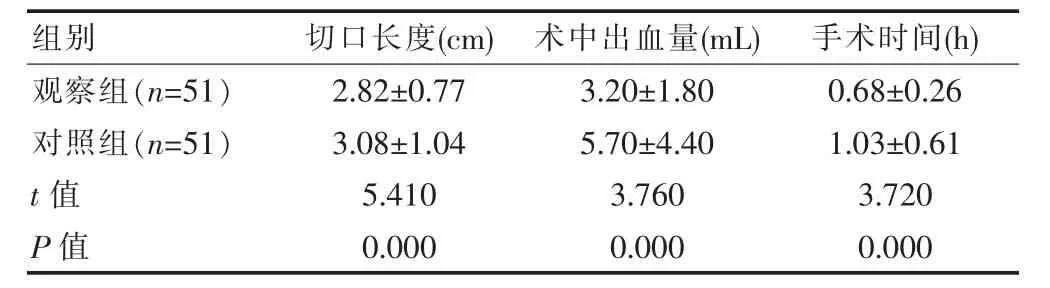
表1 两组患者手术指标的比较(±s)
组别 切口长度(cm) 术中出血量(mL) 手术时间(h)观察组(n=51)对照组(n=51)t值P值2.82±0.77 3.08±1.04 5.410 0.000 3.20±1.80 5.70±4.40 3.760 0.000 0.68±0.26 1.03±0.61 3.720 0.000
2.3 两组患者并发症发生情况及总满意率的比较
观察组共发生5例并发症,其中血肿3例(5.9%),皮肤瘀斑1例(1.9%),切口感染1例(1.9%)。对照组共发生6例并发症,其中血肿2例(3.9%),皮肤瘀斑2例(3.9%),切口感染2例(3.9%)。两组患者的并发症总发生率比较,差异无统计学意义(P>0.05);观察组患者的总满意率高于对照组,差异有统计学意义(P<0.05)(表2)。
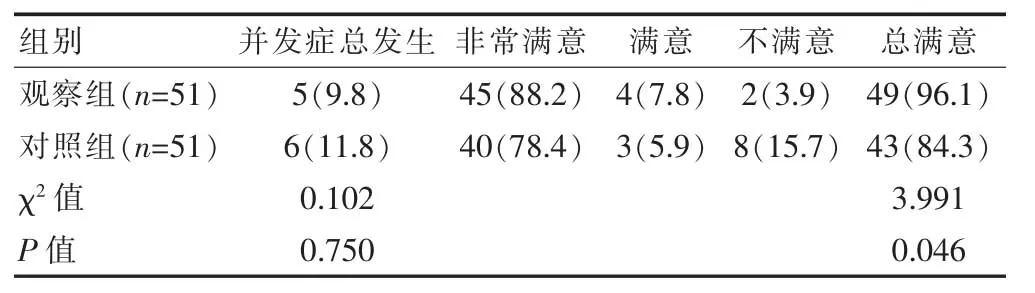
表2 两组患者并发症总发生率及总满意率的比较[n(%)]
2.4 两组患者的复发情况
术后随访两组无肿瘤残留及复发。
3 讨论
乳腺肿瘤的早期诊断及早期治疗是提高治愈率的关键[5-6]。随着越来越多的NPBL 在体检时被发现,其中相当一部分可能是恶性肿瘤,当患者有家族史或超声及核磁的肿物分级较高时,很有必要做切除活检。早期行NPBL 的精准切除有可能使部分癌前病变避免恶变并使部分早期乳腺癌患者免于化疗。准确切除NPBL 在实际手术操作中有难度,容易造成漏切病变或不必要的乳腺区段切除。影像学辅助定位是精准切除的必要方法,有X线辅助、超声辅助、乳管镜辅助三种方式。超声辅助定位在临床上应用最为普遍,分别有三种方法:超声引导下体表定位[15]、超声引导下术中动态定位[16]、超声引导下导丝定位[17-18],超声引导下肿物内置入导丝定位是目前是最常用的方法,有助于术中快速、准确找到病灶[19]。但导丝定位存在很多问题,首先是导丝倒钩对抗外力作用有限,可能在患者活动时移位,或在术中手术操作时掉落,一旦移位或掉落后没有备用方案,完全成“睁眼瞎”,切下来后没有把握一定切掉了病变;其次是穿刺导丝进入乳腺并不垂直,有一定角度,术中对肿物的距离和深浅很难判断,沿导丝分离寻找肿物比较困难;再则金属丝裸露在体外,患者舒适度较低。还有可能导致切缘阴性率减低,增加再次手术风险[20]。
超声引导下体表定位联合蓝染有明显优势,精准度高,手术时间明显缩短,且操作方便,体表定位及染色只需术前5 min 就可以完成,不需要手术全程依赖超声,不需要做不必要的乳腺区段切除。操作时需注意要先固定患者的体位及乳腺位置,再让超声探头完全垂直皮肤表面,经横切及纵切面确认后体表记号笔标记。注射美兰0.1~0.2 mL 即可,太多会造成腺体蓝染面积过大,影响视野并造成过多的组织切除。注射完退出针头时注意保持回抽状态,避免皮肤蓝染影响美观。从体表定位处切开皮肤分离皮下脂肪后一直往正下方走即可,根据术前超声标志的肿物属于浅层还是深层,来选择切除深度。再以定位点为中心,半径为肿物半径加1 cm 向四周切除乳腺组织,1 cm 切缘足以保证切除肿物,同时有美兰染色验证,将切下的标本剖开后看到蓝染就能较好地确认病变已切除。而导丝定位的手术,虽然较无定位情况要快,但实际手术操作起来要时刻避免导丝脱落,每一个步骤都要特别小心,牵拉不可用力,沿导丝分离操作处理腺体时相对较慢,一旦发现导丝有脱落倾向还需附近缝合固定导丝。一旦不慎导丝脱离就只能做区段切除来保证不漏切。这一系列问题导致了更长的手术时间和切口长度及较多的出血量。
相关文献显示,超声检查对乳腺肿块鉴别准确度在90%以上[17]。对NPBL患者进行超声体表定位结合美蓝染色标记,准确切除病灶成功率高,病理学结果与BIRADS分级一致。手术切除NPBL 的关键为“精准、美容、快速”。本方法体现了这几个优点,与麦默通手术相比,优势在于标本组织完整,有助于冰冻病例准确报告并明确显示肿瘤大小及切缘,一旦确诊乳腺癌可在手术台上继续行后续的腋窝淋巴结手术。本研究的局限在于未将切除组织量纳入研究指标,切除组织量与肿瘤直径的比值也能体现“精准”,下一步计划扩大样本量并将切除组织量纳入研究指标。此种定位方法需要超声密切配合,如依赖超声科医生则需要超声科医生进手术室,降低效率。因此,需要临床医生学习超声操作,达到术前体表定位及超声引导下穿刺注射美兰都能够自己操作,一般学习3个月即可。这也体现了目前“多学科融合”的趋势。
综上所述,超声引导下体表定位联合染色技术,可以精准高效地切除NPBL。超声引导下定位准确,操作简便,手术中能迅速找到肿物,缩短了手术时间、切口长度,患者满意度高。因此,本方法是一种值得推广的方法。

