元素金属性和非金属性强弱的比较方法
◇ 江西 熊 莹
元素的金属性和非金属性比较是高考必考知识点.金属单质与水或酸反应越剧烈、金属元素最高价氧化物对应水化物的碱性越强,金属性越强;非金属单质与H2反应越容易、气态氢化物越稳定、非金属元素最高价氧化物对应水化物的酸性越强,元素的非金属性越强.
1 位置比较法
金属性或非金属性强弱比较,可以通过金属或非金属元素在活动性顺序表中的位置判断,也可以通过元素在周期表中的位置进行判断.
例1下列不能用元素周期律解释的是( ).
A.碱性:Na OH>Li OH
B.与浓硝酸反应速率:Cu>Al
C.酸性:HCl O4>H2SO4
D.稳定性:HBr>HI
分析元素金属性越强,其最高价氧化物对应的水化物碱性越强,金属性:Na>Li,则碱性:Na OH>Li OH,能用元素周期律解释,选项A不符合题意.铝遇浓硝酸钝化,铜与浓硝酸剧烈反应,不能用元素周期律解释,选项B符合题意.元素非金属性越强,最高价氧化物的水化物对应的酸性越强,非金属性:Cl>S,则酸性:HCl O4>H2SO4,能用元素周期律解释,选项C不符合题意.元素非金属性越强,气态氢化物的稳定性越强,非金属性:Br>I,则气态氢化物的稳定性:HBr>HI,能用元素周期律解释,选项D不符合题意.答案为B.
点评
采用位置比较法关键要掌握三个顺序表:1)金属活动性顺序表:按KCaNaMgAl ZnFeSnPb(H)CuHgAgPtAu的顺序,金属性减弱.2)非金属活动性顺序表:按F、O、Cl、Br、I、S的顺序,非金属性减弱.3)周期表中金属性“左强右弱”“下强上弱”,非金属性“左弱右强”“上强下弱”.
2 实验比较法
元素的金属性、非金属性强弱还可以通过实验现象进行比较,如强酸(碱)制弱酸(碱),金属与水或酸反应、非金属单质与H2反应剧烈程度.
例2根据下列化学实验现象,分析得出的结论正确的是( ).
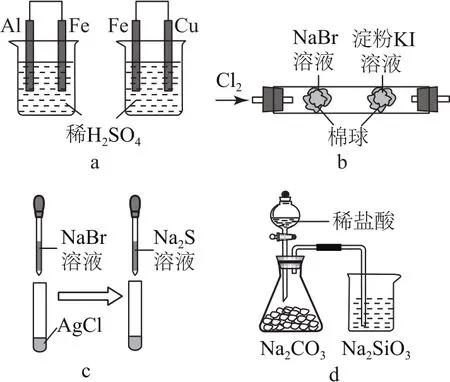
图1

选项________________________________________________________________实验现象_结论A装置a左烧杯中铁表面有气泡,_____右烧杯中铜表面有气泡金属性:Al>Fe>Cu B装置b左边棉花变为橙色,右边_____棉花变为蓝色非金属性:Cl 2>Br 2>I 2 C装置c白色固体先变为淡黄色,后_____变为黑色溶解度:Ag Cl<Ag Br<Ag 2 S________D装置d锥形瓶中有气体产生,烧_____杯中液体变浑浊非金属性:Cl>C>Si
分析左烧杯中铁表面有气泡,说明铁是正极,铝是负极,故金属性:Al>Fe,同理右烧杯中铜是正极,铁是负极,金属性:Fe>Cu,选项A正确.过量的氯气可以与碘化钾反应生成碘而使淀粉变蓝,该实验不能证明溴和碘的非金属性强弱,选项B错误.氯化银转化为溴化银,再转化为硫化银,故溶解度:Ag2S<Ag Br<Ag Cl,选项C错误.盐酸不是氯元素的最高价氧化物的水化物,不能通过盐酸与碳酸钠反应证明氯元素的非金属性强于碳;盐酸易挥发,可能是挥发出的盐酸与硅酸钠溶液反应,无法证明C与Si非金属性强弱,选项D错误.答案为A.
点评
一般情况下,作原电池负极的金属性比正极强,但要注意特殊情况,如镁和铝用导线连接放入Na OH溶液,铝作负极;铜和铁用导线连接放入浓硝酸中,铜作负极.
总之,元素的金属性越强,其单质与水反应越剧烈,最高价氧化物对应的水化物碱性越强,在原电池中常作负极,对应的阳离子在电解池的阴极越不容易放电;元素的非金属性越强,气态氢化物越稳定,最高价氧化物对应的水化物的酸性越强,对应的阴离子在电解池的阳极越不容易放电.

