紫叶紫薇良种组培快繁研究
饶丹丹,王湘莹,蔡 能,乔中全,曹受金,王晓明,周 围
(1.中南林业科技大学 林学院,湖南 长沙 410004;2.湖南省林业科学院,湖南 长沙 410004;3.长沙市木本花卉工程技术研究中心,湖南 长沙 410005)
紫薇Lagerstroemia indica千屈菜科Lythraceae紫薇属Lagerstroemia是一种落叶灌木或小乔木[1]。紫薇是我国夏季少花期的主要观花树种之一,其花色丰富,寿命长,树龄有达200 a 的,花期长达100 多天,具有较强的抗污染和抗旱性,可耐夏季40℃高温和-23℃的低温,适应性广,南北均可种植,广泛用于城市园林、道路绿化、乡村旅游、庭院绿化和盆景盆栽等。
目前,国内外研究者紫薇育种通过常规选育、杂交育种、诱变育种等方法,培育出各色的紫薇,但因国内紫薇育种起步较晚,拥有自主知识产权的紫薇优良新品种较少。‘紫玉’紫薇作为我国拥有自主知识产权的紫薇优良新品种,是通过杂交育种,从实生苗中选育出来的具有优良性状的紫薇彩叶新优品种。‘紫玉’具有生长迅速、枝干直立性强、主干明显、叶缘起伏、成熟叶紫红色、花纯白色的特点,是很好的观叶观花植物,在园林观赏和后期养护等方面具有较高的观赏价值和一定的经济价值,可用于园林绿化、行道树种、庭院绿化、园林花镜花带营造和盆栽盆景等,应用前景极大。
紫薇的常规繁殖方式有种子繁殖、扦插繁殖和嫁接繁殖3 种繁殖方式[2],但是常规的繁殖方式繁殖速度慢,并且在前期通过植物组织培养来培育紫薇苗木,既具有繁殖系数高、繁殖速度快,又能保持紫薇优良的品种性状,可以在短时期获得大量具有优良种性的优质种苗,对紫薇苗木产业化生产具有重要的应用价值,并且对保存种质资源具有重要意义。
近年来,专家学者在紫薇组织培养领域进行了大量的研究。姜旭红等[3]以紫薇嫩茎、叶片为外植体,通过诱导愈伤组织建立了日本紫薇的再生体系。曹受金等[4]以无果紫薇嫩茎产生的愈伤组织为外植体,通过诱导分化丛生芽建立无果紫薇的再生体系,结果表明,3种激素NAA 0.05 mg/L,6-BA 0.5 mg/L 和KT 0.5 mg/L 对紫薇愈伤组织分化丛生芽效果显著。段丽君、唐丽丹、陈怡佳等[5-11]以紫薇嫩茎、茎尖为外植体,通过诱导腋芽和顶芽途径建立了红火球紫薇、美国红叶紫薇、黑叶紫薇和矮首领紫薇的组培再生体系。蔡能等[12-13]通过诱导紫薇嫩茎腋芽萌发先后进行了‘晓明1 号’紫薇和‘紫韵’紫薇的组织培养快繁研究,发现紫薇属不同种或不同品种对矿质元素的需求具有一定的差异,较高浓度的矿质营养元素的DKW 基本培养基有利于‘晓明1 号’组培苗的生长,较低浓度矿质元素的WPM 基本培养基适宜‘紫韵’紫薇的生长。宋平、王晓娇等[14-19]以紫薇种子为外植体,再以无菌苗的茎段、叶诱导腋芽萌发或诱导愈伤组织,完成了‘小花紫’‘Supersonic’‘Bicolor’、‘南紫薇’、‘屋久岛紫薇’和云南紫薇再生体系的建立。李国瑞、唐兴国等[20-21]通过胚、子叶和下胚轴诱导愈伤组织途径建立了紫薇再生体系。陈晓航[22]在进行黑钻石紫薇的组培再生研究过程中,以茎段为外植体进行初代培养时发现添加一定浓度PPM 可以显著降低外植体污染率,有利于诱导腋芽萌发。吕铭等[23]在进行红叶紫薇组培研究过程中,以紫薇茎段为外植体,发现1/2 MS 培养基比MS,WPM 和1/2 WPM 更适合红叶紫薇腋芽诱导。目前为止专家学者对不同品种紫薇各种途径的组织培养已经进行了大量的研究,紫薇作为异花授粉植物,以种子和幼胚为初始外植体的途径进行组织培养,繁殖的后代易变异。
目前尚未见‘紫玉’紫薇组培快速繁殖的相关报道。本研究以‘紫玉’紫薇为试验材料,对紫叶紫薇进行组培快繁研究,对增殖基本培养基和生根培养基进行改良,得到更适合紫玉紫薇这一紫薇良种的组培快繁技术。以带腋芽茎段为外植体进行紫薇组织培养快速繁殖,通过筛选最佳消毒时间、增殖培养基和生根培养基,以期建立‘紫玉’紫薇组培快繁体系,在较短时间里获得大量母株材料,为‘紫玉’紫薇工厂化育苗和紫薇种质资源保存提供初始材料和技术支撑。
1 材料与方法
1.1 试验材料
试验材料为紫薇新优品种‘紫玉’紫薇,来自湖南省林业科学院试验林场紫薇示范基地。于晴天的早晨采样,外植体选取无病害生长健壮的植株,剪取其春季萌发的无病虫害、生长旺盛、腋芽未萌发的嫩枝,保湿带回实验室,去掉叶片和顶芽,保留叶柄,待用。
1.2 试验设计
1.2.1 外植体消毒处理
将紫薇嫩枝在自来水下流水冲洗2 h,在超净工作台中,将紫薇嫩枝剪成2~3 cm 的带腋芽茎段,用75%酒精浸泡清洗30 s,无菌水冲洗2 次,再用0.1% HgCl2溶液进行常规消毒处理,消毒时间分别为4、5、6 min,再用无菌水冲洗4 次。将茎段两端褐化部分去掉,接种于改良DKW+6-BA 1.0 mg·L-1+NAA 0.1 mg·L-1+蔗糖30 g·L-1+琼脂5.0 g·L-1的培养基上,每个消毒时间处理接种20 瓶,每瓶接种1 个茎段。试验重复3 次,初代培养30 d 后统计污染率和存活率。
1.2.2 继代增殖基本培养基筛选
以WPM、1/2MS、MS、改良DKW 为基本培养基,均添加生长调节剂6-BA 1.0 mg·L-1+NAA 0.25 mg·L-1+蔗糖30 g·L-1+琼脂5.0 g·L-1,每处理接种15 瓶,每瓶接种4 个长势一致、高约1.5 cm的芽,试验重复3 次。增殖培养30 d,观察丛生芽增殖生长情况并统计增殖系数以及芽苗生长状况。增殖系数=(统计时有效芽数)/接种芽数(有效芽为高度大于1 cm 的芽)。
1.2.3 细胞分裂素种类对增殖的影响
增殖培养基以改良DKW+NAA 0.25 mg·L-1+蔗糖30 g·L-1+琼脂5.0 g·L-1为基础,分别添加1.0 mg·L-1的细胞分裂素6-BA、ZT 和KT,研究细胞分裂素种类对‘紫玉’紫薇增殖的影响,筛选出增殖培养最适的细胞分裂素。将初代培养中长出来的腋芽剪取约1.5 cm 单株芽苗接种于增殖培养基上。每个处理接种10瓶,每瓶接种4个芽苗,试验重复3 次。30 d 后,观察丛生芽增殖情况并统计增殖系数及芽苗生长状况。
1.2.4 生长调节剂对增殖的影响
增殖培养基以改良DKW+蔗糖30 g·L-1+琼脂5.0 g·L-1为基础,分别添加0.5、1.0、2.0 mg·L-1细胞分裂素6-BA 和0.10、0.25、0.50 mg·L-1的生长素NAA,探究6-BA 质量浓度和质量NAA 浓度对‘紫玉’紫薇丛生芽增殖的影响。将初代培养中长出来的腋芽剪取约1.5 cm 的单株芽苗接种于增殖培养基上。每个处理接种10 瓶,每瓶接种4个芽苗,试验重复3 次。30 d 后,观察丛生芽增殖情况并统计增殖系数及芽苗生长状况。
1.2.5 生长调节剂对生根的影响
剪取继代增殖的1.5 cm 以上的健壮苗进行生根诱导,以1/2 改良DKW+300 mg·L-1为基本培养基,生长素IBA 设置3 个质量浓度,分别为0.2、0.5、0.8 mg·L-1;生长素NAA 设置3 个质量浓度,分别为0.1、0.2、0.3 mg·L-1。每个处理接种15 瓶,每瓶接种5个苗。试验重复3次,30 d后观察生根情况,统计生根率,根条数和根长。生根率=(生根苗数/接种苗数)×100%。
1.2.6 炼苗与移栽
选择生长健壮、根系良好的紫薇小苗,移入温室,打开瓶盖炼苗1 周,炼苗后取出组培苗,用自来水清洗小苗根部的培养基,多菌灵浸泡10 min,再移栽到已经消毒的基质中,基质采用体积比为3∶1 的泥炭和珍珠岩,移栽30 d 后统计移栽成活率。移栽成活率=(成活苗数/移栽苗数)×100%。
1.3 培养条件
以上培养基均添加琼脂5.0 g·L-1,初代培养基和增殖培养基添加蔗糖30 g·L-1,生根培养基添加蔗糖15 g·L-1,pH 值均调为5.8~6.0;121℃高温高压条件下灭菌20 min;在培养温度为(25±2)℃,光照强度为1 500~2 000 lx,每日光照时间为12 h。
1.4 数据分析
培养30 d 后统计外植体污染率、外植体成活率、丛芽增殖系数、生长状况、生根率、诱导的根长度和根条数等。使用SPSS22.0 和Excel 2010软件进行数据统计分析。
2 结果与分析
2.1 不同消毒时间对外植体消毒的影响
由表1可知不同的消毒时间对外植体污染率和存活率有很大的影响,当用0.1%升汞溶液消毒4 min 时外植体污染率最高为41.89%,外植体存活率最低为58.11%;随着0.1%升汞消毒时间的增加,污染率降低,存活率升高,当用0.1%升汞溶液消毒6 min 时外植体污染率最低为10.67%,存活率最高为89.33%,此时腋芽萌发状态见图1。因此选择最佳消毒处理为A3 处理,酒精清洗30 s+0.1%升汞溶液消毒6 min。
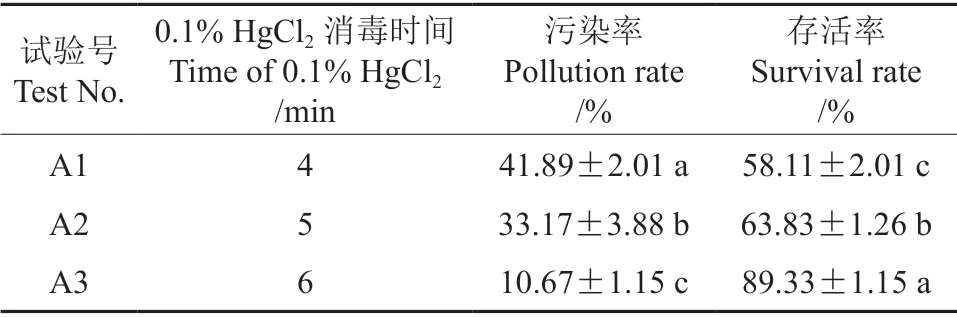
表1 不同消毒时间对外植体污染率的影响†Table 1 The effects of different disinfection time on contamination rate of explants
2.2 继代基本培养基的选择
选取生长健壮、长势基本一致的紫薇芽苗接种到不同基本培养基中,30 d 后统计数据。由表2和图2可知,基本培养基对‘紫玉’紫薇增殖系数呈显著影响,当基本培养基为WPM和1/2 MS时,增殖系数均低,增殖芽苗较少且植株生长较差(图2A—B),增殖系数最低为WPM 培养基培养时(图2A);当基本培养基为改良DKW 和MS 时,长势均较好,但MS 为基本培养基时增殖芽细弱,且小芽多,有效芽苗较少;当基本培养基为改良DKW 时增殖系数最高为4.83,并且生长旺盛,增殖芽健壮,因此选择改良DKW 作为‘紫玉’紫薇继代增殖的基本培养基。

图1 紫薇腋芽萌发Fig.1 Axillary bud germination of Lagerstroemia indica
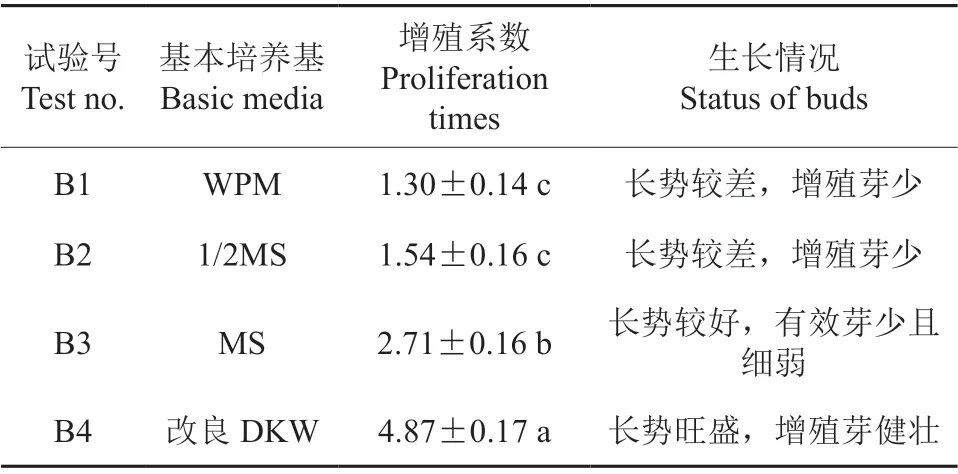
表2 不同基本培养基对继代增殖的影响Table 2 The effects of different basic mediums on subculture proliferation
2.3 不同种类细胞分裂素对增殖的影响
由不同种类细胞分裂素对增殖的影响试验可知,细胞分裂素种类对‘紫玉’紫薇的增殖有着极显著的影响。数据分析可知,B4 处理与B5、B6 处理间的增殖系数存在显著性差异,B4 处理添加细胞分裂素为6-BA 时,增殖系数最高为4.83,且植株长势旺盛,芽健壮;B5 处理和B6 处理的增殖系数差异不明显,增殖系数均较低,B6 处理最低为1.22,且叶枯落,长势差(表3,图3)。因此,‘紫玉’紫薇继代增殖应选择的最适细胞分裂素为6-BA。
2.4 生长调节剂浓度对继代增殖的影响
试验结果表明,细胞分裂素6-BA 浓度和生长素NAA 质量浓度对‘紫玉’紫薇继代增殖产生很大的影响(表4)。由表4可知,细胞分裂素质量浓度和生长素质量浓度均对紫薇组培苗增殖系数由显著影响,当NAA 质量浓度一定时,试管苗增殖系数随着6-BA质量浓度升高先增高后降低;当6-BA质量浓度相同时,NAA 质量浓度增加,增殖系数降低;当6-BA 质量浓度为1.0 mg·L-1,NAA 质量浓度为0.25 mg·L-1时,增殖系数最高为4.87,增殖芽健壮,长势好,多次继代组培苗生长良好(图4);当6-BA 质量浓度为2.0 mg·L-1时增殖系数较大,但增殖芽较细弱,小芽多,多次继代植株长势变弱。因此适合‘紫玉’紫薇继代增殖的细胞分裂素和生长素配比为BA1.0 mg·L-1、NAA0.25 mg·L-1。
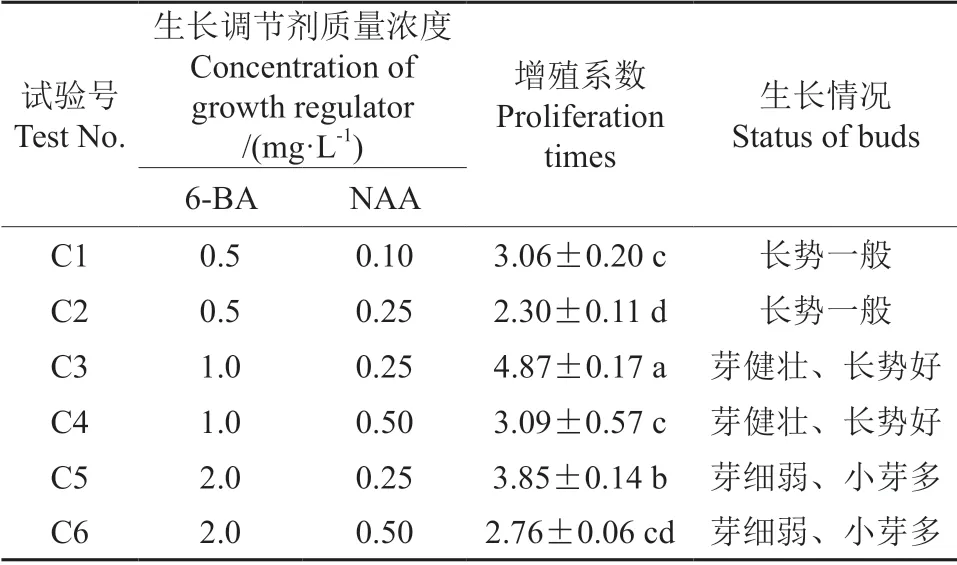
表4 6-BA 质量浓度和NAA 质量浓度对继代增殖的影响Table 4 The effects of 6-BA and NAA concentrations on subculture proliferation
2.5 生根培养以及组培苗移栽

图4 多次继代增殖的‘紫玉’紫薇丛苗Fig.4 Clusterbuds of Lagerstroemiaindica ‘Ziyu’
诱导生根试验结果表明,不同质量浓度的细胞分裂素NAA 和IBA 均对诱导‘紫玉’紫薇生根有很大的影响(表5)。由表5可知,不同质量浓度的NAA 和IBA 各处理,试管苗生根率差异显著,D3 处理生根率最高达到86.50%,此时生长素NAA 质量浓度为0.5 mg·L-1;不同质量浓度的NAA 和IBA 各处理间,诱导生根的根长度差异显著,D2 处理根长度最长为2.95 cm,此时生长素NAA 质量浓度为0.5 mg·L-1;不同质量浓度的NAA 和IBA 各处理,诱导的根条数变化幅度为2.5~2.7 条,各处理间无显著差异。生长素质量浓度为NAA0.5 mg·L-1的D2 处理,组培苗生根率最高,诱导的根长度最长,并且组培苗生长良好,因此,适合‘紫玉’紫薇生根培养添加的生长素质量浓度为NAA0.5 mg·L-1(图5)。
将生根培养得到的生根组培苗(图5)经过7 d炼苗后,移栽到泥炭和珍珠岩体积比为3∶1 的消毒基质中的生根瓶苗存活率高,移栽存活率能达90%以上。

表5 NAA 浓度和IBA 浓度对诱导生根的影响Table 5 The effects of NAA and IBA concentrations on induced rooting

图5 ‘紫玉’紫薇生根苗Fig.5 Rooting seedlings of Lagerstroemia indica ‘Ziyu’
3 结论与讨论
通过研究‘紫玉’紫薇外植体灭菌时间的优化、诱导腋芽萌发、增殖培养基的改良、生根培养基的筛选和移栽生根苗,完成了‘紫玉’紫薇离体再生和组培快繁。
3.1 基本培养基的改良
在紫薇继代增殖过程中不同品种紫薇对基本培养基的需求不相同,如无果紫薇采用MS 为增殖基本培养基[4],黑叶紫薇和‘紫韵’紫薇采用WPM 为增殖基本培养基[9,13],美国红叶紫薇采用ZW(改良的WPM)为增殖基本培养基[7],‘晓明一号’紫薇采用改良DKW为增殖基本培养基[12],这表明不同品种紫薇对基本培养基元素的需求有较大差异。针对‘紫玉’紫薇的增殖基本培养基的筛选发现,在WPM 培养基和1/2 MS 培养基上长势较差,在MS 和改良DKW 培养基上长势较好,但是MS 培养基上增殖芽较细弱,在改良DKW 培养基上长势旺盛,植株健壮,这说明,‘紫玉’紫薇不适合较低浓度矿质元素培养基,较高浓度矿质元素的改良DKW 培养基适合‘紫玉’紫薇增殖培养。
3.2 增殖培养生长调节剂的改良
植物生长调节剂对植物组织培养过程的增殖培养、生根培养等起到了十分复杂并且重要的调节作用。不同的细胞分裂素对不同的植物会产生不同的影响,紫薇的组培增殖培养一般是采用6-BA为细胞分裂素[7-12],也有采用两种细胞分裂素搭配使用,曹受金等[4]和王闯等[19]在进行无果紫薇和矮生紫薇的增殖培养时,采用6-BA 和KT 两种激素搭配使用,增殖效果较好,在筛选适合‘紫玉’紫薇增殖培养的细胞分裂素种类试验中发现,细胞分裂素6-BA 增殖效果最好,增殖系数最高,‘紫玉’紫薇因不适应细胞分裂素KT 和ZT 的培养基,生长缓慢,叶色枯黄,因此KT 和ZT 不适用于‘紫玉’紫薇增殖培养,应选择6-BA 作为‘紫玉’的增殖培养的细胞分裂素。在‘紫玉’紫薇组培苗增殖过程中,适宜质量浓度的细胞分裂素6-BA 和生长素NAA 配合使‘紫玉’紫薇组培苗增殖生长,当6-BA 质量浓度为2.0 mg·L-1时,‘紫玉’紫薇分化芽数量增加但有效芽数量减少,增殖系数降低,这与陈怡佳和蔡能等人的研究不符[7,12],这可能是因为不同基因型对细胞分裂素浓度的适应性的差异,因此选择适宜的6-BA 质量浓度对紫薇增殖十分重要,最适合‘紫玉’紫薇增殖培养的生长素和细胞分裂素质量浓度配比为6-BA 1.0 mg·L-1和NAA 0.25 mg·L-1,此时增殖系数为4.83,增殖芽健壮,生长旺盛,并且多次继代丛芽生长良好。
3.3 生长素诱导生根
培养基中添加不同种类生长素和不同质量浓度生长素均对诱导生根有很大的影响[24-26]。在‘紫玉’紫薇组培苗生根培养过程中,发现生长素种类和质量浓度均对诱导生根有一定的影响,并且不同品种紫薇诱导生根最适生长素种类以及质量浓度有一定的差异,王闯[19]在矮生紫薇的生根研究中发现NAA 为0.5 mg·L-1时生根率最高 为90%,蔡能等[12-13]采用NAA0.1 mg·L-1和NAA0.2 mg·L-1分别对‘晓明一号’和‘紫韵’紫薇诱导生根,生根率均能达到100%。王晓娇、王轲、范淑芳和陈晓航等采用1/2 MS+IBA0.5 mg·L-1分别对‘Pecos’紫薇、云南紫薇、黑叶紫薇、黑钻紫薇进行生根培养,生根率分别为80%、94.6%、98%、100%[9,15-17,22]。曹受金等[4]采用1/2 MS+0.5 mg·L-1NAA+0.1 mg·L-16-BA 诱导无果紫薇生根,生根率为87.5%,吕铭等[23]采用1/2 MS+1.0 mg·L-16-BA+0.1 mg·L-1KT 来进行红叶紫薇的生根诱导,生根率达到100%,这可能与不同品种紫薇不同基因型对生根过程的生长素种类和浓度需求和适应差异有关。作者在‘紫玉’紫薇生根培养过程,发现生长素NAA 比IBA 能更好的诱导生根,并且NAA诱导的根更加健壮,这与蔡能等[12-13]的研究相符合。因此适合‘紫玉’紫薇生根培养的生长素质量浓度为NAA 0.5 mg·L-1,此时生根率为85.19%,根长度为2.95 cm,根条数为2.7 条。
本研究以‘紫玉’紫薇嫩茎为外植体,通过诱导嫩茎腋芽萌发,腋芽增殖培养和生根培养,完成了‘紫玉’紫薇组培快繁研究,为‘紫玉’紫薇工厂化育苗提供了理论基础。

