新辅助放化疗与新辅助化疗对进展期胃癌的疗效及安全性比较*
李欣慧,喻雄杰,张 军,俞远东,狄全书
(十堰市人民医院/湖北医药学院附属人民医院肿瘤中心Ⅲ病区 442000)
胃癌是世界上最常见的恶性肿瘤之一,其发病率和病死率居各种恶性肿瘤的第二位,仅次于肺癌,5年生存率仅5%~15%[1]。早期胃癌缺乏特异征象,很大一部分患者就诊时已为进展期胃癌,虽可勉强行根治性手术切除,但因其微小转移灶的存在,术后易出现复发或转移,总体预后较差。单纯通过扩大淋巴结清扫范围、联合脏器切除等手术方式已经无法给患者带来更多益处[2]。国外AJANI等[3]最早开展的RTOG9904试验证实,新辅助放化疗可提高局部晚期胃癌患者的R0切除率及病理完全缓解率(pathological complete remission,pCR)。CUNNINGHAM等[4]在2005年ASCO大会上报告的MAGIC研究证实新辅助化疗在局部晚期胃癌中具有重要的作用。国内关于局部进展期胃癌新辅助化疗的研究报道较多,新辅助放化疗的研究报道较少,关于两种方案疗效的对比报道则更少[5]。本研究回顾分析本院术前新辅助放化疗与新辅助化疗对进展期胃癌的治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
收集本院肿瘤科及胃肠外科2014年5月至2017年6月收治的局部进展期(ⅢA~ⅢC期)胃癌患者48例,男34例,女14例,年龄29~68岁,平均(55.8±6.2)岁;其中新辅助放化疗组(观察组)21例,新辅助化疗组(对照组)27例。纳入标准:(1)均行胃镜病理活检确诊为胃癌,未并发其他恶性疾病;(2)均进行CT或PET-CT联合超声胃镜检查,依据美国癌症联合委员会(AJCC)第七版TNM分期标准,证实为ⅢA~ⅢC期局部进展期胃癌;(3)所有患者血常规、肝功能、肾功能、心电图、凝血功能正常,无传染性疾病,无严重心、肺、肝、肾等疾病,Karnofsky评分大于或等于80分,无放化疗及手术禁忌证。两组患者的一般资料(年龄、性别、分期、病变部位、病理类型、组织学分级)比较,差异无统计学意义(P>0.05),具有可比性,见表1。
1.2 观察组放疗方案
患者采用仰卧位,定位及放疗前胃排空,口服牛奶250 mL,以3 mm层厚行增强CT扫描,扫描上界在膈肌上3 cm,下界在第5腰椎水平。采用Varian 21EX直线加速器,6 MV X线,束流调强放疗(intensity-modulated radiotherapy,IMRT)进行放射治疗。据治疗前胃镜检查结果及CT影像勾画肿瘤原发病灶(GTV)及淋巴结转移灶(GTVnd),亚临床区(CTV)包括肿瘤病灶外1~1.5 cm及淋巴引流区,计划肿瘤靶区(PGTV)、计划转移淋巴结区(PGTVnd)、计划亚临床靶区(PCTV)分别为GTV、GTVnd、CTV外扩5 mm,并勾画脊髓、双肾、肝脏、胰腺、十二指肠、结肠、小肠等危及器官。通过影像学系统验证,危及器官剂量在RTOG标准安全范围,保证95%PGTV、PGTVnd、PCTV剂量为46.8~50.4 Gy,单次剂量1.8 Gy,周一至周五每天1次,共放疗5~6周。
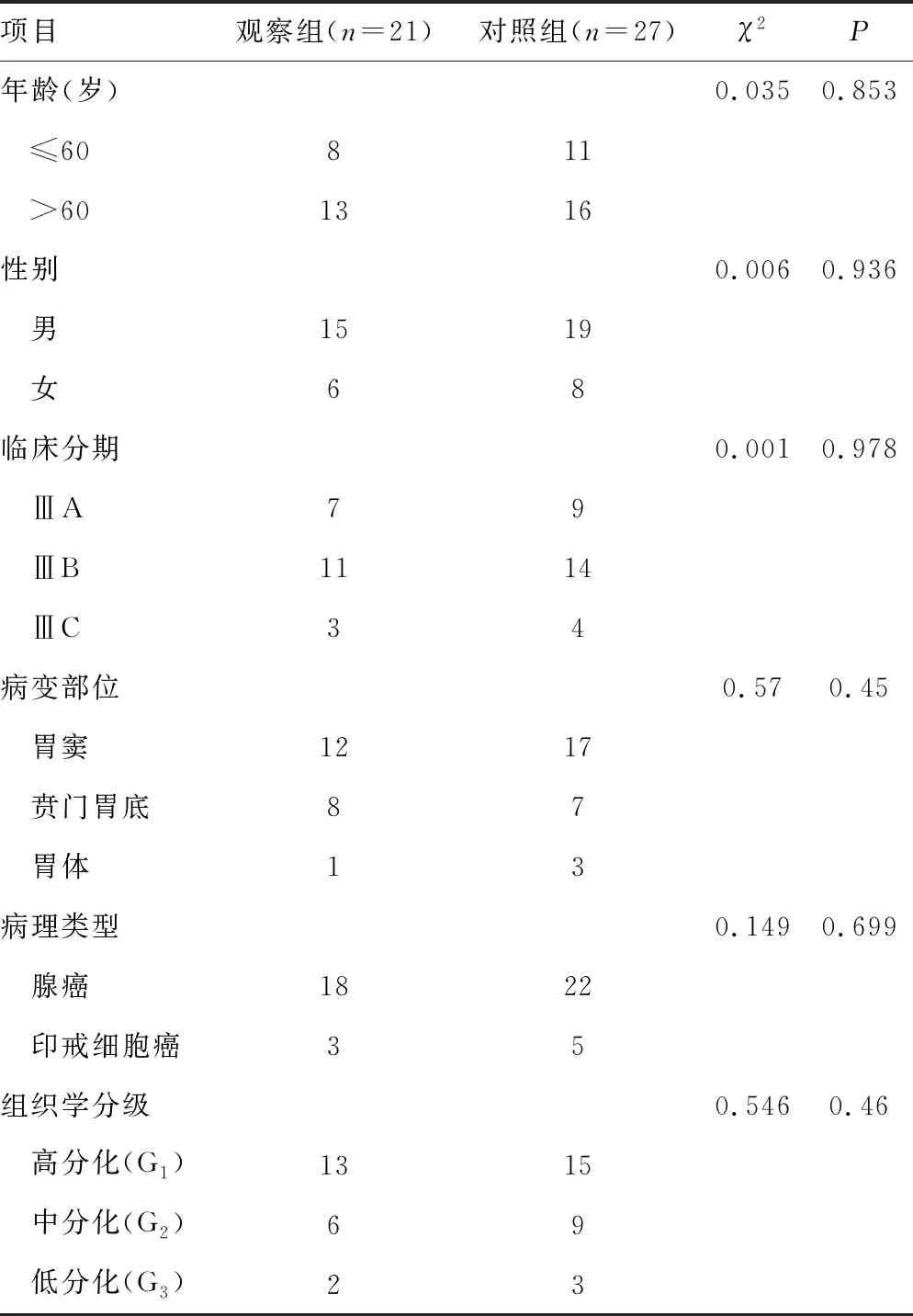
表1两组患者的一般资料(n)
1.3 观察组化疗方案
观察组放疗期间行XELOX方案[奥沙利铂100 mg/m2第1天+卡培他滨每次825 mg/m2(第1~14天,每天2次)每3周为1个周期]化疗2个周期,放疗后6~8周行D2根治术,术后根据中国临床肿瘤学会(CSCO)指南是否存在高危因素(T3以上、N+、低分化、印戒细胞癌、脉管瘤栓及年龄小于50岁)行4个周期的辅助化疗。
1.4 对照组化疗方案
术前行XELOX方案[奥沙利铂130 mg/m2第1天+卡培他滨每次1 g/m2(第1~14天,每天2次)每3周为1个周期]化疗4个周期,化疗后4~6周行D2根治术,术后根据CSCO指南是否存在高危因素行4个周期的辅助化疗。
1.5 手术方法
根据治疗前胃镜检查结果及影像学表现、术中探查情况,对位于胃上部的肿瘤行近端胃大部分切除,胃中部的肿瘤行全胃切除,胃下部的肿瘤行远端胃大部分切除;采用食管、胃空肠Roux-en-Y吻合术或BillrothⅡ式胃空肠吻合术,手术时常规行D2淋巴结清扫。
1.6 观察指标
采用电话和门诊、住院复查的方式进行随访,截止时间为2019年7月。随访时间为25~60个月,平均(43.6±5.3)个月。比较两组的客观缓解率(objective response rate,ORR)、pCR、R0切除率、中位无进展生存期(progression-free survival,PFS)、中位总生存期(overall survival,OS)及不良反应发生率。不良反应按照世界卫生组织(WHO)2009年抗肿瘤药物不良反应评分标准(NCI-CTC4.0)进行评价。采用RECIST评价临床疗效。
1.7 统计学处理
采用SPSS 17.0软件进行统计分析。计数资料以百分率表示,采用χ2检验,检验水准为α=0.05;中位PFS、中位OS生存分析采用Kaplan-Meier法并行Log-rank检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组ORR比较
观察组完全缓解率(CR)为42.86%,对照组CR为14.81%,差异具有统计学意义(χ2=4.704,P=0.030);但两组的ORR分别为80.95%和74.07%,差异无统计学意义(χ2=0.316,P=0.574),见表2。
2.2 两组pCR及R0切除率比较
观察组pCR为33.33%,明显高于对照组(7.41%),两组间差异具有统计学意义(χ2=5.103,P=0.024);观察组R0切除率为66.67%,也明显高于对照组(37.04%),两组间差异也具有统计学意义(χ2=4.148,P=0.042),见表3。
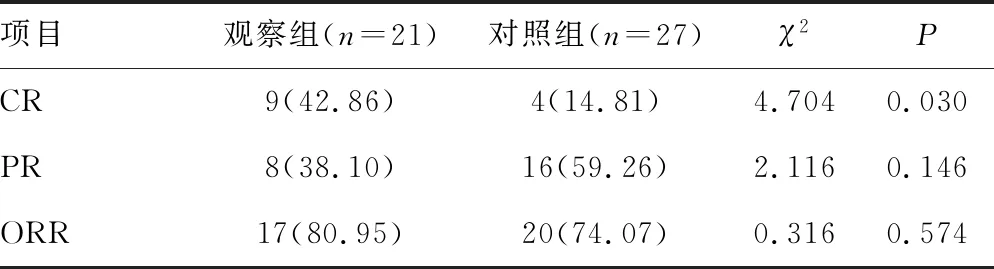
表2 两组患者的ORR比较[n(%)]
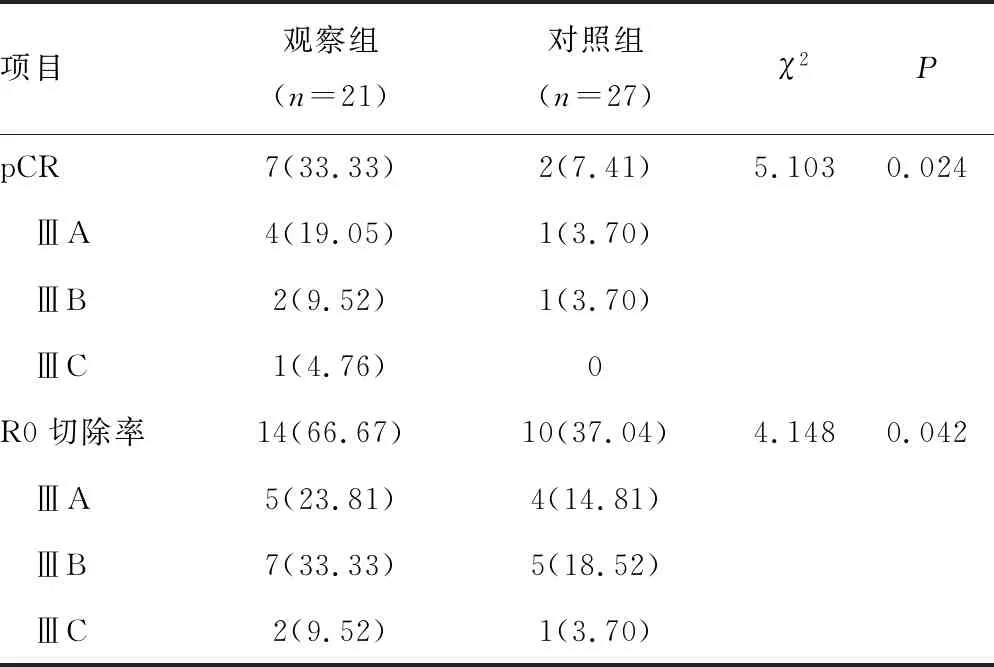
表3 两组患者pCR及R0切除率比较[n(%)]
2.3 两组中位PFS及中位OS比较
观察组中位PFS为41.00个月(95%CI:35.28~53.06个月),长于对照组的27.00个月(95%CI:22.51~36.58个月),差异具有统计学意义(χ2=4.602,P=0.032),见图1;观察组的中位OS为44.00个月(95%CI:40.85~56.42个月),长于对照组的38.00个月(95%CI:26.58~41.77个月),差异也具有统计学意义(χ2=4.205,P=0.040),见图2。
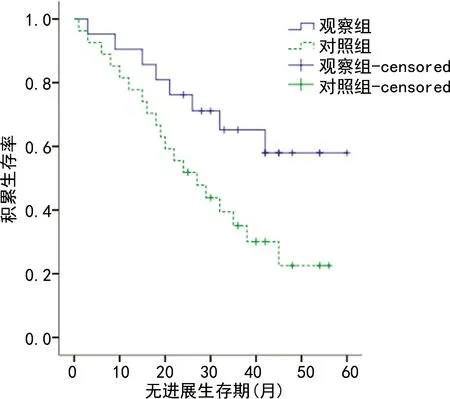
图1 观察组与对照组的无进展生存曲线
2.4 两组的不良反应比较
两组均未发生Ⅳ度不良反应,其中观察组的白细胞减少发生率(23.81%)和手足综合征发生率(14.29%)低于对照组(51.85%和40.74%),两组间差异具有统计学意义(χ2=3.884,P=0.049;χ2=4.002,P=0.045);两组在血小板减少、恶心呕吐及腹泻发生率方面差异均无统计学意义(P>0.05),见表4。
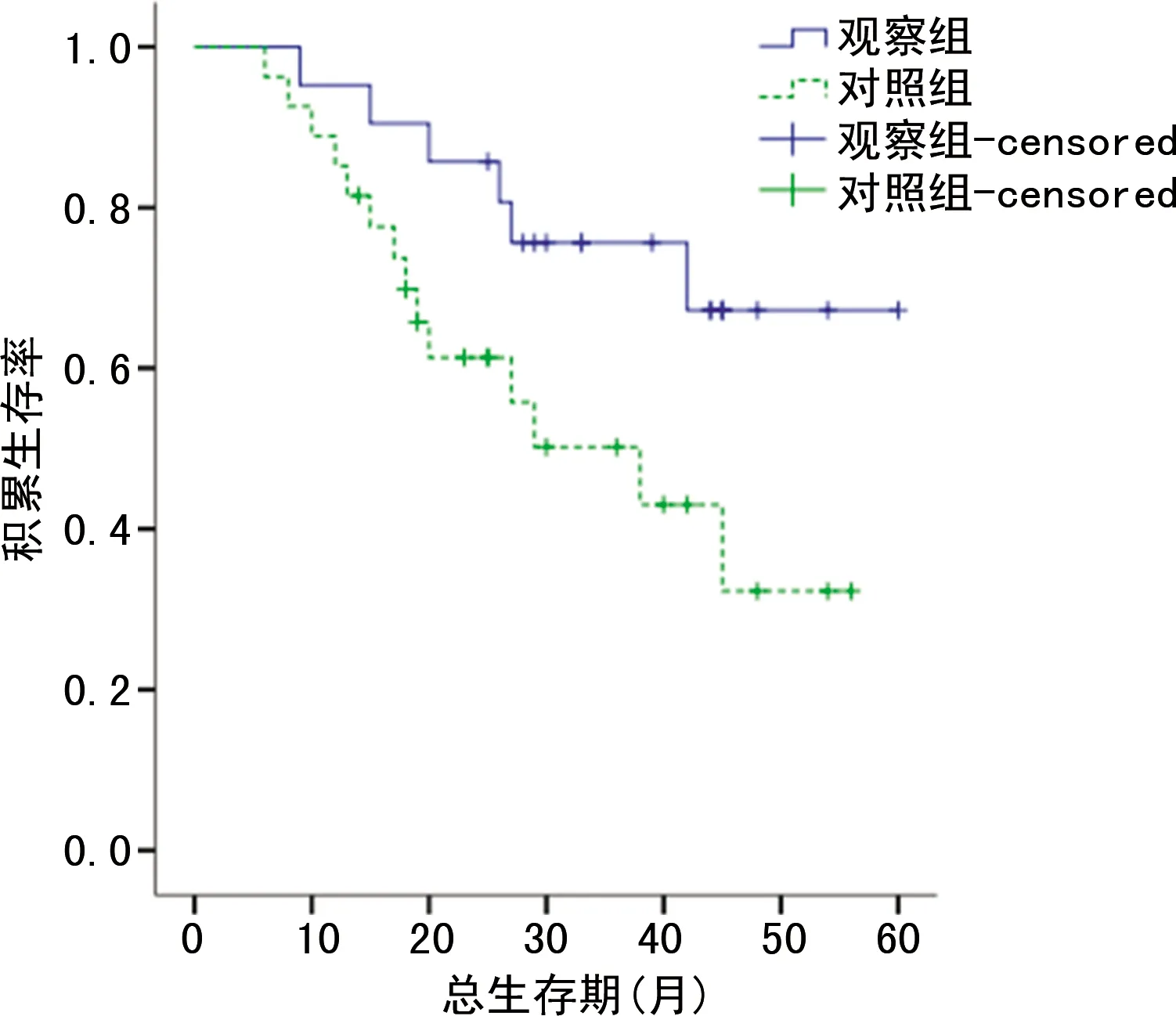
图2 观察组与对照组的总生存曲线
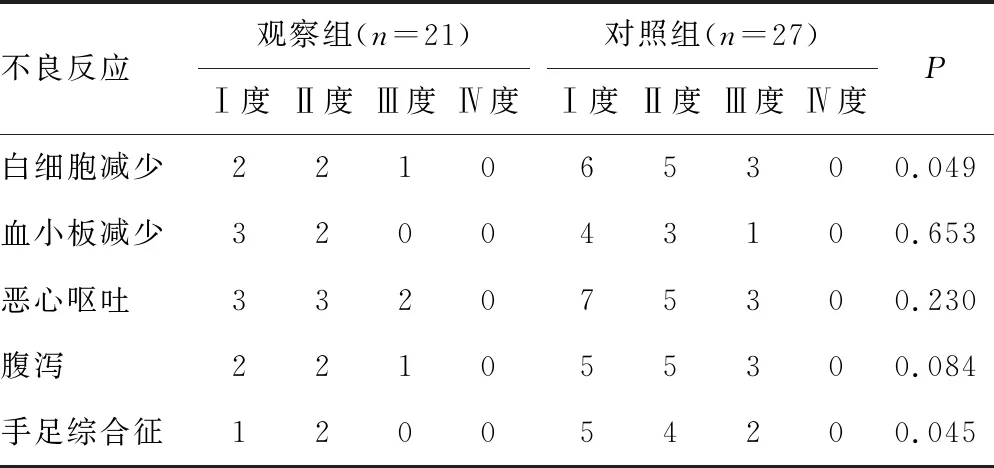
表4 两组患者的不良反应比较(n)
3 讨 论
据2018年发布的世界癌症数据统计,2012年全世界共有95.2万新增胃癌病例(占癌症新增病例总数的7%)和72.3万死亡胃癌病例(占癌症死亡病例总数的9%),超过2/5的新增病例发生在中国[6]。根据国家癌症中心的数据,2014年以来,我国胃癌发病率及死亡率仅次于肺癌,位居第二。3/4以上的患者确诊时已为胃癌晚期,胃癌分别占男性癌症死亡人数的15.5%和女性癌症死亡人数的13.3%[7]。由于局部进展期胃癌无法行根治性切除,因此,临床研究者一直寻求新辅助的方法使肿瘤缩小,以期达到根治性切除的目的。
新辅助化疗患者耐受性好,能使肿瘤的临床分期降低,给手术创造了有利的条件,并能抑制微小病灶的生长,降低术后复发率,提高生存期[8]。其中,CUNNINGHAM等[4]的MAGIC研究表明,与单纯手术组相比,术前使用表柔比星、顺铂和氟尿嘧啶联合的ECF方案化疗,可提高患者R0切除率(79%vs.69%)和5年OS率(36%vs.23%)。但三药联合化疗不良反应发生率高,中国人对上述药物耐受性差,临床应用并不广泛。国内ZHENG等[9]研究发现,XELOX新辅助化疗治疗进展期胃癌有效率为62.9%,疾病控制率为91.5%,3年OS率为77.1%,3年无病生存率为74.3%。YU等[10]采用XELOX方案对54例局部进展期胃腺癌患者进行新辅助化疗,其中R0切除率83.3%,客观有效率为50.0%,中位随访时间为52.97个月,中位PFS为20.10个月,中位OS为30.77个月,3~4级不良事件发生率为8.5%。上述研究均证实XELOX新辅助化疗方案毒副作用小,能提高患者的手术疗效。
虽然新辅助化疗可延长局部进展期胃癌患者的生存期,但延长时间有限,仍有大部分患者发生复发或转移,5年OS率不足40%[8]。因此,研究者们尝试在新辅助化疗的基础上联合放疗,以期进一步提高局部进展期胃癌患者的生存率。LIU等[11]对36例晚期胃癌或食管胃结合腺癌患者,术前采用放疗联合两个周期的SOX方案(奥沙利铂联合替吉奥胶囊)化疗,术后pCR为13.9%,随访3年,平均存活时间为30.3个月,证明术前放化疗能提高局部晚期胃癌或食管胃结合腺癌患者的3年无病生存率。王鑫等[12]初步探讨采用放疗联合不同化疗方案治疗潜在可切除或不可切除的局部进展期胃癌患者11例,其中接受R0切除率81.8%,pCR 9.1%,发生3级不良反应5例,无4级不良反应,初步证明术前同步放化疗有助于提高局部进展期胃癌患者R0切除率,不良反应可耐受。
本研究中观察组的pCR为23.81%,R0切除率为66.67%,ORR为80.95%,与YU等[10]单纯采用XELOX方案作为新辅助化疗治疗局部进展期胃癌的研究比较,ORR高于YU等[10]报道的50.0%,与放疗使肿瘤缩小有关;R0切除率低于YU等[10]报道的83.3%,可能与其入组患者分期相对早及放化疗后手术难度增加有关;YU等[10]报道的R0切除率高于本研究的对照组,其对照组pCR率为7.41%,R0切除率为37.04%,与术前放疗降低临床分期有关。随访25~60个月观察组的中位PFS为41个月,中位OS为44个月,均高于YU等报道的中位随访时间52.97个月,中位PFS 20.10个月,中位OS 30.77个月;同时本研究观察组中位PFS、中位OS也高于对照组,对照组的中位PFS为27个月,中位OS为38个月,可能与放疗提高了局部控制率,从而提高了总生存率有关。通过对比分析,证实在化疗的基础上联合放疗,可提高患者的肿瘤切除率、延长患者的生存期。由于本研究对一些术后存在高危因素的患者,根据CSCO指南进行了术后辅助性化疗,也降低了术后的局部复发率和远处转移率,故本研究的中位PFS和中位OS也高于其他同类的研究。
此外,笔者对观察组和对照组的化疗采用了不同的药物剂量,即观察组的化疗药物剂量在对照组的基础上减量20%,在不降低疗效的基础上降低了不良反应。因此观察组不良反应的发生率并不高,虽然在临床观察中发现观察组恶心呕吐、纳差乏力的患者较多,但与对照组比较差异无统计学意义,可能与样本量偏少有关;由于观察组术前化疗次数的减少,因此白细胞减少发生率和手足综合征发生率低于对照组,分别为23.81%vs.51.85%、14.29%vs.40.74%,证实新辅助放化疗安全有效,不良反应可控。本研究证实,局部进展期胃癌术前采用IMRT联合低剂量XELOX方案的新辅助放化疗,安全有效,不良反应发生率低,值得临床推广。
由于本研究为回顾性分析,且存在入组病例少及随访时间短等不足,需后期开展多中心的前瞻性试验,纳入更多符合标准的病例并进行更长时间的随访,使试验结论更加可靠。

