不同剂量纳米TiO2对小鼠肠道微生物的影响
董萌,杨晨,史婷婷,杨柳,刘东青,丘汉青,林影,路福平,赵化冰*
(1.天津科技大学生物工程学院工业发酵微生物教育部重点实验室,天津 300457;2.华南理工大学生物科学与工程学院,广东 广州 510006)
二氧化钛(TiO2)是钛元素的一种天然氧化物。这种物质在自然界中以3种矿物化合物的形式出现,即锐钛矿、金红石和板钛矿。近年来,TiO2纳米粒子由于其良好的理化性能,在涂料、废水处理、杀菌、化妆品、食品添加剂、生物医用陶瓷和植入生物材料等领域得到了越来越多的应用[1]。在食品行业中,TiO2作为食品添加剂应用于糖果、奶酪、酱料、脱脂牛奶和冰淇淋等产品中。同时,它也被用作风味增强剂应用于各种非白色食品,包括干蔬菜、坚果、种子、汤、芥末以及啤酒和葡萄酒[2]。此外,TiO2可直接用于与食品接触的包装材料,如瓶子、牛奶盒和包装箔等[3-6]。2012年,Weir等[7]检测了89种食品的总TiO2含量,结果显示平均钛含量达3.59 mg/g。并且研究发现,糖果、口香糖和蛋糕等甜食类副食品中含有更高剂量的TiO2,其中约1/3颗粒的粒径属于纳米级别。1966年美国食品药品监督管理局(Food and Drug Administration,FDA)提出,允许将TiO2作为色素添加剂加入食品中,其含量不应超过食品总重量的1%[8]。我国对于食品中TiO2的最大使用量有着严格的规定:蛋黄酱、沙拉酱不超过0.5 g/kg,可可制品等不超过2.0 g/kg[9]。但目前缺乏专门针对颗粒形态和粒径的限制[10-11]。纳米TiO2因其体积小、单位质量表面积大、反应活性高等特点,不仅能够通过食品迁移至人体内,还能够对人体肠道微生态造成影响,给人类的健康带来更大的潜在风险。
纳米TiO2颗粒进入体循环后,会迁移到各种器官和组织,使人体的肾脏、肺、脑等组织和器官产生病变[12]。纳米TiO2的暴露会引起实验动物的肺部炎症反应,进而增加肺癌的患病几率[13]。Ze等研究表明,纳米TiO2可以在脑内移位和积聚,导致氧化应激、胶质细胞过度增殖、组织坏死以及海马细胞凋亡[14]。Gui等报道了纳米TiO2在肾脏内积累,可引起肾脏炎症、细胞坏死和功能障碍[15]。而肠道作为纳米TiO2摄入后的停留时间最久的器官,更易受影响。在上皮细胞和动物身上进行的毒性评估表明,纳米TiO2可以在肠道内积聚,通过肠道屏障,氧化应激和遗传毒性诱导毒性,并破坏肠道和全身免疫稳态[16-20]。此外,长期大量口服含纳米TiO2添加剂的食品可能会增加直肠癌发生的风险[21]。
肠道微生物组已经是公认的类器官,对人类健康至关重要,在特定条件下,微生物失调可导致多种疾病[22-23]。有研究显示,纳米TiO2可引起肠道菌群失衡,降低双歧杆菌和乳酸菌两种典型益生菌的丰度[24]。纳米TiO2对肠道微生物的影响与染毒剂量、粒径、晶型等因素密切相关,所以不同的实验条件可能会产生相互矛盾的实验结果。因此,有必要进一步积累相关研究数据,加强对纳米TiO2在食品领域应用的安全性及风险的评估。
本研究以C57BL/6小鼠为研究对象,利用不同剂量的纳米TiO2悬浮液进行连续灌胃染毒实验,持续28 d,建立纳米TiO2单一亚急性暴露模型,并采用宏基因组学方法探究其对C57BL/6小鼠肠道微生物群落的影响。
1 材料与方法
1.1 实验动物及试剂
锐钛矿型纳米TiO2:Sigma-Aldrich,粒径小于25nm。实验选用三周龄C57BL/6小鼠,24只,雌雄各半,体重18 g~22 g。小鼠饲养在聚丙烯笼中,做好标识。饲养环境温度保持在20℃~22℃,相对湿度50%~70%,小鼠置于12 h/12 h光照与黑暗交替周期循环的环境中饲养,并保证环境的干净卫生。
实验开始前,小鼠需提前适应环境7 d,所有的相关操作按照动物实验标准规范操作。小鼠被随机分为4组,分别为对照组和暴露组,连续28 d进行灌胃。暴露剂量分别为10、100、1 000 mg/(kg·BW)。其中,100 mg/(kg·BW)相当于爱吃甜食的青少年的摄入量[25]。对照组每天灌胃同等体积的磷酸缓冲盐溶液(phosphate buffer saline,PBS)。使用 PBS配制纳米 TiO2悬浮液,每次灌胃前进行超声破碎,并充分振荡混匀。在饲养期间,每天观察小鼠的精神状态、饮食饮水情况及死亡率,每周记录小鼠的体重。
1.2 仪器与设备
-80℃超低温冰箱:美国Thermo Scientific Forma公司;SCIENTA-950E超声波细胞破碎仪:宁波新芝生物科技股份有限公司;恒桂牌DT系列电子天平:常熟市佳衡天平仪器有限公司;TGL-16C台式离心机:上海安亭科技仪器厂。
1.3 方法
1.3.1 脏器系数
实验建模成功后,眼球取血处死小鼠,皮肤用酒精消毒后,立即打开腹腔取其脏器组织,用生理盐水洗涤两次,滤纸吸干后称重,按公式C/%=(m1/m2)×100计算脏器系数。
式中:C 为脏器系数,%;m1为器官湿重,g;m2为小鼠体重,g。脏器组织置于-80℃冰箱保存。
1.3.2 粪便样品的采集及保存
采样者佩戴口罩和无菌手套,每周定期用已灭菌的镊子收集小鼠新鲜粪便(灌胃后2 h取)。称重后,将粪便平均分成两份,一份直接放置于-80℃冰箱保存。另一份则放在生理盐水∶甘油(7∶3,体积比)混合液中振荡混匀(100 mL混合液中约10 g粪便),放置-80℃冰箱中保存。前者适于短期保存,后者适于长期保存。这样的方式可以更好的保证粪便中的菌活性。使用QIAampDNA粪便迷你试剂盒,提取细菌总DNA。利用琼脂糖凝胶电泳检测DNA的质量,采用分光光度计测量DNA纯度及浓度,保存于-20℃冰箱中备用。
1.3.3 肠道微生物组分析
为了探究纳米TiO2不同的染毒剂量对小鼠肠道微生物群落的影响,对小鼠肠道微生物进行了16S rDNA基因测序分析。测序部分由深圳华大股份有限公司执行,主要测序实验过程如下:取质量合格的小鼠粪便DNA样品及对应融合引物配置聚合酶链式反应(polymerase chain reaction,PCR)体系,进行 PCR扩增,建立数据库。使用Hiseq平台对16S rDNA的V3~V4区域进行测序,并对结果进行过滤,将高质量的Clean data用于后期数据分析,通过reads之间的重叠关系将其拼接成Tags,并聚类成操作分类学单元(operational taxonomic units,OTU)并与 Greengenes和 R DP 数据库进行比对和物种注释。基于上述测序结果进行后续样品物种复杂度分析,组间物种差异分析等。
1.4 统计学分析
数据分析采用软件SPSS 16.0处理,各组以变异数ANOVA进行比较分析,数据用均数±标准差(mean±SD)表示,P<0.05为差异有统计学意义。
2 结果与分析
2.1 纳米TiO2对小鼠体重的影响
在整个实验期间,每周记录一次小鼠体重。图1为小鼠连续28 d暴露于不同染毒剂量组的体重增长变化图。
由图1可以看出,小鼠的体重均有所上涨。其中,雌性小鼠随着染毒剂量的增加,体重的增加量整体呈下降趋势。Chen等对SD大鼠脂质代谢的研究也同样发现了这种趋势,大鼠暴露于纳米TiO2连续90 d,随着时间推移,与对照组相比,较大剂量组的大鼠体重增加逐渐变缓[26]。但本实验中,类似的趋势在雄性小鼠中并不明显,考虑可能是由于纳米TiO2对雄性小鼠激素水平造成的影响不如对雌性小鼠大,或者是小鼠个体间差异造成的。另外,不排除可能由于摄入纳米TiO2而减少了小鼠对营养的吸收,导致了小鼠体重增长缓慢。

图1 小鼠体重增长变化Fig.1 Changes in weight gain of mice
2.2 纳米TiO2对小鼠脏器指数的影响
脏器指数是指实验动物某脏器的重量与其体重之比。正常时各脏器与体重的比值比较恒定。动物染毒后,受损脏器重量可能会发生改变,所以脏器指数也随之变化。脏器指数增大,说明脏器充血、水肿或者增生等;脏器指数减少,说明脏器萎缩或者其它病理学的改变[27]。据前人的研究报道,纳米TiO2的暴露会对脾脏、肾脏等脏器造成损伤[28-29]。脏器指数见表1。本文研究结果表明,与对照组相比,各染毒组均对小鼠心、肝、脾、肺和肾的脏器指数差异不显著。这可能是由于暴露方式、剂量不同以及材料本身等差异造成的。虽然本结果表明口服纳米TiO2颗粒28 d还不足以引起明显可见的器官损伤,但是不排除器官功能的恶化。

表1 脏器指数Table 1 Viscera indices
2.3 肠道微生物组分析
2.3.1 α多样性稀释曲线
α多样性稀释曲线是用来验证数据量是否足以反映物种多样性,间接反映样品的丰富度程度。当曲线趋于平坦时,说明测序深度已基本覆盖样品中所有的物种;反之则表示样品中物种多样性较高,还存在较多未被测序检测到的物种。各样品的稀释曲线见图2。
根据研究结果,观察到香农指数(图2a)和辛普森指数(图2b)稀释曲线随着序列的增多趋于平缓,表明数据量基本覆盖了肠道样本中所有群落物种。
图2 各样品的稀释曲线Fig.2 Dilution curves of each sample
2.3.2 OTU聚类及分析
根据16s rDNA基因测序结果,共获得1 535 340条序列。其中检测到对照组(Ti.0)序列383 573条,10 mg/(kg·BW)染毒组(Ti.10)序列382 469 条,100 mg/(kg·BW)染毒组(Ti.100)序列383 898条,1000 mg/(kg·BW)染毒组(Ti.1000)序列385 400条。利用操作分类学单元(operational taxonomic units,OTU)根据rRNA序列相似性对微生物多样性进行菌株分类。图3为OTU的比较结果。
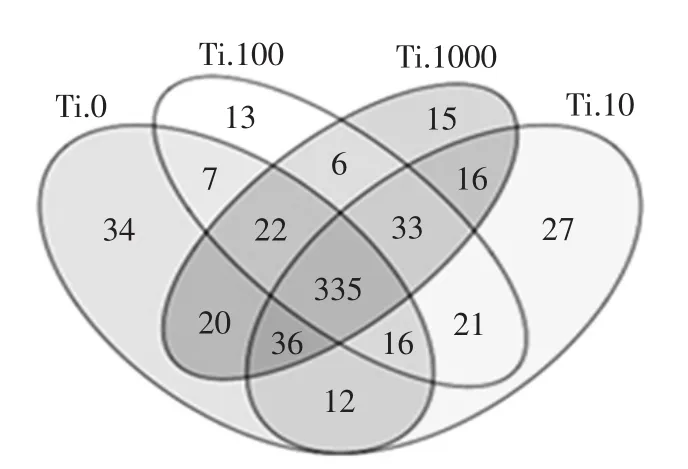
图3 OTU的比较Fig.3 Comparison of OTU
图中不同颜色图形代表不同组别,两两交叠部分数字为两组之间共有的OTU个数,多重交叠部分数字为多个组别之间共有的OTU个数。共获得1 914个OTU,其中对照组482个OTU,10 mg/(kg·BW)染毒剂量组496个OTU,100 mg/(kg·BW)染毒剂量组453个OTU,1 000 mg/(kg·BW)染毒剂量组483个OTU。
2.3.3 α多样性盒形图
人和动物肠道内定植着庞大的微生物群体,这些微生物在代谢膳食营养、促进免疫系统发育、抵抗病原微生物入侵等方面发挥重要作用[30]。近年来研究发现,许多的肠道疾病可能与肠道微生物多样性或者丰度的变化有关。α多样性是对单个样品中物种多样性的分析,包括香农指数、辛普森指数等。其中,香农指数来源于信息熵,指数越大,表明不确定性越大,不确定性越大,则表明群落未知因素越大也就是多样性高。辛普森指数值越大,说明群落多样性越低。α多样性盒形图见图4。

图4 α多样性盒形图Fig.4 α diversity box diagram
比较群落的物种多样性后发现,与对照组相比,10、100、1 000 mg/(kg·BW)的染毒剂量组的香农指数升高(图4a),辛普森指数降低(图4b),这表明摄入不同剂量的纳米TiO2均有可能导致动物肠道微生物群落物种多样性的增加。并且随着纳米TiO2摄入剂量的增加,物种的多样性也随之增加。这与Li等[31]的研究结果相似。
2.3.4 纳米TiO2对小鼠肠道微生物菌落组成的影响
为了得到每个OTU对应的物种分类信息,采用RDP classifier贝叶斯算法对OTU代表序列进行分类学分析。各样品的物种丰度柱状图见图5。通过物种柱状图直观地展示了由门到种各样本物种组成及比例,反映了样本间物种的变化情况。比较了微生物组在门和属水平上的组成。
基于门水平上的微生物菌落结构进行分析,共发现4个主要菌门,分别是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)和变形菌门(Proteobacteria)。与对照组相比,随着纳米TiO2染毒剂量的增加,疣微菌门和变形菌门的相对丰度减少,厚壁菌门的相对丰度增加。此前有研究表明,小鼠肠道菌群失调,肠道内变形菌门数量会减少,厚壁菌门数量会增加[32]。并且,变形菌门的增加是肠道损伤和肠道功能障碍的常见现象[33]。

图5 各样品的物种丰度柱状图Fig.5 Histogram of species abundance of samples
此外,部分小鼠摄入纳米TiO2后,肠道菌群中出现TM7细菌(图5a)。有研究表明,TM7细菌在人类结肠中存在,可能在具有环境影响的炎症性胃肠疾病中扮演炎症促进因子的角色[34]。
基于属水平上的微生物菌落结构进行分析,暴露组的小鼠肠道中出现了微生物群落的共同适应,包括梭菌属(Clostridium)、拟杆菌属(Bacteroides)、萨特氏菌属(Sutterella)和阿尔曼菌属(Akkermansia)的相对丰度减少,普雷沃氏菌(Prevotella)的相对丰度增加(图5b)。其中,普雷沃氏菌可在某些葡萄糖代谢中发挥作用,促进糖原的储存,从而导致血糖增加[35]。阿尔曼菌是从人粪便样品中分离出的一种细菌,也是目前唯一可培养的疣微菌门肠道微生物。有多项研究发现,在人类许多疾病中(如炎症性肠病、孤独症、肥胖等)阿克曼菌丰度均减少[36-38]。
综上所述,研究结果支持了以下观点:摄入纳米TiO2可能会改变肠道微生物区系结构,且随着纳米TiO2染毒剂量的增加,对小鼠肠道产生了一定的消极影响。
2.3.5 小鼠肠道微生物菌群物种差异分析
为了确定微生物标志物,通过LEfSe分析(LDA>2)检测到由门到种共17种细菌显示出统计学差异。在分支进化图中,由内至外每一圈代表一个层级,依次为门、纲、目、科、属水平。小圆圈直径和相对丰度大小成正比。LEfSe分析聚类图见图6。
如图6所示,对照组、Ti.10组、Ti.100组和Ti.1000组之间有17个显著差异的生物类群。其中4个菌在对照组富集,包括Bifidobacterium(双歧杆菌属)、Bifidobacteriaceae(双歧杆菌科)、Bifidobacteriales(双歧杆菌目)、Actinobacteria(放线菌);5个菌在Ti.10组富集,包括Bacteroidales(拟杆菌属)、Bacteroidia(拟杆菌目)、Bacteroidetes(拟杆菌门)、Coprococcus(粪球菌属)、Desulfovibrio(脱硫弧菌属);4个菌在Ti.100组富集,包括 Prevotellaceae(普雷沃氏菌科)、Prevotella(普氏菌属)、Enterococcaceae(肠球菌科)、Enterococcus(肠球菌属);4个菌在Ti.1000组富集,包括Helicobacteraceae(螺杆菌科)、Flexispira(螺杆菌属)、Campylobac terales(弯曲菌目)、Epsilonproteobacteria(ε-变形细菌)。由此可以看出,随染毒剂量的变化,所富集的具有代表性的微生物各不相同。

图6 LEfSe分析聚类图Fig.6 LEfSe analysis cluster diagram
在对照组中肠道有益菌双歧杆菌(Bifidobacterium)起重要作用。在Ti.100组中,普雷沃氏菌(Prevotellaceae)富集。普雷沃氏菌通常与慢性炎症相关,在炎症性肠病患者粪便中相对丰度较高[39-40]。而幽门螺旋杆菌(Helicobacter pylori)在Ti.1000组影响较大。幽门螺旋杆菌是慢性幽门螺旋杆菌胃炎、消化性溃疡等疾病的致病因素之一。上述结果表明了纳米TiO2可能会诱发小鼠胃肠道炎症,增加小鼠患病风险。
3 结论
食品添加剂的不当使用会给人体健康带来很多潜在的危害。纳米TiO2作为常见的食品添加剂,对人体的影响不容忽视。TiO2纳米颗粒在奶酪、糖果和布丁等食物中的广泛存在极大地增加了它们的摄取和积累,特别是在年轻人中。肠道作为人体吸收食物营养的第一道关卡,易受外源性物质的影响。纳米TiO2对肠道微生物的影响十分复杂,其毒理机制也尚不清楚。因此,研究纳米TiO2对小鼠肠道微生物的影响,不仅是重要的科学问题,也是食品行业健康可持续发展的基础和重要保障。
本文针对不同剂量的纳米TiO2对小鼠进行单一亚急性暴露染毒实验,阐述了纳米TiO2对肠道微生态的潜在影响。口服是人类接触日常环境中存在的纳米颗粒的主要途径,所以选定的给药方式是口服灌胃给药。对于染毒剂量,选择了相当于喜欢糖果和巧克力的儿童的摄入量。研究结果表明,纳米TiO2增加了小鼠肠道微生物群落的多样性。且随着染毒剂量的增加,小鼠肠道微生物群落组成也随之变化,主要表现为厚壁菌门相对丰度增加,双歧杆菌属和拟杆菌属相对丰度减少。在100 mg/kg·BW和1 000 mg/kg·BW的暴露组中,普雷沃氏菌和幽门螺旋杆菌的相对丰度显著增加。结果表明纳米TiO2颗粒会改变人体肠道微生物区系,并可能会增加胃肠道疾病的患病几率。
本研究结果显示纳米TiO2会对肠道菌群相对丰度产生不同程度的影响,这为TiO2纳米颗粒的进一步的安全应用提供了参考依据。然而,对于慢性摄入纳米TiO2的累积效应以及高浓度纳米TiO2对肠道微生态的影响尚不明确。并且,市面上纳米材料种类繁多,暴露的途径、时间等不确定性都给人类健康带来威胁。因此,对有关含有纳米材料生物安全性再评价的研究工作刻不容缓。

