抗炎合剂通过TLR4/MyD88/NF-κB通路抑制脂多糖诱导的过表达高迁移率蛋白-1转染小鼠巨噬细胞系RAW264.7细胞炎症反应的机制研究※
闫国良 李淑芳 王馨璐 孙 雪 汪海慧
(上海中医药大学附属市中医医院急诊科,上海 200070)
脓毒症是临床较为常见的急危重症疾病。流行病学调查显示,全世界脓毒症患者超过3 000万,严重脓毒症患者超过2 000万[1],是ICU中首位死亡原因,其中脓毒性休克的死亡率超过40%[2]。脓毒症进展过程复杂,不仅与全身炎症反应有关,也与代偿性抗炎反应综合征以及两者失衡导致的免疫功能紊乱有关,尤其是脓毒症出现器官功能障碍者,更与机体免疫功能紊乱密切相关[3]。高迁移率蛋白-1(HMGB1)为体内非常重要的晚期炎症因子,还与机体免疫系统密切相关,其主要功能是介导晚期炎症反应和参与适应性免疫应答,与脓毒症、脓毒性休克进展、预后都关系密切,其干预的时间窗相对更长[4-5],近年来成为脓毒症治疗的新热点。Toll样受体4(TLR4)介导的信号转导是脓毒症炎症激活及促炎反应的重要路径。研究发现,脓毒症时各器官存在TLR4信号转导途径异常高表达,TLR4与HMGB1结合后可通过髓样分化因子(myeloiddifferentiationfactor88,MyD88)或p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径促使核转录因子-κB(NF-κB)活化,进而调控各种炎症介质释放,参与脓毒症炎症反应的发生、发展。因此,HMGB1是治疗脓毒症的关键靶点之一。
脓毒症属中医学“热病”“温毒”范畴,基本病机为毒热互结,脉络瘀阻。本课题组多年来从事脓毒症的临床及基础研究工作,研制开发了抗炎合剂。临床研究表明,抗炎合剂治疗脓毒症疗效确切,能抑制患者炎症反应,减轻肺损伤[6-7]。动物实验研究提示,抗炎合剂可能通过抑制脓毒症大鼠TLR4/MyD88/NF-κB信号通路,减少炎症介质释放,从而减轻脓毒症大鼠急性肺损伤[8-9]。为了进一步明确抗炎合剂干预脓毒症的分子机制,本研究选取小鼠巨噬细胞系RAW264.7细胞,并通过慢病毒载体构建稳定的过表达HMGB1和沉默HMGB1(HMGB1 RNAi)的RAW264.7细胞,观察HMGB1与TLR4/MyD88/NF-κB信号通路的关系,进一步探讨抗炎合剂对TLR4/MyD88/NF-κB信号通路干预的作用,从而为脓毒症的治疗、抗炎合剂的临床应用和药理研究提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级SD雄性大鼠10只,6~7月龄,购自上海斯莱克实验动物有限责任公司,实验动物许可证号:SCXK(沪)2017-0005,饲养于上海中医药大学附属市中医医院实验动物中心,温度22~25 ℃,湿度40%~60%,自由饮水和进食。适应性饲养1周后,体质量200~230 g。
1.1.2 药物与试剂 抗炎合剂(药物组成:生大黄9 g,黄芩20 g,黄连6 g,厚朴12 g,败酱草30 g),所有药物均为符合2010版《中华人民共和国药典》规定并加工炮制合格的饮片,由上海中医药大学附属市中医医院中药房提供,并由制剂中心制备成药物浓度为1.0 g/mL的汤剂,4 ℃冰箱保存备用。10%胎牛血清,购自德国PAN-Biotech公司;Dulbecco's改良培养基(DMEM)、青链霉素双抗、胰蛋白酶消化液、脂多糖(LPS)、二甲基亚砜(DMSO)及肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、IL-10酶联免疫吸附(ELISA)法试剂盒,购自江苏凯基生物技术股份有限公司;引物探针由华大基因合成;总RNA提取试剂盒、cDNA合成试剂盒,购自赛默飞世尔科技(中国)有限公司;聚合酶链式反应(polymerase chain reaction,PCR)试剂盒,购自上海纽思格生物科技公司。
1.1.3 主要仪器 二氧化碳(CO2)培养箱(型号V-5060),德国Heraeus公司;多功能酶标仪(型号ELX800),美国BioTek公司;低温冷冻离心机(型号1-15K3K15),美国Sigma公司;实时荧光定量PCR仪(型号StepOnePlusTMReal-Time PCR system),英国Thermo Fisher Scientific公司;倒置电子显微镜(型号:莱卡DMI8),德国莱卡显微系统上海有限公司。
1.2 实验方法
1.2.1 含药血清制备 取10只SD雄性大鼠,予抗炎合剂9.9 g/kg(1.0 mL/100 g)灌胃,每日2次,连续7 d。末次灌胃给药后2 h(灌胃前12 h禁食不禁水)以10%水合氯醛0.5 mL/100 g腹腔注射麻醉,开腹后腹主动脉采血2 mL,4 ℃静置1 h后3 000 r/min离心15 min,分离血清,0.22 μm微孔滤膜过滤,56 ℃水浴灭活,-20 ℃冰箱保存备用。
1.2.2 细胞培养 将小鼠巨噬细胞系RAW264.7细胞常规培养于含10%胎牛血清的DMEM中,培养条件为37 ℃、5% CO2培养箱。待细胞融合达80%~90%时,用0.25%胰蛋白酶消化传代,每周传代或换液3~4次,第3传代用于实验。
1.2.3 通过慢病毒载体构建稳定的过表达HMGB1和HMGB1 RNAi的RAW264.7细胞株 将传代后的RAW264.7细胞接种于6个小皿中,每个小皿中接种5×104个细胞,置37 ℃、5% CO2培养箱中培养24 h。其中3个小皿中的RAW264.7细胞用10 μL过表达HMGB1慢病毒载体转染,另外3个小皿中的RAW264.7细胞用10 μL HMGB1 RNAi慢病毒载体转染,均转染24 h后,更换新鲜的DMEM培养基。48 h后加入含1 μg/mL嘌呤霉素的完全培养基继续培养12 h后,待细胞稳定生长后,对细胞进行筛选,反复筛选3次,通过荧光显微镜观察细胞的转染情况,最终形成过表达HMGB1和HMGB1 RNAi慢病毒转染的RAW264.7细胞稳定株(上述慢病毒载体由上海吉凯基因科技有限公司提供)。
1.3 分组与干预 以培养后的巨噬细胞系RAW264.7细胞为研究对象,取对数生长的细胞,按1×105个/mL浓度接种于12孔板中,每孔加1 mL细胞悬液,分为3组,每组设3个复孔。①空白对照组:用DMEM(900 μL)和10%胎牛血清(100 μL)处理RAW264.7细胞4 h。②LPS组:用DMEM(900 μL)+10%胎牛血清(100 μL)+终浓度为100 ng/mL的LPS处理RAW264.7细胞4 h。③LPS+中药血清组:含有10%胎牛血清的DMEM 975 μL+中药血清25 μL预处理RAW264.7细胞24 h,再加终浓度100 ng/mL的LPS处理4 h。
以过表达HMGB1慢病毒转染的RAW264.7细胞稳定株为研究对象,取对数生长的细胞,按照1×105个/mL浓度接种于6孔板中,每孔加1 mL细胞悬液,分为2组,每组设3个复孔。①LPS+HMGB1组:用DMEM(900 μL)+10%胎牛血清(100 μL)+终浓度为100 ng/mL的LPS处理过表达HMGB1慢病毒转染的RAW264.7细胞稳定株4 h。②LPS+HMGB1+中药血清组:含有10%胎牛血清的DMEM 975 μL+中药血清25 μL预处理过表达HMGB1慢病毒转染的RAW264.7细胞稳定株24 h,再加入终浓度为100 ng/mL的LPS处理4 h。
以HMGB1 RNAi慢病毒转染的RAW264.7细胞稳定株为研究对象,取对数生长的细胞,按1×105个/mL浓度接种于6孔板中,每孔加1 mL细胞悬液,分为2组,每组设3个复孔。①LPS+HMGB1 RNAi组:用DMEM(900 μL)+10%胎牛血清(100 μL)+终浓度为100 ng/mL的LPS处理HMGB1 RNAi慢病毒转染的RAW264.7细胞稳定株4 h。②LPS+HMGB1 RNAi +中药血清组:含有10%胎牛血清的DMEM 975 μL+中药血清25 μL预处理HMGB1 RNAi慢病毒转染的RAW264.7细胞稳定株24 h,再加入终浓度为100 ng/mL的LPS处理4 h。
1.4 检测指标与方法
1.4.1 细胞形态学观察 干预前对RAW 264.7细胞、过表达HMGB1慢病毒转染的RAW264.7细胞及HMGB1 RNAi慢病毒转染的RAW264.7细胞于倒置电子显微镜下(20×)进行形态学观察。然后按照1.3项分组处理方案对上述3种细胞进行相应的干预处理,将细胞置于倒置电子显微镜下(20×)拍照记录,进行细胞形态学观察。
经以上分析,选用西门子S7-200PLC系列中的紧凑型单元CPU 224XP CN和一个扩展模块EM232,分别型号为6ES7 214-2BD23-0XB8和6ES7 232-0HB22-0XA8。
1.4.2 ELISA检测TNF-α、IL-6、IL-10水平 1.3项各组细胞经过相应的处理后24 h,收集细胞上清,按ELISA试剂盒说明书检测TNF-α、IL-6、IL-10水平。
1.4.3 实时荧光定量PCR检测TRL4 mRNA、MyD88 mRNA、NF-κB mRNA表达 按照1.3项方案处理各组细胞后,终止培养,离心收集各组细胞,加入Trizol试剂提取总RNA,测定并调整各组细胞样本RNA浓度后,加入5×PrimeScript及重蒸水,逆转录制备cDNA。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,进行荧光定量PCR扩增,检测各组细胞中TLR4 mRNA、MyD88 mRNA、NF-κB mRNA的表达水平。引物由上海吉凯基因科技有限公司合成,引物序列见表1。反应条件:95 ℃预变性30 min,循环1次;95 ℃变性5 s,60 ℃变性30 s,循环40次;95 ℃变性15 s,循环1次;50 ℃退火30 s,循环1次;95 ℃延伸15 s,循环1次。以2-△△Ct法计算各目的基因的相对表达量。
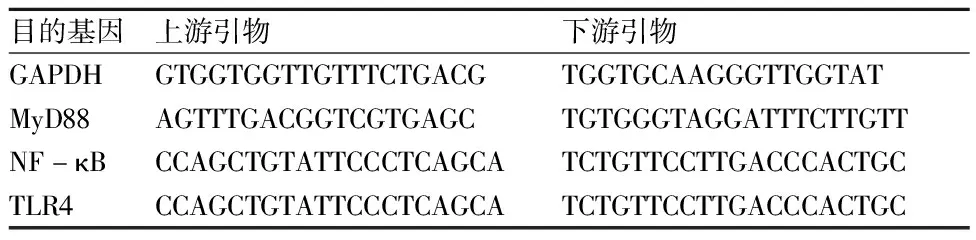
表1 各目的基因引物序列

2 结 果
2.1 各组细胞形态学观察结果 干预前镜下可见,RAW264.7细胞、过表达HMGB1慢病毒转染的RAW264.7细胞和HMGB1 RNAi慢病毒转染的RAW264.7细胞均呈圆形或椭圆形,有伪足,增殖状态无明显区别(见封3,图1)。干预后镜下可见,各不同干预组之间细胞增殖状态无明显区别,而细胞分化区别较为明显,空白对照组细胞无分化,LPS组、LPS+HMGB1组细胞分化程度较高,LPS+中药血清组、LPS+HMGB1 RNAi组、LPS+ HMGB1+中药血清组、LPS+HMGB1 RNAi+中药血清组细胞分化程度略低(见封3,图2)。
2.2 各组细胞上清IL-6、IL-10、TNF-α水平比较 见表2。
由表2可见,与空白对照组比较,LPS组、LPS+HMGB1组、LPS+HMGB1+中药血清组IL-6、IL-10、TNF-α水平均明显升高(P<0.05)。与LPS组比较,LPS+HMGB1组IL-6、TNF-α、IL-10水平均升高(P<0.05);LPS+HMGB1 RNAi组IL-6、IL-10、TNF-α水平均降低(P<0.05);LPS+中药血清组IL-6、TNF-α水平明显降低(P<0.05),IL-10水平明显升高(P<0.05)。与LPS+HMGB1组比较,LPS+HMGB1+中药血清组IL-6、TNF-α水平明显降低(P<0.05),IL-10水平明显升高(P<0.05)。与LPS+HMGB1 RNAi组比较,LPS+HMGB1 RNAi+中药血清组中IL-6、TNF-α水平明显降低(P<0.05),IL-10水平明显升高(P<0.05)。

表2 各组细胞上清IL-6、IL-10、TNF-α水平比较
2.3 各组细胞中TLR4 mRNA、MyD88 mRNA、NF-κB mRNA表达量比较 见表3。

表3 各组细胞中TLR4 mRNA、MyD88 mRNA、NF-κB mRNA表达量比较
由表3可见,与空白对照组比较,LPS组、LPS+HMGB1组、LPS+HMGB1+中药血清组中TLR4 mRNA、MyD88 mRNA、NF-κB mRNA表达量均明显升高(P<0.05)。与LPS组比较,LPS+HMGB1组TLR4 mRNA、MyD88 mRNA、NF-κB mRNA表达量均升高(P<0.05),LPS+HMGB1 RNAi组、LPS+中药血清组均降低(P<0.05)。与LPS+HMGB1组比较,LPS+HMGB1+中药血清组中TLR4 mRNA、MyD88 mRNA、NF-κB mRNA表达量均明显降低(P<0.05)。与LPS+HMGB1 RNAi组比较,LPS+HMGB1 RNAi+中药血清组中TLR4 mRNA、MyD88 mRNA、NF-κB mRNA表达量均明显降低(P<0.05)。
3 讨 论
脓毒症病情发展迅速,病死率居高不下,属中医学“伤寒温病”“外感热病”“厥证”“脱证”“温毒”等范畴,发病机制可概述为“虚、毒、瘀”[10],病因包括内因(正气虚弱,抗邪无力)和外因(外感六淫、疫戾之气),基本病机是正虚毒损,脉络瘀滞。脓毒症发生发展的关键因素主要有3条:其一是正气不足;其二是毒邪(痰浊、瘀血、热毒)内蕴;其三是气血运行不畅,瘀阻脉络,脏腑功能障碍[11-12]。抗炎合剂苦寒并用,清热利湿,通腑活血,排毒泄浊,主治热毒互结的脓毒症。方中生大黄泻下攻积,清热泻火,活血祛瘀,利湿退黄,凉血解毒,为君药。黄芩、黄连清热燥湿,泻火解毒,清上焦、中焦热,为臣药。厚朴行气消积,燥湿平喘;败酱草清热解毒,消痈排脓,祛瘀止痛,为佐药。
近年来,越来越多的研究认识到内源性物质警报素在脓毒症的发生发展过程中有重要作用。HMGB1为警报素的代表性物质[13],其在真核生物细胞中可与细胞DNA结合,全程参与DNA的复制、转录和翻译过程[14]。有研究表明,HMGB1是脓毒症发挥致死效应的关键促炎因子,既可主动分泌,也可被动分泌[15]。主动分泌是由受感染的免疫细胞或受损伤的免疫细胞分泌,被动分泌是由坏死的细胞分泌。HMGB1在人体所有细胞中均有表达,其中肝脏和大脑细胞的细胞质中表达比较集中,而其他组织细胞的细胞核中富集HMGB1。HMGB1的作用主要包括:①介导早期炎症反应。研究发现,在大鼠肝脏缺血—再灌注模型中,HMGB1通过介导炎症反应参与了肝损伤过程。大鼠肝脏再灌注2 h后,HMGB1蛋白表达随时间呈上升趋势,在24 h时达到峰值[16]。②介导晚期炎症反应。在炎症、组织损伤、肺损伤中,细胞外早期炎症因子如TNF-α、IL-1b、IL-6等早于HMGB1表达。48 h后对注射过LPS的小鼠进行检测,发现其血清中仍存在高水平的HMGB1[17]。③参与适应性免疫应答。HMGB1有2种启动方式,一种是激活树突细胞,促进适应性免疫应答;另外一种是直接与T淋巴细胞、B细胞结合,参与相关免疫反应。释放到细胞外的HMGB1主要识别并结合的受体为晚期糖基化终末产物受体(RAGE)和TLRs等受体[18],启动相应的信号转导通路,其中TLR4被认为是HMGB1主要的结合受体[19]。研究发现,在脓毒症发生发展中,各个器官中都存在TLR4调控的信号通路高表达[20]。TLR4与HMGB1结合后,可能通过MyD88,也有可能是通过p38MAPK途径以促使NF-κB激活,进而促进各种炎症介质激活和释放,所以说HMGB1参与了脓毒症炎症反应的发生发展,进一步影响各器官功能,是脓毒症发病的重要因子[21]。
MyD88是TLRs信号通路的关键接头蛋白,TLR4调控的LPS信号通路主要通过MyD88依赖性和非依赖性2个途径来激活下游信号。LPS通过与髓样分化蛋白-2(MD-2)识别而与TLR结合,使得TLR4二聚体化,即被激活,形成LPS/TLR4/MD-2复合物,参与并介导炎症细胞因子的信号通路转导,复合物与MyD88结构中的TIR区域结合,继而肿瘤坏死因子受体相关因子6(TRAF-6)被激活,活化后的TRAF-6抑制IκB激酶(IκB Kinase,IKK),使其与NF-κB解离,从而激活NF-κB。活化后的NF-κB进一步促进IL-1、TNF-α等炎症因子表达,最终导致炎症因子的瀑布样释放[22]。伴随促炎因子的增加,抗炎因子分泌也增加,机体表现为免疫紊乱状态。IL-10是主要的抗炎因子和免疫抑制因子,主要由巨噬细胞和辅助性T细胞2(Th2)合成,能够抑制炎症细胞增殖[23]。
本研究中,与空白对照组比较,LPS组IL-6、IL-10、TNF-α水平和TLR4 mRNA、MyD88 mRNA、NF-κB mRNA表达量均明显升高(P<0.05),说明浓度为100 ng/mL的LPS可以刺激RAW264.7细胞构建细胞脓毒症的模型,也说明脓毒症发生时,TLR4可以通过识别LPS,并通过NF-κB信号转导,促使促炎因子释放。与LPS组比较,LPS+HMGB1组中IL-6、IL-10、TNF-α水平及TLR4 mRNA、MyD88 mRNA、NF-κB mRNA的表达量升高(P<0.05),提示当LPS诱导过表达HMGB1慢病毒转染RAW264.7细胞株发生炎症反应时,信号通路TLR4/MyD88/NF-κB参与了免疫应答,炎症反应增强。而干扰HMGB1后的LPS+HMGB1 RNAi组IL-6、IL-10、TNF-α水平及TLR4 mRNA、MyD88 mRNA、NF-κB mRNA的表达量降低(P<0.05),证明HMGB1是启动炎症反应的关键物质。而LPS+中药血清组与LPS组比较、LPS+HMGB1+中药血清组与LPS+HMGB1组比较、LPS+HMGB1 RNAi+中药血清组与LPS+HMGB1 RNAi组比较分别显示,IL-6、TNF-α水平及TLR4 mRNA、MyD88 mRNA、NF-κB mRNA的表达量均明显降低(P<0.05),IL-10水平明显升高(P<0.05)。说明抗炎合剂可能通过TLR4/MyD88/NF-κB信号通路调节炎症反应,抑制TLR4使MyD88和NF-κB的表达减少,减少促炎因子IL-6、TNF-α释放,促进抗炎因子IL-10合成,从而减轻炎症反应。
综上可见,脓毒症时HMGB1能够促进TLR4/MyD88/NF-κB信号通路的活化,加速炎症反应的发生,抗炎合剂能够抑制该信号通路减轻脓毒症的炎症反应,但此作用并不是通过抑制HMGB1取得的,其机制还待以后进一步研究。

