参苓白术散治疗新型冠状病毒肺炎恢复期的网络药理学探讨Δ
林 彤,李 丽,梁彩君,曾 辉,李晓良,彭立生
(1.广州中医药大学第四临床医学院,广东 深圳518033; 2.深圳市第三人民医院心内科,广东 深圳 518033; 3.深圳市中医院科教科,广东 深圳 518033)
随着新型冠状病毒肺炎(COVID-19)诊治工作的推进,临床治愈的患者迅速增多,虽已满足出院标准[1],但部分患者仍存在乏力、纳差、憋闷和干咳等症状,肺部CT仍显示散发阴影,伴有不同程度的间质性肺炎和肺功能受损,甚至有肺纤维化的可能[2]。部分高龄患者因免疫能力低下,不能排除再次感染的风险,因此,恢复期治疗不容忽视。
由国家卫生健康委员会发布的《新型冠状病毒感染的肺炎诊疗方案》自试行第3版起纳入中医治疗[1],各省、自治区、直辖市对该病各阶段病机的认识虽各不相同,但基本将其分为预防期,观察期,临床治疗初、中、重症及恢复期,恢复期以肺脾气虚证或气阴两虚证为主[3]。本研究团队所处的广东省结合岭南地区气候与地域特色,针对恢复期肺脾气虚证,推荐参苓白术散为基础方剂[4]。参苓白术散出自宋朝《太平惠民和剂局方》,是“培土生金”的代表方,方中人参、白术及茯苓健脾益肺燥湿,为君药;山药、莲子、白扁豆并薏苡仁健脾渗湿止泻,为臣药;砂仁醒脾化湿,桔梗宣肺利气、载药上行,均为佐药;炒甘草健脾和中为使,全方补脾益肺、渗湿止泻,常用于肺系及脾胃系疾病。
血管紧张素转换酶Ⅱ(ACE2)是冠状病毒的受体[5];冠状病毒木瓜样蛋白酶(PLP)和3CL水解酶(Mpro)是病毒复制过程中重要的酶[6];上述3个蛋白与病毒入侵及复制相关,被作为COVID-19药物研发的主要靶点[7-8]。
中医学的优势在于“系统调节”,但作用机制复杂,造成相关研究难度较大。网络药理学与中医学有相似的“整体观”,能较全面地探讨药物与疾病间的联系。本研究运用网络药理学方法,挖掘参苓白术散的药效物质基础及潜在靶点,通过网络分析提取重要靶点,并对重要靶点行功能富集分析,阐释方剂的潜在药效机制,最后用分子对接技术探讨其核心成分对于预防病毒“再感染”的可能性,综合分析参苓白术散治疗恢复期COVID-19的可行性,为其临床应用及科研提供参考。
1 资料与方法
1.1 参苓白术散活性成分搜集
结合中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)和中医药百科全书数据库(the encyclopedia of traditional Chinese medicine,ETCM),搜集参苓白术散所含的化学成分,依次输入方剂所含10味中药的名称;以TCMSP中口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18为标准筛选活性成分。在PubChem下载每个化合物的三维结构文件,并记录化合物的SMILES式。
1.2 靶点预测
利用3个平台进行活性成分靶点预测。(1)Swiss Target Prediction:在该平台分别输入每个活性成分的SMILES式,其基于“分子相似性”预测化合物的靶点,保留预测结果中概率≥0.7的靶点;(2)PharmMapper:将化合物的三维结构文件分别上传至该平台,其基于“药效团反向分子对接”原理预测靶点,筛选结果中匹配度>3分者;(3)保存TCMSP提供的靶点。将3个来源的靶点合并去重,用Uniprot数据库将靶点全称统一为人类基因标准名。
1.3 网络构建与分析
采用Cytoscape 3.7.2软件构建网络,通过Network Analyzer插件分析网络关系。网络中的节点表示中药、活性成分或靶点,连接节点的边表示其间关系。
1.4 靶点蛋白互作网络
将“1.2”中预测的靶点输入STRING平台进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)分析,物种设为“人”,最低相互作用阈值设为0.7(较高),将结果导入Cytoscape分析,凭度值提取重要靶点。
1.5 功能富集分析
采用Cytoscape的GlueGO插件对重要靶点进行基因本体(gene ontology,GO)生物学过程(biological process,BP)功能富集分析和基于京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)的通路富集分析,置信区间均设为P<0.01,采用R软件ggplot2包将结果可视化。
1.6 分子对接
采用iGEMDOCK 2.1软件进行分子对接,选择标准对接模式,参数设置如下:群体大小=200,子代数目=80,解的个数=2。对接结果表示为受体与配体结合的总能量,能量越低,结合程度越高,两者发生作用的可能性越大;本研究以靶点蛋白与原配体的结合能量作为对照。从PDB数据库下载靶点蛋白的晶体结构,ACE2、PLP和Mpro对应的PDB编号分别为2ajf、6bi8和6lu7;从ZINC数据库下载活性成分和靶点原配体三维结构的MOL2文件。
2 结果
2.1 活性成分筛选
根据筛选条件,并剔除无靶点的活性成分,共纳入127种活性成分,人参、白术、茯苓、山药、莲子、白扁豆、薏苡仁、砂仁、桔梗和甘草分别贡献13、4、8、11、5、1、6、8、4和72个活性成分,部分中药间成分存在重叠。
2.2 中药-活性成分-靶点网络
中药-活性成分-靶点网络中包括330个节点(10个中药,127个成分,193个靶点)和1 571条边。在网络中,1个节点的度值指与该节点连接的边的数目,一般认为,度值≥所有节点度值中位数2倍的节点在网络中有较重要的地位。该网络中,每个活性成分平均作用于11.86个靶点,每个靶点平均受7.8个活性成分调控,体现了中药复方多成分、多靶点、成分间协同作用的特点,见图1。

注:方形节点表示中药;箭头形节点表示活性成分;圆形节点表示靶点;度值越大的节点面积越大Note: square nodes represent traditional Chinese medicine; arrow-shaped nodes represent active ingredients; round nodes represent targets; the greater the degree, the greater the area of the node图1 中药-活性成分-靶点网络Fig 1 Chinese medicine-active ingredient-target network
所有活性成分度值中位数为11,度值≥22的节点有20个;度值排序居前5位的活性成分为C47(二氢槲皮素)、C1(山柰酚)、C48(木犀草素)、C57(7-甲氧基-2-甲基-异黄酮)和C2(豆甾醇),对应度值53、51、36、32和30,其与137个(>70%)靶点关联,故可以认为上述5个成分是参苓白术散的核心药效物质基础。表1为度值排序居前10位的活性成分。

表1 参苓白术散的主要活性成分(前10位,度值排序)Tab 1 Main active ingredients of Shenling Baizhu powder(top 10, ranking by degree)
所有靶点度值中位数为2,度值≥4的节点有49个,说明这49个靶点受到4个以上活性成分的调控,取这些靶点进行PPI分析。度值排序居前5位的靶点为前列腺素内过氧化物合酶2(PTGS2)、雌激素受体1(ESR1)、雄激素受体(AR)、核受体辅激活因子2(NCOA2)和一氧化氮合酶(NOS2),度值分别为94、68、65、60和59,其受到最多活性成分的调控。
2.3 靶点PPI网络
PPI网络中有47个节点(2个靶点无相互作用信息,未在网络中)和216条边,见图2。网络中所有节点的中位数为9,>中位数的靶点有26个,这些靶点与网络中其他靶点联系密切,能代表靶点网络的功能,是参苓白术散药效作用的重要靶点(表2),对其行GO和KEGG通路富集分析,以了解其在系统水平上的功能。
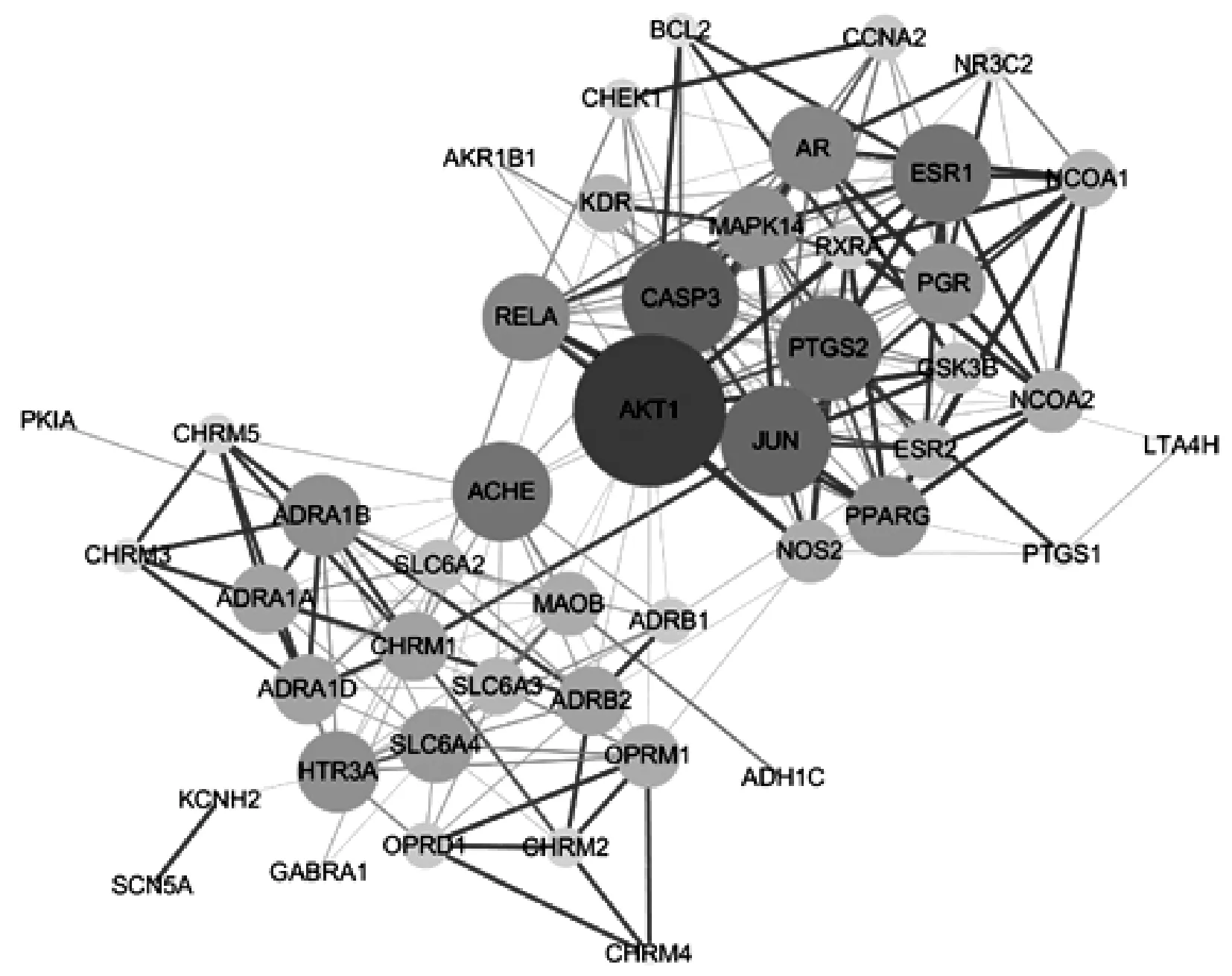
注:节点表示靶点蛋白,边表示蛋白间相互作用,节点越大、颜色越深,对应靶点的度值越大;边越粗、颜色越深,对应蛋白间联系程度越高Note: nodes represent target protein, the edge represents interaction between proteins, the larger the node and the darker the color, the greater the degree of corresponding target; the thicker the edge and the darker the color, the higher the degree of connection between corresponding proteins图2 靶点PPI网络Fig 2 PPI network of targets

表2 重要靶点信息Tab 2 Information of important targets
2.4 富集分析
26个重要靶点共富集到60个GO-BP条目,主要涉及机体对血管紧张素的反应,血液循环的良性调节,肾上腺素及其受体、G蛋白偶联受体以及类固醇激素受体活性等,选取靶点基因占比居前15位的条目进行展示,见图3。重要靶点富集到22条KEGG通路,涉及白细胞介素17(IL-17)、B细胞、肿瘤坏死因子(TNF)、血管内皮生长因子(VEGF)、肾上腺素和催乳素等信号通路,以及多种病毒、细菌相关疾病的信号通路,选取靶点基因占比居前15位的条目展示,见图4。
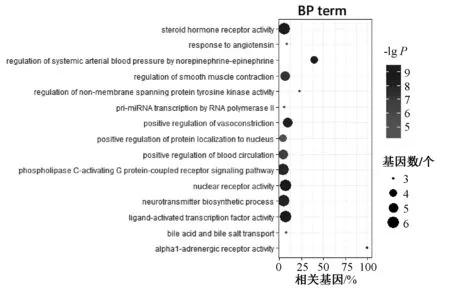
图3 GO-BP富集分析部分结果Fig 3 Partial results of GO-BP enrichment analysis

图4 KEGG通路富集分析部分结果Fig 4 Partial results of KEGG pathway enrichment analysis
2.5 分子对接结果
分子对接技术用计算机模拟预测小分子化合物与特定受体在不同结合位点内的亲和力,广泛应用于药物筛选。本研究将二氢槲皮素、山柰酚、木犀草素、7-甲氧基-2-甲基-异黄酮及豆甾醇分别与ACE2、PLP和Mpro进行分子对接,探索上述活性成分是否具有预防再度感染严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)的能力。除PLP和7-甲氧基-2-甲基-异黄酮外,其他成分与靶点蛋白的结合能量均低于原配体,说明参苓白术散的核心成分具备与COVID-19靶点结合的潜力,可能可预防“复感”;其中,PLP与二氢槲皮素结合程度最好,结合能量为-365.84 kJ/mol,见表3、图5。

表3 分子对接结果Tab 3 Results of molecular docking

A.ACE2-二氢槲皮素;B.PLP-二氢槲皮素;C.Mpro-木犀草素A.ACE2-dihydroquercetin; B.PLP-kaempferol; C.Mpro-luteolin图5 分子对接Fig 5 Molecular docking
3 讨论
本研究通过对参苓白术散靶点PPI网络的分析,提炼出26个重要靶点,这些靶点富集在免疫、循环和神经-内分泌相关生物学功能及信号通路上。首先,IL-17、B细胞和TNF通路相互交错,调控免疫炎症反应。IL-17由辅助性T细胞17(Th17)产生,能募集B细胞等炎症细胞,促进炎症因子释放,启动“炎症瀑布”,激化肺部炎症并导致肺纤维化[9]。第二,VEGF高表达导致呼吸道黏膜血管新生及通透性增加,增加炎症因子渗入,导致呼吸道壁增厚,促进肺纤维化[10]。第三,血管紧张素引起肺内血管收缩、血流量降低是导致急性呼吸窘迫综合征的重要原因,而氧化应激是肾素-血管紧张素系统(renin-angiotensin system,RAS)的上游调节剂[11]。第四,肾上腺素能β2受体的激活能缓解支气管痉挛,抗炎、抗过敏,改善通气。最后,靶点还富集到多种病毒、细菌感染疾病的信号通路上,提示参苓白术散可能对体虚患者继发其他病毒、细菌感染有一定预防作用。
本研究筛选出的5个核心成分,二氢槲皮素、木犀草素、山柰酚、7-甲氧基-2-甲基-异黄酮及豆甾醇,均属于黄酮类化合物,具有抗菌、抗病毒、抗炎、抗氧化、抗凋亡及抗恶性肿瘤等药理活性[12];豆甾醇为天然甾醇,具有降脂、抗菌、抗炎、抗肿瘤、调节免疫及抗氧化等作用[13]。可以发现,核心活性成分的药理作用与重要靶点的生物功能相契合,黄酮类化合物具有广谱抗病原微生物活性,故可大胆预测,参苓白术散可能具有抗SARS-CoV-2的能力。同时,该方可能通过调节IL-17等信号通路抑制免疫损伤、减轻炎症;下调VEGF表达,减轻肺纤维化;缓解氧化应激,调节RAS系统,改善肺内血液循环与组织缺氧;也可在一定程度上激活支气管内肾上腺素能受体,解痉止咳。分子对接结果证明,5个核心活性成分能与ACE2、PLP和Mpro较紧密地结合,说明上述成分具有预防病毒再次入侵机体的潜能,也从侧面佐证了本研究的可信性。
参苓白术散中的药物主要归脾、肺经,临床除了常用于溃疡性结肠炎等脾系疾病外,对于慢性阻塞性肺疾病、呼吸机相关性肺炎等肺系疾病也有确切疗效,是肺脾同治的良方[14]。ACE2不仅在Ⅱ型肺泡上皮细胞高表达,并且在食道上皮、回结肠等消化道中也呈高表达,故呼吸及消化系统皆会出现症状[15]。研究结果证实,参苓白术散能调节肠道菌群平衡[16],可能纠正治疗COVID-19期间使用激素造成的肠道菌群失调。并且,大量输液易致脾虚证候,部分患者有腹泻症状,参苓白术散主治脾虚湿泄,使用该方恰如其分。COVID-19发病与机体免疫功能不足有很大联系,以往的研究结果显示,参苓白术散方中所含的人参皂苷和茯苓多糖是天然的免疫增强剂,有利于瘥后康复[17]。
综上所述,本研究从系统生物学水平阐释了参苓白术散通过多成分、多靶点和多通路对机体发挥整体调节作用,其可能通过良性调节免疫炎症反应、循环、神经-内分泌系统以及肠道菌群,改善COVID-19恢复期肺脾气虚证的乏力、咳嗽、纳差、腹胀及便溏等症状,促进肺部组织修复,减少肺纤维化,并可能预防再次感染病毒。因网络药理学方法尚存在局限性,如数据库未完善、药材间研究偏倚以及无法考虑活性成分含量和成分间的化学反应等,本研究暂提供理论参考,具体机制尚需实验验证。

