加载miRNA-21壳聚糖基纳米粒对牙周膜干细胞成骨分化的影响
吴广升,王亚男,惠光艳,梅 涛,王忠山
miRNA是一种由21~25个核苷酸组成的较小的内源性非编码RNA,可以通过提高或抑制目的mRNAs的降解而调控增殖、分化、凋亡及癌变等一系列的细胞活动[1-2]。miRNA在干细胞成骨分化过程中发挥了非常重要的作用,已经被广泛应用于骨再生方面的研究,多种miRNA具有促进干细胞成骨分化的作用[3-4]。但由于游离miRNA存在极易降解性、细胞难以摄取,潜在的免疫源性等缺陷,必须采用合适的载体才能提高miRNA转染效率。壳聚糖(CS)是一种纯天然高分子多糖,自身带正电荷,可以作为RNA、DNA、生长因子及抗肿瘤药物载体[5]。CS基纳米粒作为一种非病毒载体,避免了外源基因序列的插入,但将其应用于miRNA转染体系仍存在转染效率不高的问题[6]。基因反向转染技术是先将DNA(或RNA)通过基质锚定在一定界面上,再将细胞接种于该基质表面,细胞贴壁的同时摄取锚定在介质表面DNA(或RNA)而实现基因转染。与常规转染方法相比,该转染体系可更有效地接触细胞表面从而达到更高的转染效率和更低的细胞毒性等效果[7-8]。miR-21是一种具有促进成骨分化作用的miRNA,可上调成骨相关基因表达,在体内可促进骨组织再生[9]。本实验制备壳聚糖/三聚磷酸钠/透明质酸/miR-21纳米粒(CTH/miR-21 NPs)并对牙周膜干细胞(PDLSCs)进行反向转染,观察其转染效率及促进成骨基因表达作用,为CTH/miR-21 NPs进一步应用于促进牙周组织再生提供经验。
1 材料与方法
1.1主要材料与设备 CS(医用级,脱乙酰度≥90%,分子量约100 kDa,金壳药业,浙江),透明质酸(HA,分子量约10 kDa,福瑞达医药,山东),α-MEM培养基、胎牛血清、PBS、双抗(Hyclone,美国);L-谷氨酰胺、抗坏血酸、β-甘油磷酸钠、Ⅰ型胶原酶(COLⅠ)和Dispase酶(Sigma,美国),0.25%胰蛋白酶(雷根,北京);乙酸(优级纯,国药集团),CO2恒温细胞孵箱(Thermo Forma,美国),miR-21(吉玛制药,上海);超净工作台(博科生物,山东);荧光显微镜(Olympus,BX51,日本),倒置相差显微镜(Olympus,日本),扫描电子显微镜(Hitachi S-4800,日本);离心机、反转录PCR仪(Eppendorf,德国),实时荧光定量分析仪(Bio-rad,美国),纳米粒径测量仪(Zetasizer NanoZS90, Malvern Instrument,英国)。
1.2CTH/miR-21 NPs的制备及鉴定 参考相关文献[6]制备方法,采用离子交联的方法制备CTH/miRNA-21 NPs。将适量CS溶于0.1 mol/L的乙酸溶液中,制备1 mg/ml的CS乙酸溶液。再将适量三聚磷酸钠(TPP)和HA分别溶于去离子水,获得1 mg/ml的TPP和HA溶液。将CS、TPP和HA按体积比1∶0.1∶0.025,1∶0.15∶0.025,1∶0.15∶0.05,1∶0.15∶0.1,1∶0.15∶0.15及1∶0.15∶0.5的比例进行混合。置于磁力搅拌器上以3000 r/min的速度搅拌10 min,形成乳光色的CTH NPs悬液。将适量浓度为20 μmol/ml的miR-21加入CTH NPs中(N∶P=20∶1,即氮/磷,指CS中正电荷的氨基与miR-21中负电荷的磷酸基的摩尔比为20∶1),并用移液器抽吸混匀,振荡器上震荡10 s后室温下静置60 min,获得CTH/miR-21 NPs。采用激光粒度仪检测CTH/miR-21 NPs粒径和电位。
1.3CTH/miR-21 NPs反向转染体系的制备及鉴定 将适量的CTH/miR-21 NPs(含300 pmol miR-21)混入100 μl的0.2%明胶溶液中,震荡混匀后滴加入6孔板中,涂覆均匀,超净工作台内风干后戊二醛固定,喷金,扫描电镜观察。
1.4PDLSCs的原代培养及鉴定 收集4例18~22周岁(已签署知情同意书)因正畸治疗需要拔除的前磨牙或埋伏阻生的第三磨牙。超净工作台内用11号手术刀片刮取牙根中1/3处的牙周膜组织,并剪成体积0.5~1 mm3的组织碎片,移入15 ml离心管并滴加5 ml含有1% Dispase和1% COLⅠ的混合消化液,37℃环境下消化45 min,其间每隔15 min轻轻震荡数次,重悬后接种于6孔板中(含10% FBS,1%双抗),在37℃、5% CO2环境下培养,细胞汇合至80%后胰酶消化法传代。采用有限稀释克隆法获取3~5代PDLSCs用于后续实验。采用流式细胞分析仪对细胞表面标记分子进行检测。采用胰酶消化法收集第3代PDLSCs,PBS洗3遍,PBS重悬、计数,与CD31、CD34、CD45、CD29、CD90以及CD105室温避光孵育40 min后,将PDLSCs转移至流式管中,采用流式细胞仪检测细胞表面标志物的表达水平。成骨诱导:选取第3代PDLSCs,当细胞融合约90%时,用成骨诱导液继续培养21 d,4%多聚甲醛固定后茜素红染色。成脂诱导:选取第3代PDLSCs,当细胞融合约90%时,用成脂诱导液继续培养2周,4%多聚甲醛固定后油红O染色。
1.5PDLSCs摄取CTH/miR-21 NPs的情况 将CTH/miR-21 NPs(已用FITC标记CS, Cy-3标记miR-21)以300 pmol/孔的量加入6孔板,并加入适量的0.2%明胶溶液交联,干燥。PDLSCs以2×105/孔的浓度接种到6孔板中,37℃、5% CO2及饱和湿度的条件下培养24 h。吸出原培养液,PBS冲洗2遍,4%多聚甲醛固定30 min,每孔加500 μl DAPI,PBS冲洗3遍,去除多余的DAPI。荧光显微镜下观察PDLSCs中DAPI(蓝色荧光)、FITC(绿色荧光)及Cy-3(红色荧光)的分布,拍照。
1.6CTH/miR-21 NPs转染PDLSCs效率鉴定 采用流式细胞仪观察CTH/miR-21 NPs转染PDLSCs的效率。按照上述方法将CTH/miR-21 NPs(Cy-3标记)以0、150、300、450 pmol/孔的量反向转染PDLSCs 24 h,PBS轻轻洗涤2次、重悬,4%多聚甲醛固定。浓度为0 pmol/孔组为阴性对照,根据PDLSCs发射出来的红色荧光的比率测定转染效率。每个样本重复检测3次。
1.7CTH/miR-21 NPs转染PDLSCs后成骨相关基因的表达 采用RT-PCR方法检测CTH/miR-2 NPs转染PDLSCs后成骨基因表达水平。将CTH/miR-21 NPs以0、150、300、450 pmol/孔的量加入6孔板中,并用0.2%明胶溶液交联。PDLSCs以2×105/孔的浓度接种到6孔板中,37℃、5% CO2及饱和湿度的条件下培养3 d。吸弃原培养液,PBS冲洗3遍,以用500 μl/孔的量加入TRIzol裂解细胞,收集细胞内的总RNA。采用PrimeScript RT试剂盒反转录为cDNA。成骨相关基因RUNT相关转录因子2(RUNX2)、骨桥素(OPN)、骨钙素(OCN)、COLⅠ的表达水平用Takara公司SYBR Premix Ex TaqTM试剂盒进行检测。实验中使用的上游和下游引物序列见表1。数据分析采用iQTM5光学系统软件2.0。数据中所有目的基因表达水平均通过管家基因GAPDH进行校正。

表1 成骨相关基因引物序列
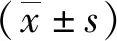
2 结果
2.1CTH/miR-21 NPs粒径及电位检测结果 CTH/miR-21 NPs的粒径和Zeta电位由CS、TPP和HA三者之间的体积比所决定。随着HA比率的增高,CTH/miR-21 NPs的粒径由147.3 nm增加至288.5 nm,而Zeta电位由44.5 mV逐渐降低至21.7 mV。当CS∶TPP∶HA为1∶0.15∶0.025时,CTH/miR-21 NPs的粒径最小。见图1。
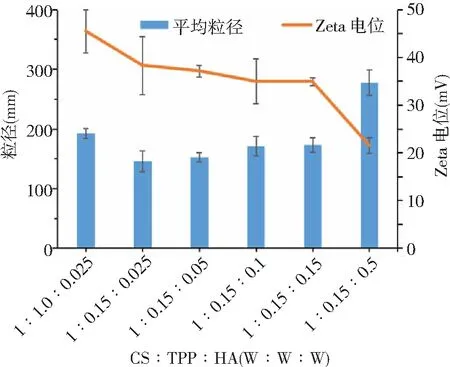
图1 CTH/miR-21 NPs的粒径及Zeta电位CTH/miR-21 NPs为壳聚糖/三聚磷酸钠/透明质酸/miR-21纳米粒,CS为壳聚糖,TPP为三聚磷酸钠,HA为透明质酸
2.2CTH/miR-21 NPs反向转染体系的形态学特征 CTH/miR-21 NPs呈球形均匀地分布在培养板表面,纳米球的周缘被明胶部分包绕。见图2。

图2 交联在培养板上的CTH/miR-21 NPs形态特征CTH/miR-21 NPs为壳聚糖/三聚磷酸钠/透明质酸/miR-21纳米粒
2.3PDLSCs特性鉴定 PDLSCs阴性表达造血干细胞表面标记物:CD31、CD34、CD45;阳性高表达间充质干细胞表面标记物:CD29、CD90、CD105,证明本实验原代培养的细胞具有间充质来源的干细胞特征。见图3。本研究所培养人PDLSCs呈典型长梭形,经体外成骨诱导21 d后,茜素红染色阳性,密集排列的细胞表面形成不规则红色矿化结节;PDLSCs经成脂诱导14 d后,油红O染色阳性,PDLSCs细胞内及细胞间散在分布大小不等的圆形红色脂滴,证实PDLSCs具有多向分化潜能。见图4。
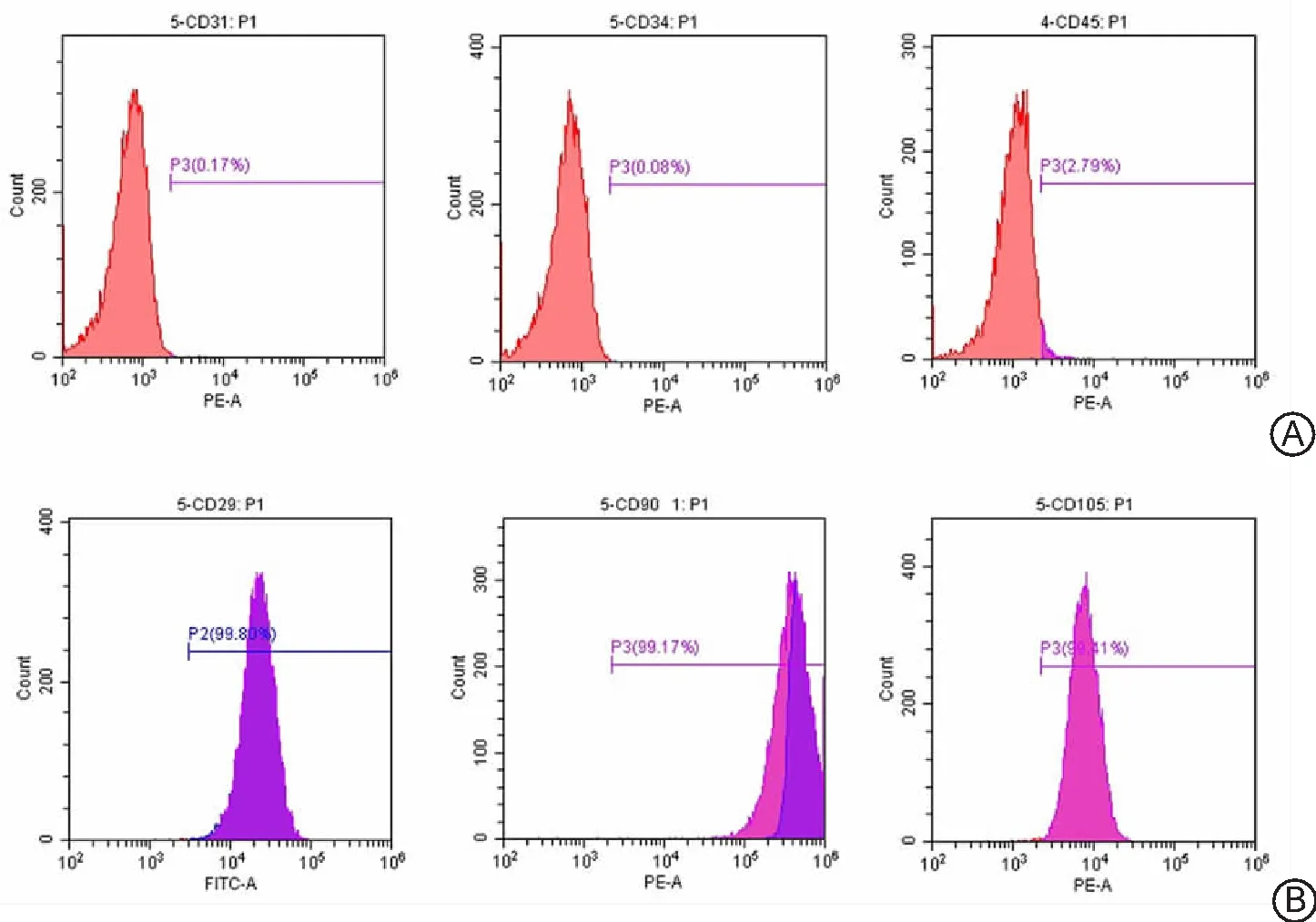
图3 PDLSCs表面标记物表达情况PDLSCs为牙周膜干细胞;A.阴性表达造血干细胞表面标记物;B.阳性高表达间充质干细胞表面标记物
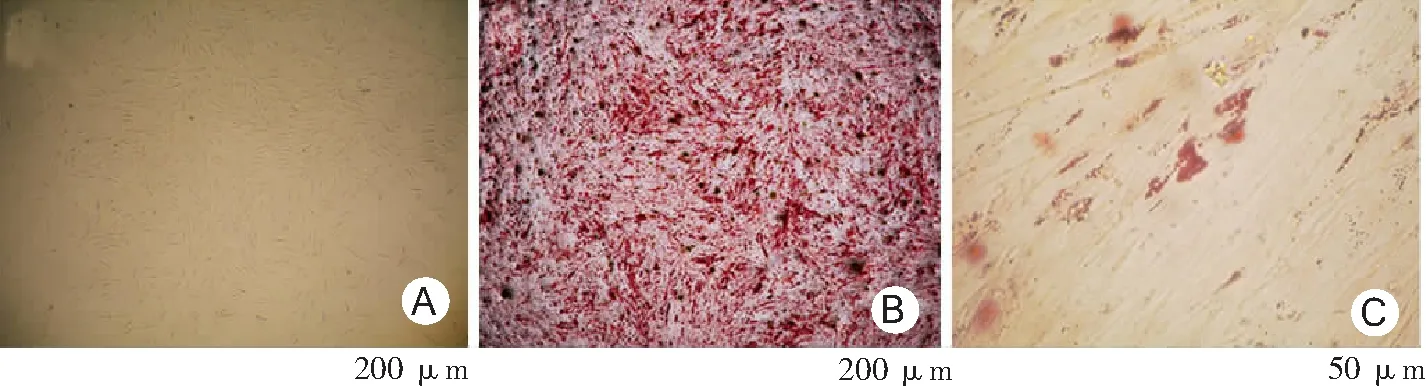
图4 PDLSCs培养及鉴定PDLSCs为牙周膜干细胞;A.第3代PDLSCs;B.矿化结节茜素红染色;C.油红O染色
2.4PDLSCs摄取CTH/miR-21 NPs情况 荧光显微镜下,PDLSCs的细胞核被DAPI染成蓝色(图5A),CTH/miR-21 NPs中被FITC标记的CS呈绿色(图5B),Cy-3标记miR-21呈红色(图5C),图5D为图5B和图5C融合之后,绿色和红色完成重合,证实miR-21与CTH NPs完整地结合在一起并被细胞摄入。图5E为图5A、5B、5C融合,蓝色的细胞核周围绿色及红色荧光聚集,说明PDLSCs可以吞噬大量的CTH/miR-21 NPs。流式细胞仪检测细胞转染效率,300和450 pmol/孔可以达到90%以上的转染效率,高于0、150 pmol/孔(P<0.01)。见图5F。
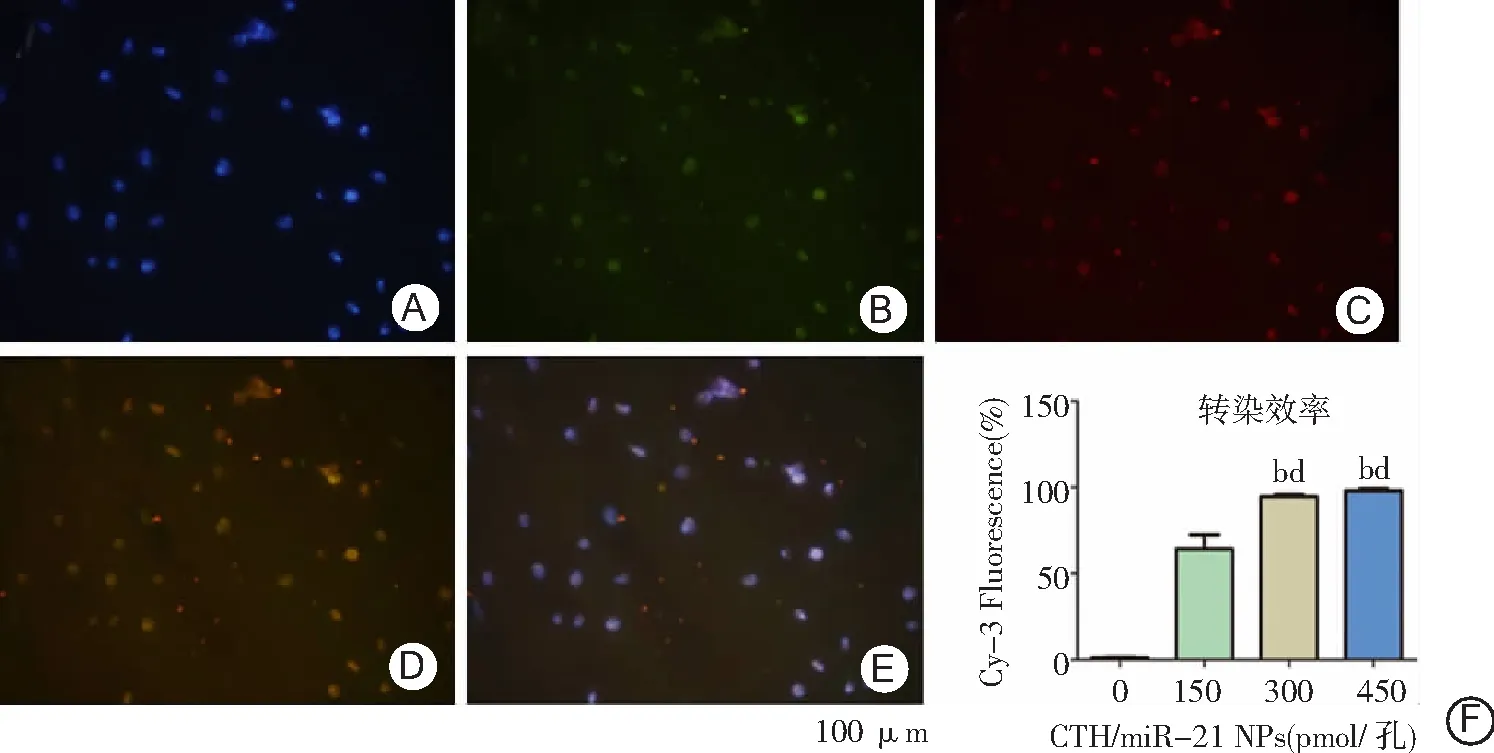
图5 PDLSCs摄取CTH/miR-21 NPs情况及CTH/miR-21 NPs转染效率A.DAPI标记细胞核(蓝色);B.FITC标记CS(绿色);C.Cy-3标记miR-21(红色);D.为图B和图C融合;E.为图A、B、C融合;F.不同浓度CTH/miR-21 NPs转染效率;PDLSCs为牙周膜干细胞,CTH/miR-21 NPs为壳聚糖/三聚磷酸钠/透明质酸/miR-21纳米粒;与0 pmol/孔比较,bP<0.01;与150 pmol/孔比较,dP<0.01
2.5反向转染后PDLSCs成骨相关基因表达水平 与0 pmol/孔组比较,300、450 pmol/孔组RUNX2、OPN、OCN和COLⅠ水平及150 pmol/孔OPN和COLⅠ水平上调,且300、450 pmol/孔组OPN、OCN水平高于150 pmol/孔组(P<0.05,P<0.01)。见图6。
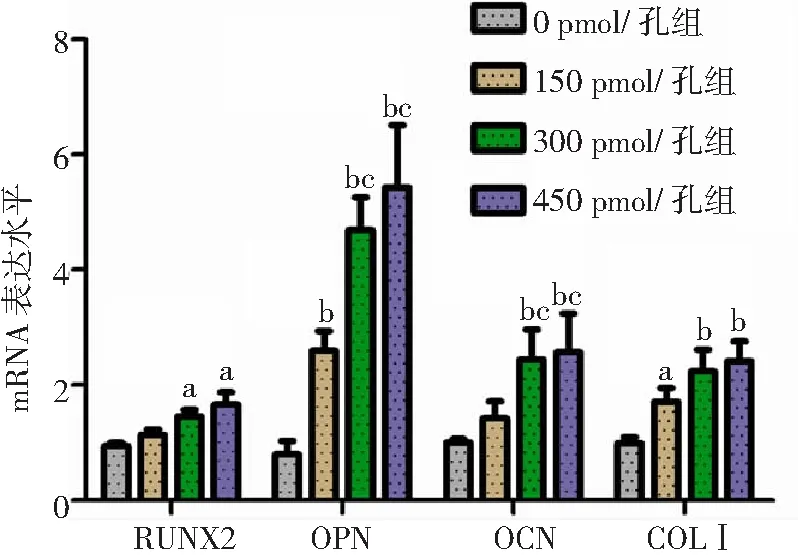
图6 不同浓度CTH/miR-21NPs对PDLSCs成骨相关基因表达情况PDLSCs为牙周膜干细胞,CTH/miR-21 NPs为壳聚糖/三聚磷酸钠/透明质酸/miR-21纳米粒,RUNX2为RUNT相关转录因子2,OPN为骨桥素,OCN为骨钙素,COLⅠ为Ⅰ型胶原酶;与0 pmol/孔组比较,aP<0.05,bP<0.01;与150 pmol/孔组比较,cP<0.05
3 讨论
牙周炎是导致成人牙齿松动和脱落的主要原因之一,如何使缺损的牙周组织再生是一个具有重大挑战性的临床问题。随着组织工程技术和生物材料学的不断发展进步,牙周组织再生研究进入了高速发展的新阶段。PDLSCs是存在于牙周韧带组织中的间充质干细胞(MSCs),具有很强的自我更新能力以及多向分化潜能,可以分化为牙骨质和牙周膜。PDLSCs被公认为目前牙周组织工程中最佳的种子细胞[10]。但PDLSCs需要在特定的微环境诱导下才能持续进行成骨分化。
近年来,基因转染技术在生物医学领域得到越来越广泛应用。传统的基因转染方法是阳离子聚合物或脂质体等通过静电作用结合RNA或DNA形成纳米复合体,随后加入细胞培养基中,依靠重力作用沉降至已经贴壁细胞的表面,再通过胞吞作用进入细胞,这种基因转染方法被称为正向转染。然而,其缺陷在于复合物粒径不稳定,并且为了获得较高转染效率需要提高复合体浓度而引起一定的细胞毒性。反向转染具有以下优势:①载体/基因复合体更加稳定,并还可以在固定位置释放基因;②与细胞膜直接接触,便于细胞内吞,提高转染效率;③转染过程可以在血清环境中实现[7-8]。
miRNA可以调控多种干细胞成骨分化,为了克服游离的miRNA存在的极易降解性、细胞难以摄取和潜在的免疫源性等不足,采用合适的载体负载miRNA后再进行转染是最普遍的方法。Wu等[11]将脂质体/miRNA复合物通过冻干的方式结合培养板表面,随后将骨髓间充质干细胞(BMSCs)接种于该培养板表面进行反向转染,获得了更高的转染效率及更低的细胞毒性,并且冻干后的脂质体/miRNA复合物在4℃或-20℃条件下保存90 d后仍然可以反向转染MSCs,且转染效率没有太大变化。Wu等[12]又通过将脂质体/miRNA冻干在经过微弧氧化形成的微孔氧化钛表面,制备miRNA功能化的微孔钛种植体。微孔氧化钛表面为miRNA负载提供了更大的表面积,使miRNA能够在孔隙内保留,直到细胞转染完成。将MSCs接种到miRNA功能化的微孔氧化钛表面后,观察到更高的miRNA转染效率,且没有明显的细胞毒性。同时可以上调MSCs成骨相关基因的表达,促进碱性磷酸酶的产生、胶原分泌和细胞外基质矿化等。
CS基纳米粒作为一种非病毒载体,已经被应用于miRNA正向转染体系的研究中,但其转染效率接近70%[13-15]。Wang等[16-17]以CS-HA为载体,制备了CS/HA-miRNA NPs反向转染体系。先将CS/HA-miRNA NPs交联在微孔氧化钛表面,发现对人MSCs的转染效率≥90%。将CS/HA-miRNA NPs交联培养板上对骨髓MSCs细胞膜片的转染效率进行观察,发现转染效率在80%以上,且均可以显著提高MSCs的成骨相关基因的表达水平。
miRNA对多种干细胞的分化具有调控作用[4],miR-21是一种具有很强的促进成骨分化作用的miRNA,可以上调成骨相关基因的表达[18]。Yang等[9]以慢病毒作为载体,构建miRNA-21/LacZ转染体系并转染BMSCs,在体外显著提高了骨形成蛋白-2(BMP-2)、RUNX2、OCN、OPN、低氧诱导因子-1α(HIF-1α)和血管内皮生长因子(VEGF)表达水平;用miRNA-21/LacZ转染大鼠BMSCs,再种植于β-磷酸三钙支架材料内,最后植入修复大鼠颅骨极限缺损处,取得了显著的促进骨再生效果。
本研究选择miR-21作为反向转染PDLSCs的目的基因,实验结果证实CTH/miR-21 NPs可以成功地转染PDLSCs,并显著提高相关成骨基因的表达水平,为反向基因转染技术应用于牙周组织再生提供了新的思路。

