清肾颗粒对慢性肾衰竭大鼠肾组织细胞自噬及凋亡的影响和机制研究
赵 晔,王秀颖,于 磊
随着各种慢性肾脏疾病的进展,最终会出现慢性肾衰竭(chronic renal failure, CRF),但是目前尚无有效治疗方法,肾移植虽然可以治愈CRF,但是其治疗难度大、费用高,难以广泛应用[1]。有研究显示,肾组织细胞过度凋亡是引起肾功能障碍的重要机制[2]。自噬是一种细胞自我溶解的过程,其可将损伤的细胞器或大分子蛋白分解为小分子片段,并被细胞重新利用,研究显示促进自噬会抑制肾组织中的细胞凋亡并保护肾功能[3]。近年来,中药在治疗CRF方面有显著的进展,清肾颗粒具有改善肾功能、抑制炎症反应的作用[4],但其作用机制尚不明确。本研究通过动物实验,探究清肾颗粒通过调控凋亡和自噬对CRF的作用,为临床更好的治疗CRF提供理论依据。
1 材料与方法
1.1实验动物和仪器 SD大鼠(清洁级,雌性,200±20 g,北京维通利华实验动物技术有限公司),腺嘌呤(Sigma公司,美国),ELISA和TUNEL凋亡试剂盒(碧云天公司,中国),抗体(Abcam公司,美国),PVDF膜(Bio-Rad公司,美国),化学发光试剂盒(Amersham,美国),显微镜(Olympus,日本)。
1.2模型制备和干预方法 30只大鼠随机分为对照组、CRF组和CRF+清肾颗粒组,每组10只。CRF组和CRF+清肾颗粒组应用腺嘌呤构建CRF模型,其具体方法是在普通饲料中掺有5%的腺嘌呤,自由进食,共进行3周。CRF+清肾颗粒组给予清肾颗粒灌胃治疗,将清肾颗粒溶于生理盐水,根据临床用量[4]和《实验药理学》[5]换算大鼠的清肾颗粒用药量,剂量为20 mg/kg,每日1次,连续3周,对照组、CRF组给予等量生理盐水灌胃。
1.3观察指标和检测方法
1.3.1ELISA检测肾功能指标:大鼠剪尾取血,离心(2000 r/min,20 min)后取上层血清,根据试剂盒的说明加入抗体和显色剂,利用酶标仪检测450 nm下的吸光度,通过标准曲线计算血清中尿素(BUN)、肌酐(Scr)的浓度。
1.3.2HE染色检测肾组织损伤:大鼠通过腹腔注射过量2%戊巴比妥麻醉、断头处死,取出肾组织,用4%多聚甲醛固定并用梯度乙醇脱水,石蜡包埋,制成4 μm的组织玻片标本。用苏木精在室温下染色10 min,然后用0.5%伊红水溶液室温下染色3 min。显微镜下观察HE染色结果。
1.3.3TUNEL染色检测细胞凋亡情况:将“1.3.2”中的切片根据试剂盒说明书进行操作,将其放置于TUNEL溶液中,在37℃下孵育1 h,之后依次进行显色、DAPI染色细胞核,然后进行封片。凋亡率=凋亡阳性细胞数/总细胞数×100%。
1.3.4Western blot检测自噬蛋白以及核因子-κB(NF-κB)通路:用组织匀浆机将肾组织均匀研磨萃取总蛋白,蛋白浓度通过BCA试剂盒测量。每组取总量为40 μg的总蛋白使用10%的聚丙烯酰胺凝胶进行电泳(PAGE,80~120 V,90 min)。在100 mV的恒定电压下与PVDF膜进行湿转移。在5%牛血清白蛋白(BSA)中于室温孵育1 h。将1∶500稀释的anti-Beclin1、anti-LC3、anti-NF-κB和anti-IκBα添加到膜中,并在4℃下孵育过夜。洗涤后在室温下添加二抗孵育1 h。然后加入化学发光试剂进行显影。GAPDH用作内参,用Image J测量灰度值计算蛋白的相对表达水平。
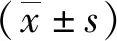
2 结果
2.1肾功能指标 CRF组BUN和Scr水平高于对照组,CRF+清肾颗粒组BUN和Scr水平显著低于CRF组(P<0.05,P<0.01)。见表1。
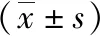
表1 3组大鼠血清BUN、Scr水平比较
2.2肾组织损伤情况 对照组大鼠肾组织中细胞结构、形态、排列正常,染色均匀,肾小球和肾小管结构清晰可见。CRF组中细胞染色不均匀,细胞形态发生改变,肾小球和肾小管结构丧失,细胞出现大量凋亡。CRF+清肾颗粒组可见肾小球结构,但是结构数量较少,且也有细胞凋亡情况出现。见图1。

图1 3组大鼠肾组织损伤情况(HE×100)CRF为慢性肾衰竭
2.3肾组织中细胞凋亡水平 蓝色为细胞核染色,红色为凋亡细胞。见图2。对照组、CRF组和CRF+清肾颗粒组肾组织中细胞凋亡率分别为(7.12±1.43)%、(28.35±3.89)%、(15.46±2.61)%。CRF组肾组织中细胞凋亡率高于对照组,CRF+清肾颗粒组低于CRF组(P<0.05)。

图2 3组大鼠肾组织中细胞凋亡情况(TUNEL×400)CRF为慢性肾衰竭
2.4自噬水平比较 CRF组自噬标志蛋白Beclin1和LC3水平低于对照组,CRF+清肾颗粒组Beclin1和LC3水平高于CRF组(P<0.01)。见图3和表2。
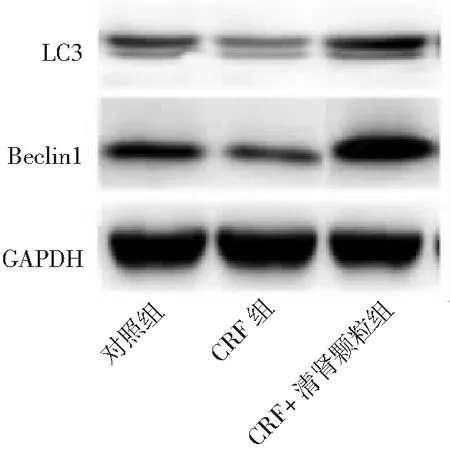
图3 3组大鼠肾组织细胞Beclin1和LC3表达情况CRF为慢性肾衰竭,Beclin1和LC3为自噬标志蛋白
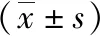
表2 3组大鼠肾组织细胞自噬标志蛋白Beclin1和LC3水平比较
2.5NF-κB和NF-κB抑制因子α(IκBα)蛋白水平 CRF组NF-κB和IκBα蛋白水平高于对照组,CRF+清肾颗粒组NF-κB和IκBα蛋白水平低于CRF组(P<0.05,P<0.01)。见图4和表3。
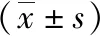
表3 3组大鼠肾组织中NF-κB和IκBα蛋白水平比较
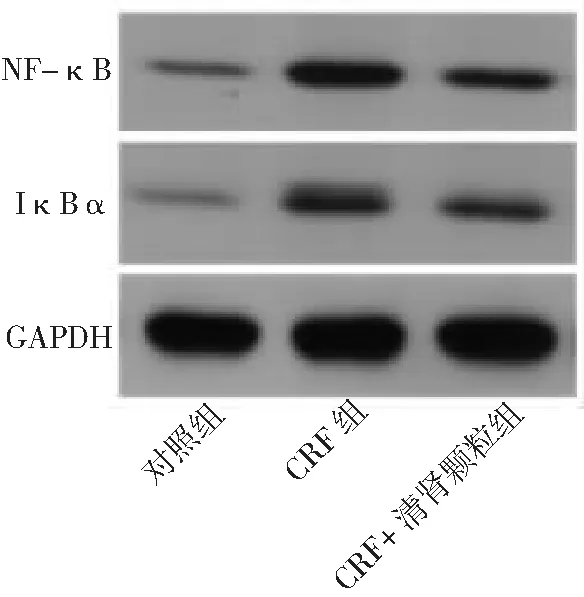
图4 3组大鼠肾组织中NF-κB和IκBα蛋白表达情况CRF为慢性肾衰竭,NF-κB为核因子-κB,IκBα为NF-κB抑制因子α
3 讨论
CRF是一种以肾功能进行性和不可逆性恶化为特征的综合征。CRF主要由高血压、肾小球肾炎和糖尿病引起[6]。与其他慢性疾病患者相比,CRF患者往往需要更长时间、更频繁的住院治疗。肾衰竭会严重影响患者的生命健康和生活质量,是日益严重的公共卫生问题。
在中医中,CRF的特点是湿热、瘀血,清肾颗粒的主要成分包括白花蛇舌草、丹参、茵陈等,具有清热化湿祛瘀的功效。近年来临床上大量的研究已经证实了清肾颗粒在CRF中的作用,有研究显示清肾颗粒可以改善氧化应激,从而改善CRF患者的肾功能[7]。王亿平等[8]研究发现,清肾颗粒可以抑制CRF患者炎性细胞因子的水平,但是关于清肾颗粒治疗CRF的机制尚不清楚。肾组织中的细胞不受控制的凋亡和纤维化是导致CRF的重要机制。自噬是细胞应对外界压力的一种适应性反应,研究显示诱导自噬可以抑制凋亡。本研究结果显示,CRF组BUN、Scr、肾组织细胞凋亡率高于对照组,自噬标志蛋白Beclin1和LC3水平低于对照组;CRF+清肾颗粒组BUN、Scr水平、肾组织细胞凋亡率低于CRF组,Beclin1和LC3水平高于CRF组。提示CRF模型大鼠肾组织细胞的凋亡水平升高而自噬水平降低,给予清肾颗粒灌胃干预后,肾组织损伤显著缓解,肾功能指标改善。研究显示,清肾颗粒的主要成分白花蛇舌草、丹参、茵陈均具有诱导自噬和抑制凋亡的作用[9-11]。提示清肾颗粒可能通过诱导自噬抑制凋亡改善CRF大鼠模型的肾功能。
为进一步分析清肾颗粒调控自噬和凋亡的机制,对肾组织中NF-κB通路的影响。研究已经证实NF-κB通路的激活会通过诱导凋亡和氧化应激引起CRF大鼠肾组织中细胞的凋亡,参与CRF进程[12]。此外,NF-κB通路也具有调控自噬的作用,从而抑制炎症反应缓解脂多糖诱导的肾损伤[13]。本研究结果显示,CRF组NF-κB和IκBα蛋白水平高于对照组,CRF+清肾颗粒组NF-κB和IκBα蛋白水平低于CRF组。有研究显示清肾颗粒会抑制CRF患者血清中的NF-κB水平和氧化应激反应[14]。研究显示以白花蛇舌草为主要成分的中药方可以抑制糖尿病肾病患者血清中NF-κB水平[15]。丹参的主要活性成分丹参酮ⅡA也可以通过抑制NF-κB缓解氧化应激反应[16]。也有动物实验研究结果显示,以茵陈为主的中药方剂可以抑制NF-κB通路调控自噬和炎症反应[17]。提示清肾颗粒可以通过抑制NF-κB通路诱导自噬抑制凋亡。
综上所述,清肾颗粒可以通过抑制NF-κB通路诱导肾组织细胞的自噬,从而抑制凋亡,缓解CRF大鼠模型的肾功能。关于清肾颗粒调节NF-κB通路和自噬的机制仍需要进一步研究。

