NGF、TRPV1在子宫内膜异位症患者中的表达及与疼痛的关系
杨 剑,孟 鑫,李 颖,李清雪,支 政,杜惠兰,潘 莉,陈景伟
子宫内膜异位症(endometriosis, EMs)是指正常子宫内膜组织生长、浸润在子宫体以外的部位[1-2],以盆腔痛、不孕、月经异常为主要表现,已成为困扰广大女性的常见病。近年EMs发病率为10%~15%,疼痛是EMs的典型症状,临床可见痛经、盆腔痛、性交痛、排便痛等[3],严重影响患者身心健康。EMs疼痛的发病机制尚不明确,是当前国内外医学界关注的热点问题。香草酸瞬时受体亚型1(transient receptor potential vanilloid 1, TRPV1)是一类非选择性阳离子通道,主要分布在感觉神经元中,是一种外周伤害性感受器,参与和介导了外周炎症时伤害性初级传入纤维的敏化过程,在热痛、酸痛、神经痛、内脏痛等多种病理性疼痛中发挥重要作用。TRPV1在组织损伤或炎症过程中可被多种炎性介质所激活[4],在炎症与疼痛中起着至关重要的作用。近年研究发现TRPV1与EMs患者慢性盆腔痛及疼痛的程度密切相关,但具体作用机制并不明确[5-7]。神经生长因子(nerve growth factor, NGF)除了具有营养神经的作用外,还可通过敏化TRPV1通道,增加机体对伤害性刺激的敏感性参与疼痛的发生[8]。本研究回顾性分析EMs患者在位、异位内膜组织中NGF和TRPV1的表达特征,分析其与EMs疼痛的相关性,并探讨NGF与TRPV1在EMs疼痛发病中可能的作用机制。
1 资料与方法
1.1临床资料 选择2017年1月—2019年12月在石家庄市第四医院就诊且符合EMs诊断标准及纳入标准的EMs患者50例为观察组,其中无痛组14例,疼痛组36例。选择同期就诊的妇科良性病变且无痛经患者20例为对照组。全部患者知情同意,术前3个月无激素类药物治疗史。本研究经河北中医学院医学伦理委员会批准后进行,批准号:YXLL2020029。
1.2疼痛评分 根据视觉模拟评分法(visual analogue scale, VAS)对患者疼痛程度进行评分。疼痛判定标准:0分为无痛;1~3分为轻度疼痛;4~6分为中度疼痛;7~10分为重度疼痛。
1.3主要试剂 兔抗NGF单克隆抗体,Epitomics公司(YH072703C);兔抗TRPV1多克隆抗体,GeneTex公司(821303237);SYBR Green荧光定量PCR试剂盒:加拿大MBI公司(K0251)。
1.4诊断及病例选择标准 诊断标准:盆腔或B超检查发现EMs病灶;疼痛(痛经、慢性盆腔痛、性交痛等)、不孕;术后经病理证实[9]。纳入标准:符合诊断标准;年龄20~50岁,未绝经妇女;无内科合并症;接受其他药物治疗者停药3个月以上。排除标准:合并妇科良恶性肿瘤;合并心血管疾病;其他药物治疗停药未超过3个月;合并有精神、神经疾患者。
1.5取材方法 所有患者于手术时取在位内膜、异位内膜及正常内膜,部分组织多聚甲醛溶液固定用于免疫组化染色;部分组织-80℃保存,用于蛋白及mRNA检测。
1.6检测指标
1.6.1免疫组化SP法检测NGF、TRPV1表达:采用HMIAS-2000高清晰度彩色病理图文分析系统分析NGF、TRPV1表达的平均光度值,每一切片测5个视野。
1.6.2Western blot法检测NGF、TRPV1蛋白表达:提取蛋白并进行蛋白定量后,与上样缓冲液混匀后变性、冷却离心,-20℃保存备用。制胶,插入梳子,加入相应蛋白样品及标准蛋白标志物,电泳分离、转膜后5%脱脂牛奶封闭,加NGF、TRPV1及内参β-actin等一抗4℃过夜,次日经TBST漂洗3次,每次10 min,加相应二抗孵育1 h,使用LI-COR Odyssey红外荧光扫描成像系统扫描显影。
1.6.3Real-time PCR检测NGF mRNA、TRPV1 mRNA表达:将组织用Trizol一步法提取总RNA,测定RNA纯度。PCR反应结束后获取循环阈值,以GAPDH为内参照基因,与对照组相比,得到目的基因的Ct值,按照公式RQ=2-ΔΔCt计算目的基因表达的相对定量值[10]。
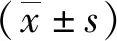
2 结果
2.1免疫组化法检测NGF、TRPV1表达情况 EMs在位内膜、异位内膜腺体及间质中均可见NGF阳性表达,以胞浆表达为主,呈棕黄色颗粒状。见图1。EMs在位内膜、异位内膜腺体中可见TRPV1表达,以胞浆表达为主,呈棕褐色颗粒。见图2。观察组NGF和TRPV1表达水平高于对照组(P<0.01);疼痛组在位内膜NGF和TRPV1表达水平高于无痛组及对照组(P<0.05,P<0.01),无痛组与对照组比较差异无统计学意义(P>0.05)。疼痛组异位内膜NGF和TRPV1表达水平高于无痛组(P<0.01)。见表1、2。
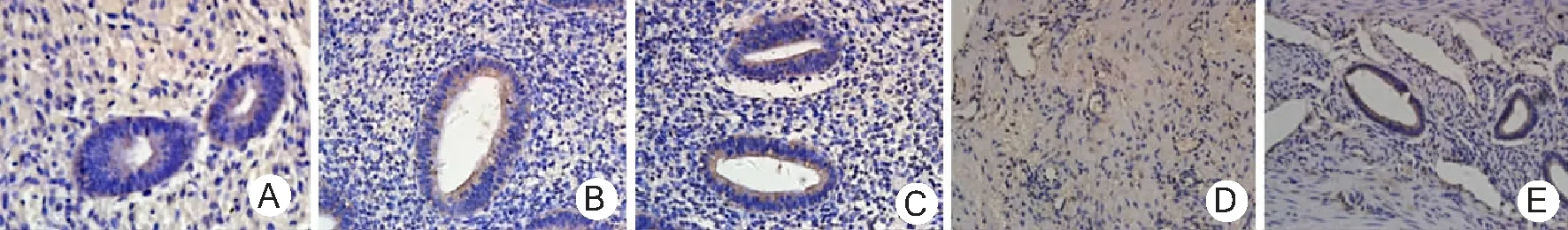
图1 对照组和EMs患者在位内膜和异位内膜腺体及间质中NGF表达情况(SP×400)EMs为子宫内膜异位症,NGF为神经生长因子;A.对照组内膜,B.无痛组在位内膜,C.疼痛组在位内膜,D.无痛组异位内膜,E.疼痛组异位内膜;无痛组和疼痛组为EMs患者
图2 对照组和EMs患者在位内膜和异位内膜腺体中TRPV1表达情况(SP×400)EMs为子宫内膜异位症,TRPV1为香草酸瞬时受体亚型1;A.对照组内膜,B.无痛组在位内膜,C.疼痛组在位内膜,D.无痛组异位内膜,E.疼痛组异位内膜;无痛组和疼痛组为EMs患者
表1 对照组和EMs患者在位内膜NGF、TRPV1表达水平比较
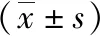
表2 EMs异位内膜NGF、TRPV1表达水平比较
2.2NGF、TRPV1、VAS相关性分析 NGF与TRPV1在EMs在位内膜及异位内膜的表达呈正相关(r=0.530、0.592,P<0.01、<0.05);NGF在EMs在位内膜及异位内膜的表达与VAS评分呈正相关(r=0.469、0.826,P<0.05、<0.01);TRPV1在EMs在位内膜及异位内膜的表达与VAS评分呈正相关(r=0.794、0.667,P均<0.01)。
2.3Western blot法检测NGF、TRPV1蛋白表达情况 疼痛组在位内膜NGF、TRPV1蛋白表达水平高于对照组与无痛组(P<0.05,P<0.01),无痛组与对照组比较差异无统计学意义(P>0.05)。疼痛组异位内膜NGF、TRPV1蛋白表达水平高于无痛组(P<0.05,P<0.01)。见图3,表3、4。

图3 对照组和EMs患者在位内膜和异位内膜NGF、TRPV1蛋白的表达情况EMs为子宫内膜异位症,NGF为神经生长因子,TRPV1为香草酸瞬时受体亚型1;1.对照组内膜,2.无痛组在位内膜,3.疼痛组在位内膜,4.无痛组异位内膜,5.疼痛组异位内膜;无痛组和疼痛组为EMs患者
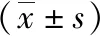
表3 对照组和EMs患者在位内膜NGF、TRPV1蛋白表达水平比较
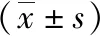
表4 EMs异位内膜NGF、TRPV1蛋白表达水平
2.4NGF和TRPV1 mRNA表达情况 与对照组比较,观察组在位内膜NGF mRNA、TRPV1 mRNA水平显著升高(P<0.01);与对照组及无痛组相比,疼痛组在位内膜NGF mRNA、TRPV1 mRNA水平升高(P<0.01)。疼痛组异位内膜NGF mRNA、TRPV1 mRNA水平高于无痛组(P<0.01)。见表5、6。
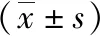
表5 对照组和EMs患者在位内膜NGF mRNA、TRPV1 mRNA表达水平比较
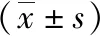
表6 EMs异位内膜NGF mRNA、TRPV1 mRNA表达水平比较
3 讨论
EMs的疼痛机制尚不明确,涉及神经性疼痛、炎症性疼痛、内脏性疼痛等多种形式的病理性疼痛。已有研究证实,NGF和神经纤维的异常表达与EMs疼痛的严重程度相关[11]。本研究证实NGF的表达水平与EMs患者的VAS评分呈正相关,提示NGF异常表达参与EMs疼痛的发生。NGF可以使异位病灶周围正常组织的神经纤维向异位病灶内生长,诱导P物质、降钙素基因相关肽(CGRP)、神经肽等致痛物质的生成,刺激末梢神经纤维,产生疼痛。NGF是神经元存活和维持所必需的营养因子,过度表达诱导神经纤维的产生,导致持续性疼痛的发生。此外,NGF也是一种炎症痛觉过敏的关键性调节因子[12],其与受体结合后可诱导热敏通道TRPV1敏化,增强神经元放电,参与痛觉过敏的病理过程[13]。同时有研究指出,NGF刺激可以增强辣椒素诱发的DRG神经元内向电流,提示NGF对TRPV1通道具有敏化作用[14]。
TRPV1是一种非选择性阳离子通道,广泛分布于初级感觉神经元末梢的伤害性感受器,可参与炎症和痛觉过敏的形成[15]。同时介导温度感受和疼痛感觉,被称为感觉叠加的积分器[16]。TRPV1通道被NGF、缓激肽等炎性因子激活后,启动细胞内瀑布信号转导,从而诱导痛觉过敏[17]。本研究证实,热敏通道TRPV1在EMs在位内膜、异位内膜均有表达且与疼痛程度呈正相关,提示TRPV1参与EMs疼痛的发生。相关性分析显示,NGF与TRPV1在EMs在位和异位内膜的表达呈正相关关系,提示EMs患者异常表达的NGF促进了TRPV1受体的表达,使感觉神经末梢痛觉敏感性增加,对EMs疼痛的持续存在产生作用。
综上所述,NGF在EMs疼痛患者在位内膜及异位内膜中的表达水平明显升高,异位病灶一旦形成后,局部存在缺血、缺氧、炎症等病理状态,众多因素联合作用使局部组织酸化,增强TRPV1的活性,促进TRPV1在EMs中异常表达,同时,这些因素可以降低TRPV1激活的温度阈值,使其在体温下就可以被激活[18],TRPV1被激活后使EMs局部病灶细胞产生Ca2+及致炎致痛因子,这些因子可以作用于内膜异位灶附近的伤害感受器上的TRPV1通道,影响其门控开关,从而引起痛觉感受;NGF作为炎性因子可以敏化TRPV1通道而促进该作用,这也许是EMs患者感到疼痛的原因之一。提示通过抑制NGF及TRPV1的表达,可缓解或阻断EMs疼痛的发生,而EMs患者过度表达的NGF及TRPV1之间具体的分子调控机制有待进一步研究。

