镓基液态金属微/纳米液滴的合成及其在生物医学中的应用*
熊建钧,严骏杰,杨敏△
(1. 南京医科大学药学院,南京 211166;2. 国家卫生健康委员会核医学重点实验室,江苏省分子核医学重点实验室,江苏省原子医学研究所,无锡 214063)
1 引 言
液态金属是熔点低于或接近室温的金属或金属合金[1-2],如汞(Hg, 熔点-39 ℃)、铷(Rb, 熔点38.89 ℃)、铯(Cs, 熔点28.40 ℃)、钫(Fr, 熔点27 ℃)和镓(Ga, 熔点29.8 ℃)[3]。其中,铷、钫化学性质活泼,铯具有放射性,汞毒性较高,因此限制了它们的应用[4-6]。镓基液态金属因表面自钝化层的存在,表现出较高的化学稳定性。一些研究也揭示了镓基液态金属在电、热、机械和流体等方面的特性[7-9]。
合金的熔点与其组成密切相关,镓易于和其他金属(铟(In)、铋(Bi)、锡(Sn)、铅(Pb)、锌(Zn)、铝(Al))结合形成低熔点合金[10]。目前,商品化的镓基液态金属合金主要包括镓铟合金(EGaIn, Ga 75 wt% and 25 wt%)[11]和镓铟锡合金(EGaInSn, Ga 68 wt%, In 22 wt% and Sn 10 wt%)[12],拓宽了镓基液态金属的应用范围。镓基液态金属微/纳米液滴在药物递送、电子(可穿戴)器件、分子影像、肿瘤治疗和催化等领域也展现出了一定的潜力[13-16]。
在此,我们对当前典型液态金属的物理特性进行了总结(见表1),重点介绍了液态金属微/纳米液滴的合成方法及其在生物医学领域中的最新研究进展,并对液态金属微/纳米液滴的前景进行了展望。
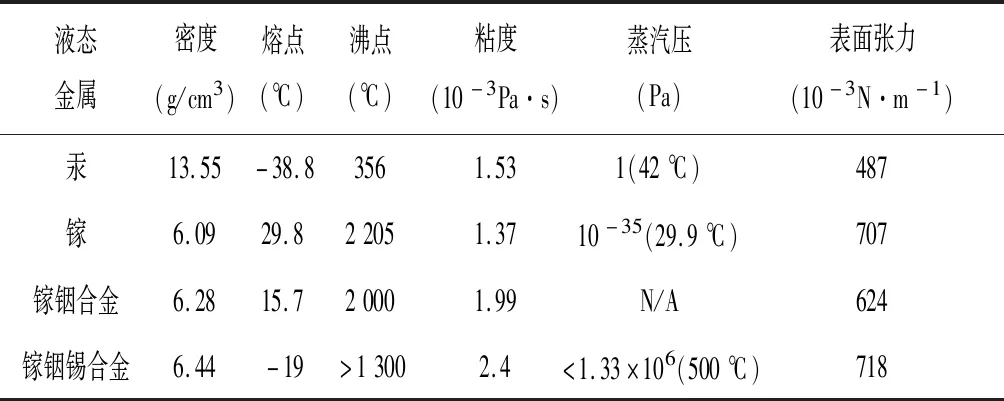
表1 当前典型液态金属的物理特性
2 液态金属微/纳米液滴的合成
液态金属表面形成的自钝化层在控制液态金属微/纳米液滴形貌和尺寸上起着至关重要的作用。通过控制配体种类、液态金属/配体投料比、超声时间和超声悬液温度可以获得各种不同的纳米结构[17]。一般而言,制备液态金属微/纳米液滴的基本方法主要包括自下而上(Bottom-up)和自上而下(Top-down)法。
2.1 自下而上法
自下而上法通常是利用金属盐前驱体的化学(生物)还原反应,该方法适合制备形状均一、尺寸分布较窄的微/纳米液滴。分布不均的液滴尺寸会限制其光学和生物学应用,只有尺寸可控的液态金属微/纳米液滴才能被用于提供理想的特性[5]。因此,一些研究利用自下而上法来制备尺寸可控的镓基液态金属微/纳米液滴。
2.1.1热分解法 热分解法在自下而上法中具有代表性。该方法一般是将金属有机化合物作为反应前驱体,在含有表面活性剂或配体的热溶剂中进行反应。传统的热分解法由于缺乏稳定剂,导致合成的金属纳米液滴尺寸分布宽泛[18]。之后的研究发现,在反应体系中加入配体或表面活性剂后,制得的纳米液滴分散性好、形状均一,因此被广泛应用[19]。目前,已有研究利用热分解法并使用金属-烷基/硅氨基作为前驱体来合成镓基液态金属微/纳米液滴。Yarema等[20]首次以镓-烷基胺(Ga(NMe2)6)作为前驱体分散到二辛胺(DOA)中,然后高温快速注入1-十八烯(ODE)的热溶剂中,成功合成了单分散的胶体镓纳米颗粒(GaNP),并通过调节DOA的剂量、反应时间和反应温度实现了GaNP粒径在12~46 nm的精确控制和7.4%的窄尺寸分布。之后,He等[21]将油胺(R-NH2)作为配体通过复分解反应迅速制得了长链的镓-油胺复合物(Ga(R-NH)n),并通过热分解法制得粒径在5~30 nm,尺寸分布在5%~10%的镓纳米液滴。该方法省略了对水、氧气易敏前驱体的制备、存储和后处理,为实现参数可控的液态金属纳米液滴的制备提供了便利。
2.1.2物理沉积法 物理沉积法能够合成尺寸和粒径分布较窄的金属微纳米液滴。Taccardi等[16]将三乙胺镓烷(Et3NGaH3)沉积在大孔玻璃上,受热分解获得金属镓纳米液滴并释放出氢气和三乙胺,生成的液滴直径从数百纳米到数微米不等。Yang等[22]利用分子束外延(MBE)将镓纳米液滴沉积到蓝宝石衬底上,证明了液态金属纳米液滴能通过分子束合成。Ghigna等[23]在真空条件下,通过镓的热蒸发得到了由纳米液滴组成的镓膜,当温度控制在90~350 K时,尺寸分布在5~150 nm。
2.2 自上而下法
自上而下法是将宏观材料制成微/纳米液滴最常用的方法。采用超声波降解、机械搅拌等方法即可获得所需的微/纳米液滴[24]。利用超声波分解制得的微/纳米液滴通常呈球状,改变反应条件可生成棒状或米粒状的液态金属纳米液滴,不同形貌的纳米液滴拓宽了液态金属在生物医学领域的应用范围[25-26]。
2.2.1超声波降解法 Lin等[27]利用超声波降解法制备了稳定的镓基液态金属纳米液滴。将聚(马来酸酐-alt-1-十八碳烯)(POMA)溶解在甲苯中,在超声条件下制成液态金属纳米液滴,液滴直径170 nm左右,在缓冲溶液中可以保存60 d以上。Yan等[17]通过调整液态金属/黑色素纳米粒子投料比、超声时间和反应温度,制得了纳米棒、纳米球和纳米米粒等多种形貌的镓基液态金属纳米液滴,成功实现了液态金属纳米液滴的形貌控制。Centurion等[28]利用没食子酸为配体,连续超声60 min,制得了粒径约(700 ± 20)nm的镓纳米液滴。此外,还发现镓纳米液滴的直径随着没食子酸含量的增加而减小,但仍未解决液滴尺寸分布较宽的问题。Yamaguchi等[29]首次报道了利用超声法可逆控制镓纳米液滴的尺寸,通过调节超声温度和硫醇表面活性剂的含量控制镓纳米液滴的尺寸,并利用盐酸移除镓基纳米液滴的表面氧化层,成功实现了镓基纳米液滴的融合与分散。
2.2.2机械搅拌法 Tevis等[30]采用一种可调节、绿色、低成本的流体剪切技术制备了镓基微/纳米液滴。该技术是液滴乳化技术(SLICE)的延伸,将约0.6 g镓铟合金置于5 % (v/v)乙酸溶液中,并以11 600 rpm的转速搅拌剪切20 min。在此过程中,镓铟纳米液滴(EGaIn NPs)的表面首先被氧化形成保护层,然后将醋酸盐修饰到氧化物表面形成具有稳定三层结构(液态金属核、氧化镓层、醋酸盐功能化的氧化层)的EGaIn NPs。该方法还可以通过调节搅拌速度、搅拌时间和表面稳定剂的含量合成多种尺寸、形状、组成和表面形态的微/纳米液滴。
3 生物医学应用
液态金属良好的流动性、生物相容性、高阻射性、优异的光热转换性能等特点,使其在各领域的应用越来越广泛,以下主要介绍镓基液态金属微/纳米液滴在生物医学工程领域的相关应用,见图1。
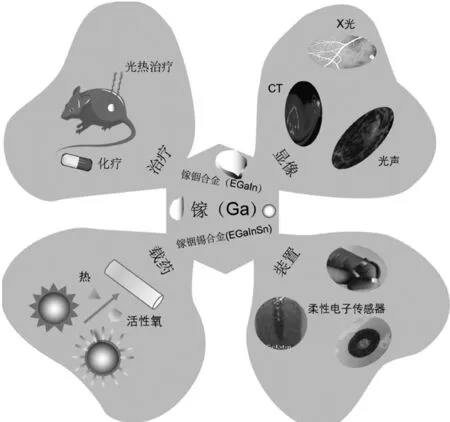
图1 镓基液态金属在不同的生物医学工程中的应用
3.1 药物递送
液态金属纳米液滴在没有封端剂或表面活性剂修饰的情况下,极易快速地聚沉。在使用硫醇等基团修饰后,不仅能形成稳定的液态金属纳米液滴悬液,而且在酸性条件下又能使液态金属纳米液滴发生融合并降解。Lu等[13]用巯基化(2—羟丙基)—β—环糊精(MUA—CD)和巯基化透明质酸(m—HA)两种配体作为封端剂来制备稳定的EGaIn NPs。同时,β—环糊精的七元糖环结构也为阿霉素(DOX)的装载提供了相应的位点。透明质酸是肿瘤细胞表面CD44受体的靶向基团,为该药物递送体系提供了良好的肿瘤靶向性。将此液态金属纳米液滴注入荷瘤鼠体内后,药物载体通过胞吞作用进入细胞,并在内涵体/溶酶体的酸性环境下促进药物释放。Lu等[31]发现将光敏剂(石墨烯量子点)包覆在EGaIn NPs表面,随后DOX通过π-π堆积作用负载到EGaIn NPs表面。在近红外激光的照射下,EGaIn NPs发生形变,实现了高效的药物控释。Fan等[32]利用液态金属优异的光热转换能力,制备了一种聚(N-异丙基丙烯酰胺—co—N, N—亚甲基二丙稀酰胺)(poly(NIPAm—co—MBA))水凝胶/液态金属(PNM/LM)药物递送体系。将DOX物理包埋进载体后,通过近红外光照射,温敏性水凝胶塌缩、挤压促发DOX的释放。
3.2 光热/光动力治疗
液态金属优异的光热转换效率可用于肿瘤光学治疗。Wang等[33]制备了一种镁-镓铟(Mg—GaIn)光热转换(PTC)材料,该材料毒性低、光热转换效率高、导热性佳,柔性和可塑性强,已用于荷瘤鼠的光热治疗实验评估其抗肿瘤效果。实验结果均表明Mg—GaIn具有最深的加热深度、最大的加热面积和最佳的肿瘤抑制率。此外,还发现Mg—GaIn光热转换效率(η)为42%,远高于EGaIn(26%)和去离子水(19%)。Xia等[34]将氧化锆(ZrO2)包覆在液态金属液滴表面,形成稳定的壳-核液态金属纳米液滴(LM@pZrO2NPs)。再通过聚乙二醇修饰改善LM@pZrO2NPs的生物相容性,同时保持其理想的光热(PT)转换性能,并被用于小鼠的抗肿瘤治疗。Sun等[15]利用巯基-聚乙二醇-巯基(SH—PEG—SH)作为表面活性剂,成功地制备了镓纳米球(GaNS)、镓纳米棒(GaNR)和镓铟合金纳米棒(LMNR),并探索了它们在激光照射下的抗癌潜力。结果表明在激光照射下,GaNR表现出了最佳的光热转换效率,并在体内外获得了最佳的光热效应。Hu等[35]合成了一种介孔氧化硅包覆的液态金属纳米液滴(LM@MSN),该液滴在酸性环境和多次激光照射下,仍然表现出良好的光热稳定性。实验证明,在激光照射条件下,光热协同化疗的方式能够显著抑制实体瘤生长。Hu等[36]将甲氧基聚乙二醇硫醇(mPEG-SH)作为表面活性剂合成了一种表面负载葡萄糖氧化酶(GOX)的液态金属纳米液滴(LM@GOX),用于饥饿/光热联合的肿瘤治疗,并实现了光热治疗和饥饿治疗的协同效应。
3.3 生物成像造影剂
镓基液态金属凭借良好的生物相容性、延展性、高阻射性等特点,已被用于CT、光声成象和X光成像。Xia等[34]合成了一种氧化锆包覆的镓铟液态金属纳米液滴(LM@pZrO2NPs)用于CT成像,证实了LM@pZrO2NPs浓度与CT值呈线性相关,验证其作为体内造影剂的潜力。Chechetka等[14]构建了一种用光聚合磷脂层稳定的多功能镓铟液态金属纳米囊泡。该纳米囊泡在350~800 nm的紫外-可见-近红外(UV-Vis-NIR)吸收光谱中没有表现出任何特征峰,但在680 nm处具有最大的光声信号,且光声信号强度与EGaIn纳米囊泡的浓度呈线性相关。Fan等[37]研制了一种功能复合型肿瘤栓塞水凝胶。将均匀分散有EGaIn NPs的海藻酸钠(sodium alginate,SA)水溶液与钙离子溶液混合后,即可快速形成液态金属/海藻酸钙(calcium alginate,CA)水凝胶。由于液态金属的高阻射性,LM/CA水凝胶也被用作造影剂。动物实验中,将LM/CA水凝胶注入大鼠股动脉、离体猪心、兔耳静脉和兔耳动脉后,CT造影均有明显增强。
3.4 生物传感器
Peng等[38]利用液态金属作为柔性填料,在亲水聚合物网络中实现超拉伸水凝胶的制备,并将其用作非对称力学传感器。在该水凝胶中,液态金属纳米液滴因其特性不仅显著增加了水凝胶基质的韧性(拉伸应变:~1500%)、压敏性(0.25 kPa-1)和电阻响应性(180 ms),而且还加速引发剂(过硫酸铵)产生自由基,促进凝胶化反应,迅速形成液态金属水凝胶。Liao等[39]研制了一种具优异溶解性和良好自愈合能力的液态金属水凝胶基可穿戴表皮传感器。该水凝胶的构建方法是将EGaInNPs分散到硼酸盐修饰的聚乙烯醇(PVA)网络中。一方面,PVA羟基可以作为配体与液态金属纳米粒子表面氧化层相互作用,实现了EGaIn NPs的稳定且均匀地分散于凝胶网络中;另一方面,由于PVA与硼酸四羟基离子之间存在动态交联键,从而使其具备良好的自愈合能力。此外,研究人员还证明了该水凝胶良好的传感性能、高灵敏度以及较宽的压力检测范围(2~120 kPa)。
4 总结与展望
由于镓基液态金属具备柔韧性、流动性和高表面张力等特性,导致其合成方法有别于传统的金属纳米颗粒。自下而上法对于控制液态金属纳米液滴颗粒的大小和拓扑结构是可行的,但它通常不能控制化学计量的组成;而自上而下法可以很容易地控制化学计量的组成,并通过一定的外部能量输入即可将宏观的液态金属转化为微/纳米液滴[40]。
然而,液态金属纳米液滴合成过程中的尺寸控制和形貌控制仍然具有挑战性。对于许多应用来说,严格尺寸控制是很重要的。通过表面活性剂与氧化层之间的静电作用来控制形貌的可能性已经被证明[15,25]。一些带正电荷的表面活性剂(溶菌酶和十六烷基三甲基溴化铵)可稳定具有负电荷氧化层的液态金属纳米液滴表面,使其由球形向棒状的一羟基氧化镓(GaOOH)转变。最新研究还涉及将聚合物包覆在液态金属纳米液滴表面,这也表明解决该问题或许可以通过测试新型的封端剂和表面活性剂来实现[41]。LMs在生物医学应用中的毒性问题仍然存在争议。就目前研究结果来看,镓和镓基合金具有良好的生物相容性,并被广泛用作汞的替代品。事实上,镓铟锡合金作为牙体填料已被临床应用,其生物安全性已被证实[6]。然而,由于人体内是一个复杂的环境,涉及各种动态的生物和化学变化,因此对LMs急性和慢性毒性的综合研究还很有限。尤其是当LMs被加工成各种形态的微小尺寸液滴时,其生理行为可能会有很大的差异。因此,需对LMs的毒理学进行更深入的研究。此外,由于LMs表面氧化层的存在,黏性增加,使其容易附着在陶瓷、玻璃、高分子等多种材料的表面,这在一定程度上牺牲了其自身的流动性。有研究使用低压作为控制LMs形状和流体行为的手段,证明了利用电化学法去除或沉积氧化物的可行性[42]。同时LMs粘稠的表面也会导致每次使用注射器或移液管转移LMs时造成损失,给准确定量镓基LMs带来了挑战。因此,急需一种简单的试剂(抗氧化剂,不含酸或碱)或一种能够控制氧化层存在的策略。最后,在实际应用和推广之前,生物材料的成本是需要考虑的重要问题。银具有各种优良的性能,但成本较高是其难以被广泛应用的原因之一。镓的价格大约是银的三分之一,直接成本较低。然而在自然界中不存在游离的镓,需要从不同的矿物中提取,间接增加了成本。此外,在利用超声波降解法制备液态金属纳米液滴的过程中,大量原始LMs的丢失,无形中也提高了镓的成本。基于以上事实,LMs的总成本无法显著降低。因此,从长远来看,开发具有相似性能的新型材料非常必要。
尽管液态金属在生物医学、等离子体、电子学、电化学及催化等领域均有一些应用,但关于镓基液态金属微/纳米液滴相对宏观液态金属或其他固体(非流体)金属微/纳米颗粒在相关方面的研究仍处于相对初级阶段。我们相信,以上挑战也将为液态金属材料的制备和应用带来巨大的机遇。

