微囊藻毒素-LR对鲤鱼上皮瘤细胞活力及显微、超微结构的影响
刘 林,何 丽,林长高,周 颖,隗黎丽
(江西农业大学动物科学技术学院,江西南昌 330045)
【研究意义】近年来,淡水水体富营养化现象日益严重,由此导致的蓝藻水华污染问题已受到国内外学者的广泛关注。一些常见的蓝藻类如铜绿微囊藻和鱼腥藻等可在其细胞内部合成产生多种微囊藻毒素(microcystins,MCs)[1],其中微囊藻毒素-LR(microcystin-LR,MC-LR)是MCs异构体中最为常见且毒性最强的一种毒素[2]。已有研究表明MC-LR 可通过口、鳃或皮肤进入鱼体内,干扰鱼类的正常生长发育,危害鱼类种群安全。同时,MC-LR 进入鱼体后还能通过食物链的生物富集对人类健康造成威胁[3]。鱼类体表是抵御MC-LR 进入鱼体的第一道防线,但且其体表上皮细胞无法形成角质化,比哺乳动物体表上皮细胞更为脆弱[4]。因此,了解MC-LR 对鱼类体表上皮细胞所造成的影响具有十分重要的生态学意义。【前人研究进展】MC-LR 可通过特定的转运系统,即有机阴离子转运多肽(organic anion transporting polypeptides,OATPs)主动转运进入鱼体内[5],并蓄积在肝脏、肾脏和性腺等组织器官中,从而产生多种毒性作用[6]。如Jiang 等[7]研究表明,MC-LR 可通过促进鲤鱼肝脏中活性氧(reactive oxygen species,ROS)的生成,诱导鱼体肝细胞氧化应激和细胞凋亡,最终导致肝脏损伤。而Huang等[8]则指出,MC-LR暴露可对草鱼肾细胞中细胞骨架相关基因的表达产生影响,导致细胞骨架发生解体或重排。除此之外,MC-LR还可通过诱导细胞自噬、线粒体损伤、细胞膜完整性丧失或脂质过氧化等机制发挥毒性作用[9-10]。【本研究切入点】有学者[11]发现:MC-LR可通过细胞膜扩散进入人表皮细胞中,并对细胞增殖、细胞骨架及细胞器结构产生不利影响。亦有研究[12]指出当动物体表受损时,MC-LR可更快的通过表皮渗透进入细胞中。这些研究提示MC-LR 接触动物体表后产生的影响值得重视,但MC-LR 在鱼类体表中的研究却较为匮乏。【拟解决的关键问题】本研究以鲤鱼EPC 细胞作为鱼类体表上皮细胞模型,采用MTT 法检测MC-LR对EPC 细胞活力的影响,同时对MC-LR 暴露后的EPC 细胞显微结构和超微结构进行观察,以期为进一步研究MC-LR对鱼类上皮细胞的影响的机理奠定基础。
1 材料与方法
1.1 材料和试剂
鲤鱼EPC细胞由江西师范大学付建平老师馈赠。M199培养基、0.25%胰蛋白酶(含EDTA)及胎牛血清(FBS)购于BioInd 生物科技公司。青链霉素混合液(青霉素100 U/mL、链霉素100µg/L)、二甲基亚砜(DMSO)及MTT 购于索莱宝科技有限公司,其中MTT 用磷酸缓冲液(PBS,0.01 mol/L,pH 7.2~7.4,博士德生物科技公司)溶解至5×103mg/L,经0.22µm滤膜过滤除菌后保存于-20 ℃备用。2.5%戊二醛、1%锇酸和丙酮等电镜切片制作所用试剂购于赛维尔生物科技有限公司。MC-LR(纯度>95%,Taiwan Algal Sci⁃ence Inc)用超纯水溶解至1×103mg/L的母液保存于-20 ℃备用,使用前用细胞培养液(含10%FBS、1%青链霉素混合液和89%M199培养基)稀释至所需浓度。
1.2 细胞培养
将细胞冻存管置于28 ℃水浴锅中迅速解冻细胞,加入PBS后离心收集细胞,弃上清,再用PBS洗2~3遍后加入细胞培养液,吹散细胞制成单细胞悬液,将细胞悬液接种在75 cm2的细胞培养瓶中,置于28 ℃、5%CO2饱和湿度培养箱中培养,每2~3 d更换培养液。待培养瓶中的细胞密度生长至90%左右时,即可使用0.25%胰蛋白酶消化细胞并传代至96孔培养板中培养。
1.3 MTT法检测细胞活力
将EPC 细胞以1.2×104个/孔接种于96 孔板中,于培养箱中培养至细胞铺满孔底,随后弃去培养液,再分别加入0.05,0.5,5,50 mg/L MC-LR的细胞培养液于96孔板中,同时设置空白组和对照组,每组设5个复孔。继续培养24 h 后,弃去培养液。每孔加入100µL 培养液和20µL MTT,在培养箱中孵育4 h 后将培养液吸去,然后加入150µL DMSO,继续放入培养箱中孵育10 min。待孔板中的甲臢溶解后,用酶标仪在570 nm 波长处测定各孔吸光值,根据OD570值计算细胞活力(%)。同时,采用SPSS 25.0 软件进行线性回归分析,将试验组细胞活力(%)作为响应频率,对照组细胞活力(100%)作为总数,MC-LR 处理浓度作为协变量,获得MC-LR对EPC细胞的IC50(24 h)。细胞活力(%)计算公式如下:

1.4 电镜切片制作与观察
将EPC 细胞以4×105个/孔接种于6 孔板中培养,待孔板中的细胞铺满孔底后,分别加入0、4.5 mg/L(1/4IC50)和18 mg/L(IC50)MC-LR的培养液培养24 h后,在倒置显微镜(江南XD-202)下观察并拍照。弃去培养液,先用PBS 洗2~3遍后,再用胰蛋白酶消化并收集细胞,接着再用PBS 洗1~2遍,随后加入2.5%戊二醛4 ℃下预固定4 h,再用PBS 冲洗,然后用1%锇酸溶液于4 ℃后固定2 h,再经梯度丙酮脱水,接着采用环氧树脂812 包埋,Leica EM UC7 超薄切片机切片,最后用醋酸铀和硝酸铅双染色,日立Hitachi-600透射电子显微镜下观察并拍照。
1.5 数据分析
试验数据采用SPSS 25.0软件进行单因素方差分析(One-way ANOVA)及多重比较(Duncan),结果用“平均值±标准差”表示,以P>0.05表示无显著差异,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 MC-LR对鲤鱼EPC细胞活力的影响
不同浓度MC-LR处理EPC细胞24 h后,细胞活力变化结果如表1所示。当MC-LR浓度为0.05 mg/L时,EPC 细胞活力与对照组相比无显著差异(P>0.05);浓度为0.5 mg/L 和5 mg/L 时EPC 细胞活力显著低于对照组(P<0.05),当MC-LR 浓度为50 mg/L 时,EPC 细胞活力下降至25.138%,与对照组相比差异极显著(P<0.01)。根据回归分析计算得出MC-LR对EPC细胞的IC50(24 h)为18 mg/L。
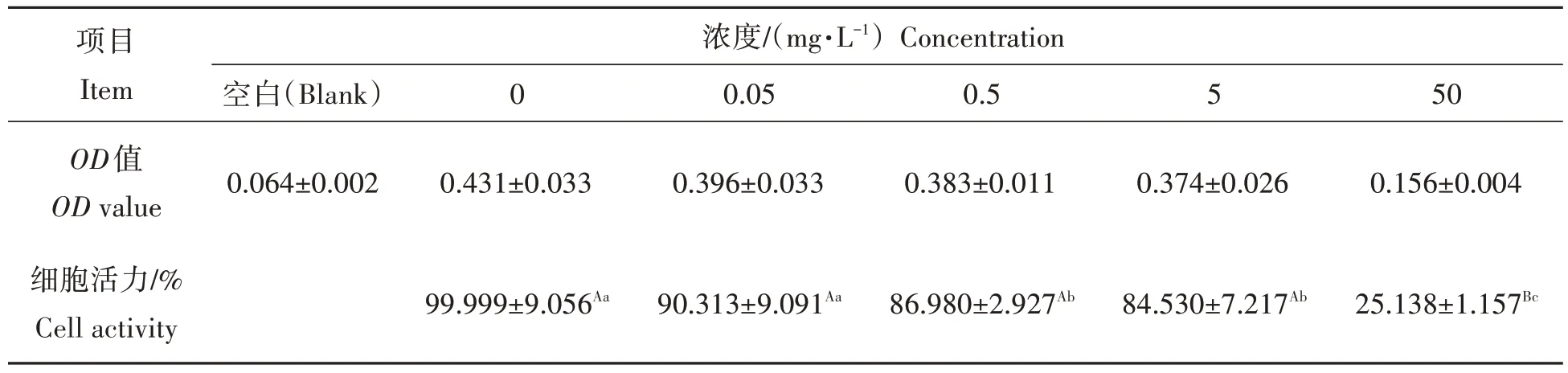
表1 MC-LR对EPC细胞活力的影响Tab.1 Effects of MC-LR on EPC cell activity
2.2 MC-LR对鲤鱼EPC细胞显微结构的影响
分别使用0,4.5,18 mg/L MC-LR 处理鲤鱼EPC细胞24 h。光学显微镜下观察发现,对照组细胞呈梭形或不规则的多边形,可以正常贴壁生长,细胞数量较多,形态比较整齐规则,细胞间距小,排列紧密(图1A);4.5 mg/L MC-LR 组细胞发生皱缩,并有少量细胞死亡(图1B);而在18 mg/L MC-LR 组中可观察到细胞数量减少,多数细胞发生皱缩,已有部分死亡细胞失去固有形态,由多边形或梭形变为圆形,并脱离培养瓶底部,飘浮在培养液中(图1C)。
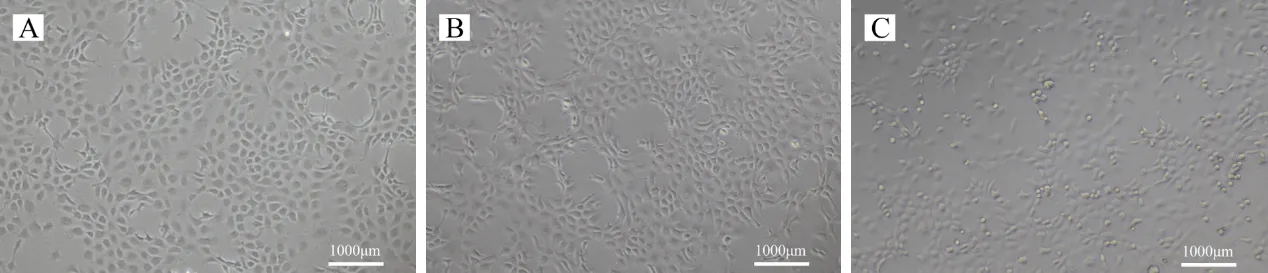
图1 MC-LR对EPC细胞显微结构的影响Fig.1 Effects of MC-LR on the microstructure of EPC cells
2.3 MC-LR对鲤鱼EPC细胞超微结构的影响
利用透射电镜观察发现,对照组细胞胞质致密;线粒体分布广泛,形态正常,呈卵圆形,线粒体内嵴结构清晰完整(图2A和B)。4.5 mg/L MC-LR 组细胞内线粒体明显肿胀,嵴排列紊乱、数目减少甚至溶解消失,呈现轻微空泡化。同时胞质内已出现少量脂滴(图2C 和D)。18 mg/L MC-LR 组细胞胞质可见圆形脂滴增大;线粒体同样发生肿胀,嵴溶解消失,空泡化现象严重(图2E和F)。

图2 MC-LR对EPC细胞超微结构的影响Fig.2 Effects of MC-LR on the ultrastructure of EPC cells
3 讨论与结论
3.1 MC-LR对鲤鱼EPC细胞活力的影响
已有研究指出MC-LR的分子量较大且分子结构复杂,通常较难通过质膜扩散进入细胞,而肝细胞和肾上皮细胞等细胞中特有的OATPs转运系统可将MC-LR主动转运进入细胞中[13]。因此,有关MC-LR对动物细胞活力的研究多集中在肝、肾细胞系中。在哺乳动物中,Chen等[14]曾提出0.2~12.8µmol/L MC-LR暴露24 h可导致人肝癌细胞活力受到抑制。在鱼类中亦有研究表明,较低浓度MC-LR(0.001~0.1 mg/L)暴露24 h 后草鱼肾细胞活力显著提高[8],对草鱼肝细胞活力则无显著影响[15]。近几年来,有关MC-LR 对哺乳动物上皮细胞活力的研究也有相关报道。Kozdeba等[11]研究表明,MC-LR(10µmol/L)暴露24 h后未对人角质形成细胞活力产生显著影响,但当暴露时间持续至48 h 或96 h 时,细胞活力显著下降。Zhou等[16]则提出12.5~50 µmol/L MC-LR 暴露24 h 可对大鼠小肠上皮细胞活力产生显著抑制作用。然而,MC-LR 对鱼类上皮细胞活力的影响却鲜少报道。在本研究中,0.05 mg/L MC-LR 暴露24 h 未对EPC 细胞活力产生显著影响,当MC-LR 浓度上升至0.5 mg/L 时,EPC 细胞活力被显著抑制。而后随着MC-LR浓度上升,EPC 细胞活力也随之下降,这一结果与MC-LR 在大鼠小肠上皮细胞[16]和人支气管上皮细胞[17]中的研究类似。在Lu等[18]的研究中同样发现,MC-LR(10~150 mg/L)处理24 h可对斑马鱼肝细胞活力产生抑制作用,且随着暴露浓度上升,细胞活力逐渐降低。这表明MC-LR 可对多种细胞系的活性产生抑制作用,且均存在一定的剂量-效应关系。
在本研究中,MC-LR 对EPC 细胞的IC50(24 h)较低,仅为18 mg/L。而在Liu 等[19]的研究中则表明MC-LR 对小鼠卵巢颗粒细胞的IC50为34 mg/L,MC-LR 对斑马鱼肝细胞的半数最大效应浓度EC50(24 h)高达80.123 mg/L[18]。不同类型的细胞摄取MC-LR 的能力不同,这可能是导致MC-LR 对不同细胞的IC50或EC50存在差异的原因[5]。除此之外,细胞对MC-LR 的敏感程度还可能受到细胞培养条件及培养方式等因素的影响。因此,今后深入研究MC-LR 对鱼类细胞的影响时,需从细胞类型、细胞培养方式或条件等方面进行综合分析。
3.2 MC-LR对鲤鱼EPC细胞显微结构的影响
利用光学显微镜观察EPC 细胞发现,对照组EPC 细胞贴壁生长,形状较为规则整齐;4.5 mg/L MCLR组细胞形态发生皱缩并观察到少量细胞死亡;而18 mg/L MC-LR组中可观察到部分细胞死亡,细胞形态变圆皱缩,漂浮在培养液中。这一结果与之前对其它细胞的研究比较相似,如马军国[20]将MC-LR(0.5~50µmol/L)暴露于肝癌细胞24~72 h后发现,随着MC-LR 浓度升高及暴露时间延长,细胞形态由多边形或梭形变为圆形,细胞贴壁能力减弱并悬浮在培养基中。亦有研究表明,MC-LR(12.5、25µmol/L)暴露72 h可导致小鼠结肠癌细胞形态变圆,贴壁能力减弱[21]。以上研究表明,MC-LR可对细胞形态结构产生不利影响,今后亦可通过体内试验进一步探究MC-LR 的细胞毒性效应。但有研究发现,人胚肾细胞和中国仓鼠卵巢细胞经MC-LR(1 或5µmol/L)暴露30 min 后其显微结构未产生明显变化。当这两种细胞经OATPs过表达处理后,MC-LR暴露即可导致这两种细胞形态发生皱缩,并脱离培养板底部[22]。这表明MC-LR对细胞显微结构的影响与细胞中OATPs含量同样存在联系。
3.3 MC-LR对鲤鱼EPC细胞超微结构的影响
利用透射电子显微镜观察EPC 细胞发现,对照组EPC 细胞胞内线粒体结构清楚,嵴排列整齐。而MC-LR 处理后的细胞胞内线粒体肿胀,嵴结构模糊,内部发生降解,空泡化严重。这一结果与其它研究类似,如Zhao 等[23]研究表明,鲫鱼经注射MC-LR 3~48 h 后,低剂量组(20µg/kg)鱼体肝脏细胞线粒体内明显空泡化,而高剂量组(200µg/kg)则表现为线粒体肿胀,线粒体基质和嵴浓缩。Li 等[24]则提出:MCLR(200µg/kg)注射鳙鱼24 h后可导致鱼体肝脏细胞线粒体嵴扩张,当浓度上升至500µg/kg时则发生线粒体嵴和基质的溶解消失。在哺乳动物中同样发现,饮用水中添加MC-LR(0.005、0.03 mg/L)3个月后小鼠肝脏细胞内线粒体出现肿胀变形、内部结构丧失,外膜破裂等现象[25]。线粒体是机体调节细胞信号通路和功能的重要细胞器,细胞分化、细胞氧化还原、蛋白质及脂类合成等生理过程都与线粒体有关[26]。同时,线粒体代谢在MC-LR 介导ROS 生成而导致细胞损伤的毒性作用机制中发挥了重要作用[27]。这些研究结果均表明线粒体是MC-LR 发挥毒性作用的重要靶标,今后还需围绕线粒体进一步探讨MC-LR对EPC细胞的毒性作用机制。
本研究中,随着MC-LR 浓度的上升,EPC 细胞内脂滴的出现也逐渐增加。在其它研究中也观察到了类似现象,如Li 等[28]发现当太湖中MCs 的爆发时,鲢鱼肝脏中MCs 可达6.84µg/g,且其肝脏中的脂滴累积明显。亦有学者发现鲢鱼或罗非鱼经注射(100µg/kg)MCs 48 h 后,其肝细胞中也可观察到大量脂滴[29]。脂滴的形成与机体脂类合成与分解、细胞膜的形成以及多种信号传导等过程密切相关[30]。脂滴还可作为细胞储存脂质的场所,当细胞内营养物质不足时,机体可利用脂滴分解获得的脂肪酸为线粒体氧化过程供能[31]。MC-LR暴露后细胞内脂滴的出现也预示了其可能对鱼体细胞内脂肪的合成代谢产生了一定影响。
MC-LR 暴露可对鲤鱼EPC 细胞活力产生显著抑制作用,并且存在剂量-效应关系,此外,MC-LR 还可导致EPC 细胞形态皱缩、线粒体空泡化、脂滴的产生以及细胞死亡。本研究展示MC-LR 可能通过诱导EPC细胞线粒体损伤等机制发挥其细胞毒性效应,但具体的作用机制还需进一步探讨。

