AKR1C3在评估直肠癌放化疗早期疗效的应用价值
崔 磊 徐晓南 曾 星 孙俊旗 高双全 苗淑红
1.广东省粤北人民医院放射治疗科,广东韶关 512026;2.广东省粤北人民医院影像诊断科,广东韶关 512026;3.广东省粤北人民医院病理科,广东韶关 512026;4.广东省粤北人民医院产前诊断中心,广东韶关 512026
近年来随着人们生活方式的改变,直肠癌发病率逐年升高。临床上根治性切除手术一般用于未发生转移的直肠癌患者,但普遍预后效果较差,5年内生存率较低[1]。由于直肠癌早期体征不明显,患者确诊时多为中晚期,因此如何提高对患者的早期诊断尤为重要。如今,放疗技术、细胞毒性药物可联合作用于不适进行手术的患者,且与手术效果相似。但有临床研究表明,放化疗疾病复发率及病情进展率可达50%[2]。而放化疗失败原因一般与直肠癌瘤体内存在放射抵抗细胞有关,而此类细胞可能与醛固酮类还原酶家族1成员C3(AKR1C3)表达水平有关,AKR1C3表达低可能增加患者的放射敏感性[3]。本研究对进行放化疗的直肠癌患者病理标本进行检测,探究AKR1C3 与放化疗早期效果的关系,为直肠癌靶向治疗提供依据,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2013年1月~2020年1月于粤北人民医院进行放化疗的60例直肠癌患者的临床资料,其中男41例,女19例。本研究经医院医学伦理会批准通过。
纳入标准:①患者年龄>18岁;②患者均经组织病理学及《中国结直肠癌诊疗规范(2017年版)》[4]诊断为直肠癌;③患者卡氏评分(Karnofsky,KPS)≥70分;④患者CT、MRI 检测为晚期局部直肠癌,病灶可检测。
排除标准:①患者单独进行放疗或化疗;②患者病灶出现远处明显转移。
1.2 放化疗方案
1.2.1 治疗方案 直肠癌靶区勾画参考Roels 等[5]及Valentini 等[6]推荐的直肠癌靶区勾画指南,使用6MVX线进行同步推量调强放疗。放疗剂量控制在PGTV 50 Gy/2 Gy/25次,PCTV 45 Gy/1.8 Gy/25次,每周5次。PGTV剂量控制在95%~105%等剂量线范围内,PCTV范围控制在93%~107%。放疗过程按照患者耐受情况及膀胱、尿道等剂量曲线进行调整,患者放疗结束21 d后进行化疗治疗。化疗方法FOLFOX6 方案或卡培他滨方案,FOLFOX6 方案:选择注射用奥沙利铂(浙江海正药业股份有限公司,国药准字H20093811,规格:50 mg,生产批号18082247)85 mg/m2进行2 h 静脉滴注;使用注射用亚叶酸钙(江苏恒瑞医药股份有限公司,国药准字H32022390,规格:25 mg,生产批号18082547)400 mg/m2进行2 h 静脉滴注;使用氟尿嘧啶(武汉武药制药有限公司,国药准字H42022258,生产批号18092147)400 mg/m2进行46~48 h 静脉滴注,总量控制在2400 mg/m2,共2 周期;卡培他滨方案:卡培他滨片(上海罗氏制药有限公司,国药准字H20073024,规格:500 mg,生产批号19032448)850 mg/m2,化疗时密切关注患者肝、肾、血常规情况,及时调整药物剂量。放疗结束后6 周评估及手术治疗,取患者治疗前内镜病理标本进行研究。
1.2.2 疗效评估 疗效分为4个标准,分别为完全缓解(CR):病灶完全消失;部分缓解(PR):病灶基线长径总长度缩小超过30%;进展(PD):患者出现新病灶或病灶基线长径总长度增加超过20%;稳定(SD):患者病灶基线长径总长度缩小值不满足PR 或增加值不满足PD[1]。
1.2.3 放射抵抗与放射敏感 患者放化疗后6 周进行复查,若CT、MRI 复查结果显示为CR+PR 则为放化疗敏感,若为PD+SD 则为放化疗抵抗。
1.3 免疫组化检测
1.3.1 免疫组化检测方法 将60 张组织病理切片于60℃恒温箱中进行20 min 烘烤,再脱蜡至水,使用PBS水洗2次,5 min/次;使用3%过氧化氢密闭5~10 min,使用蒸馏水洗3次。抗原修复使用0.01% mmol/L 柠檬酸钠缓冲液,于室温使用山羊血清密闭20 min,再滴加50 μL 一抗(Anti-AKR1C3 antibody,Abcam)置于37℃下过夜,Anti-AKR1C3 antibody 比例为1∶200。使用PBS 溶液清洗后,滴加IgG 抗体(赛默飞世尔)于37℃下孵育20 min,再滴加HRP 辣根过氧化物酶标记的链酶卵白素,室温下孵育20 min,使用塞维尔DAB 试剂显色,将切片脱水、封片,置于显微镜下镜检。
1.3.2 免疫组化检测标准 随机选取每张切片10个高倍(200×)视野进行计算,细胞呈棕色为检测阳性。计算阳性细胞占总细胞数的百分比,将10个视野进行平均计算,百分比范围为0%~100%。0%~25%表示为+;>25%~50%为++;>50%~75%为+++;>75%~100%为++++。患者的组织标本肿瘤分化程度由专家进行判断。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示;计数资料采用率表示,组间比较采用χ2检验;等级资料采用秩和检验,采用Logistic 进行多因素回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料
本研究中患者均进行调强放疗,其中放化疗抵抗组共40例,放化疗敏感组共20例。
2.2 AKR1C3 病理学检测结果
免疫组化检测结果显示,放化疗抵抗组患者的AKR1C3表达程度高于放化疗敏感组,差异有统计学意义(P<0.05)(图1、表1)。
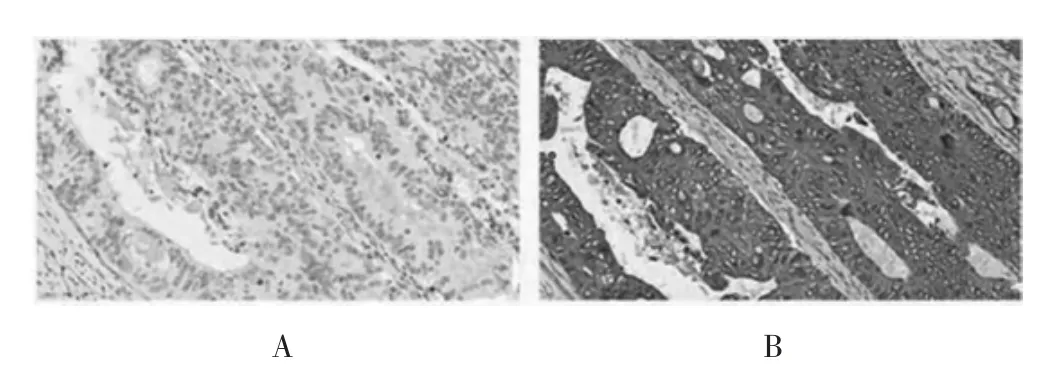
图1 高倍镜下AKR1C3 免疫组化结果(DAB 染色,200×)
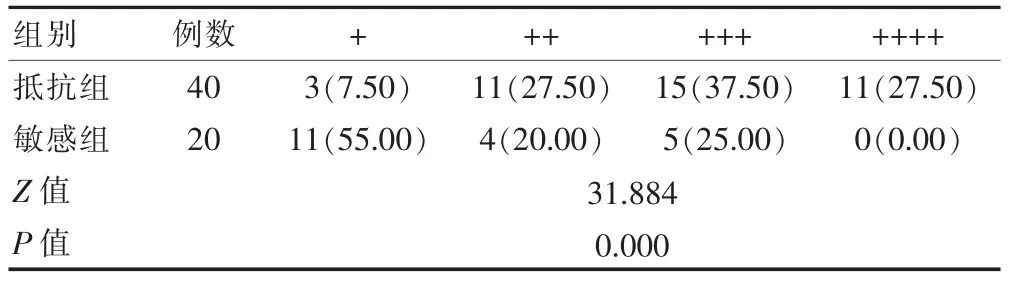
表1 两组患者AKR1C3表达强度的比较[n(%)]
2.3 放化疗抵抗相关影响因素的单因素分析
不同性别、分化程度、病变长度、AKR1C3表达患者的放化疗抵抗发生率比较,差异有统计学意义(P<0.05);不同年龄患者的放化疗抵抗发生率比较,差异无统计学意义(P>0.05)(表2)。
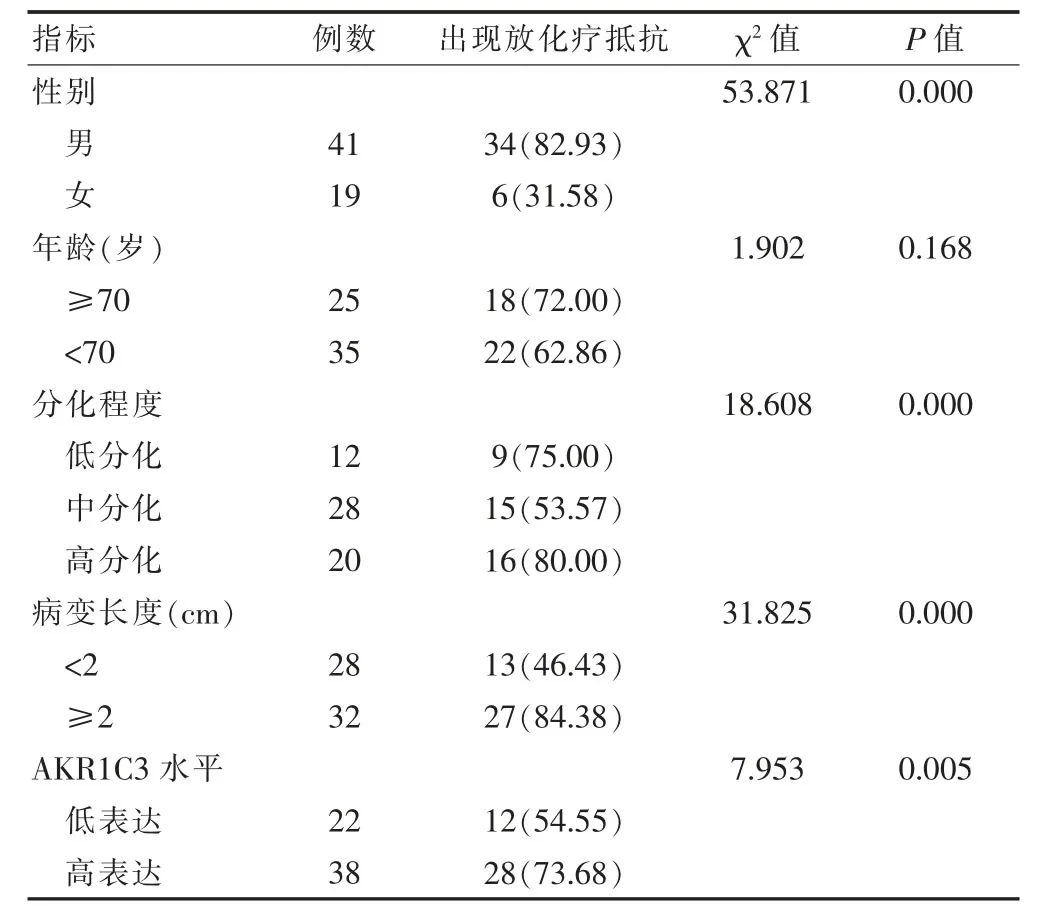
表2 放化疗抵抗相关影响因素的单因素分析[n(%)]
2.4 放化疗抵抗相关影响因素的多因素回归分析
将性别、分化程度、病变长度、AKR1C3表达作为自变量,放化疗抵抗作为因变量纳入Logistic回归模型分析,结果显示,AKR1C3 高表达是影响直肠癌患者放化疗的危险因素(P<0.05)(表3)。

表3 放化疗抵抗相关影响因素的Logistic回归分析
3 讨论
直肠癌涉及多种癌基因活化及抑癌基因失活,发病机制较复杂,临床治疗手段虽然已有明显进步,但无法对其发生、发展、转移等进行阐明,导致患者预后效果较差[7]。有研究表明,AKR1C3表达水平与恶性肿瘤发生、发展有关,包括前列腺癌、胃癌、肾癌、消化道肿瘤、乳腺癌等[8]。AKR1C3在人体内存在4种亚型,广泛存在于原核生物及真核生物中,主要功能为催化雌激素、雄激素、外源物质代谢等。AKR1C3表达水平多通过免疫组化方式进行检测,其表达水平在肿瘤组织中出现大量上升[9]。但其在直肠癌方面的相关研究报道罕见。
AKR 家族成员均与细胞代谢、肿瘤生成及发展有一定关系,且不同成员对肿瘤的作用机制不同。AKR1C3主要存在于尿路上皮细胞及肾小管上皮细胞,其异常表达通常与癌症细胞的发展有一定关系[10-11]。本研究选取60例放化疗直肠癌患者病理切片进行研究,显示放化疗抵抗组有40例,放化疗敏感组有20例。免疫组化染色结果表示,AKR1C3在放化疗抵抗组患者中的表达程度高于放化疗敏感组患者,表明AKR1C3 可能与直肠癌患者放化疗效果有一定关系[12]。甄明慧等[13]指出,AKR1C3在癌组织表达水平较非癌组织更高。田原僮等[14]表明,AKR1C3在结肠中不同部位表达方式出现一定差异,其中组织较深位置较组织较浅表达水平更低。同时,在尿路上皮细胞及膀胱中同样存在这一现象。这可能是因为浅层上皮细胞可保护组织不受外界因素影响,如膀胱不受尿液影响等[15]。AKR1C3 水平可作为上皮细胞屏障的一部分,与其他细胞共同抵御外界有害化学物质,但其与直肠癌的关系还需进一步研究。另李继华等[16]研究指出,AKR1C3在乳腺癌、胃癌、小细胞肺癌等组织中出现高分化低表达的情况,因此AKR1C3表达水平可能与不同器官不同发展阶段有关,而AKR1C3在直肠癌患者中表达仍不明确。
同时,方亚妮等[17]研究表示,AKR1C3表达增加可能会导致顺铂的耐药性,从而影响患者化疗效果。因此本研究对放射抵抗组患者的性别、年龄、肿瘤分化程度、病变长度、AKR1C3表达量进行分析,结果显示,不同性别、分化程度、病变长度、AKR1C3表达患者的放化疗抵抗发生率比较,差异有统计学意义(P<0.05);多因素回归分析显示,AKR1C3 高表达水平是影响直肠癌患者放化疗抵抗、放化疗早期疗效的独立危险因素(P<0.05)。提示AKR1C3 可作为直肠癌放化疗敏感性的检测指标,直肠癌进展越严重,AKR1C3表达水平越高[18]。此外,临床研究显示,AKR1C3表达水平与患者预后相关[19]。AKR1C3 存在于性激素器官中,可代谢孕酮、雄性激素、雌性激素等多种类固醇激素,从而影响肿瘤内激素水平[20]。与乳腺癌等癌症不同,直肠癌不是一种与激素相关的癌症,但部分研究仍指出直肠癌与其他激素相关的癌症一样,受到激素影响[21-22]。即直肠癌发生时,AKR1C3表达水平会出现改变,导致激素调节机制紊乱,加重病情。本研究结果可为临床治疗直肠癌患者提供一定理论基础,为其治疗及预后提供新思路,但本研究样本量较小,AKR1C3表达水平与直肠癌患者生存率的关系需扩大样本量进一步验证。
综上所述,AKR1C3表达强度与直肠癌患者放化疗早期疗效密切相关,可通过AKR1C3 免疫组化结果对患者放化疗疗效进行检测,临床上可通过研发AKR1C3 抑制剂进行抗肿瘤治疗。

