左卡尼汀联合促红细胞生成素及蔗糖铁治疗尿毒症行血液透析伴有肾性贫血的效果
郭冬慈 张宝桐
辽宁省辽阳市中心医院血液透析室,辽宁辽阳 111000
当前对尿毒症行血液透析伴有肾性贫血患者的治疗,通常采用促红细胞生成素(erythropoietin,EPO)来促进红细胞的生成,弥补因自身机体EPO 分泌不足导致的血细胞比容(hematocrit,HCT)降低。因此,在肾性贫血患者的治疗中,治疗方式均是以促进红细胞生成、提升HCT 为主,从而改善患者病情,缓解症状。EPO是由肝脏、肾脏分泌的一种生理激素,其核心价值体现在促进红细胞的生成,因此也被用于治疗贫血疾病[1],使用EPO 能够增加患者红细胞的生理水平指标提升HCT,从而改善缺血症状。
左卡尼汀在降低EPO 抵抗、改善红细胞寿命等有着重要临床意义,因此临床上常用于纠正肾性贫血以及蛋白质的代谢平衡,改善患者营养状况[2-3]。基于此,本研究选取辽阳市中心医院收治的尿毒症行血液透析伴有肾性贫血患者实施左卡尼汀、EPO及蔗糖铁联合用药的治疗方式,同时与未使用左卡尼汀的患者进行对照分析,探究临床治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2018年4月~2019年6月辽阳市中心医院收治的84例尿毒症行血液透析伴有肾性贫血患者作为研究对象,按照随机数字表法将其分为常规组(42例)和观察组(42例)。常规组中,男23例,女19例;年龄32~70岁,平均(51.33±1.45)岁;尿毒症病程1~12年,平均(6.54±1.12)年;合并患有糖尿病肾病22例,肾小球肾炎14例,高血压肾病5例,其他肾病1例;观察组中,男22例,女20例;年龄33~70岁,平均(52.09±1.29)岁;尿毒症病程1.5~11年,平均(6.74±1.22)年;合并患有糖尿病肾病20例,肾小球肾炎13例,高血压肾病6例,其他肾病3例。两组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。入选患者、家属对本次研究目的、治疗措施均知情,并签署调研意愿书。另外,本研究经医院医学伦理委员会审核批准。
诊断标准:根据2006年NKF-DOQI 规定的慢性肾脏病诊断标准[4]以及《内科学》[5]中贫血的诊断标准:男性血红蛋白(hemoglobin,Hb)<135 g/L,女性Hb<120 g/L。
纳入标准:均伴有不同程度的慢性肾脏疾病;维持性血液透析治疗≥3个月。
排除标准:伴有顽固型高血压、心脏病患者;非慢性肾脏病所致的贫血;伴有血液系统疾病或恶性肿瘤患者;伴有铁、叶酸、维生素B12缺乏者。
1.2 方法
常规组患者接受EPO 联合蔗糖铁(山西普德药业股份有限公司;国药准字H20046043;规格:5 mL/100 mg,生产批号:03170501)治疗,重组人类EPO 注射液(沈阳三生制药有限公司;国药准字S20010001;规格:3000 IU/支,生产批号:生产批号:20170132),每周使用量100~150 IU/kg,同时在血液透析完成以后回血阶段,添加使用蔗糖铁100 mg,2 周1次,另实施血压控制药物、抗感染、抗炎药物的给药,连续用药6周。
观察组患者在EPO 联合蔗糖铁治疗的基础上给予注射用左卡尼汀(瑞阳制药有限公司;国药准字H20041372;规格:1.0 g,生产批号:10100902),其中基础治疗措施、抗感染治疗措施、EPO、蔗糖铁等药物的选择与使用剂量、使用方式均相同,在左卡尼汀药物的选择上选择为注射用左卡尼汀,将1.0 g 左卡尼汀药物与20 mL 氯化钠注射液混合,行静脉注射完给药,每周3次,连续用药6周。
1.3 观察指标及评价标准
治疗效果分为显效、有效、无效,具体如下。显效:Hb 升高>10%,HCT 升高>30 g/L,患者贫血症显著缓解;有效:Hb 升高>5%~10%,HCT 升高>15~30 g/L,患者贫血症有所改善;无效:Hb、HCT 指标无明显改善,或存在恶化趋势。总有效率(%)=(显效+有效)例数/总例数×100%。
Hb、HCT、铁蛋白(serum ferritin,SF)、转铁蛋白饱和度(transferrin saturation,TSAT)水平:治疗过程中分别于治疗前及治疗2、4、6周后检测患者的Hb、HCT、SF、TSAT水平,并对检测结果进行记录与处理。
治疗期间对两组患者EPO 的使用量进行详细记录并将所得数据处理后进行比较分析。
观察并记录两组患者在治疗期间出现的不良反应,主要包括:血压升高、心率失常、胃肠道反应。
1.4 统计学方法
采用SPSS 19.0 统计学软件进行数据分析,符合正态分布的计量资料用均数±标准差(±s)表示,两组间比较采用t检验,不符合正态分布者转换为正态分布后行统计学分析;计数资料采用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗总有效率的比较
常规组患者的治疗总有效率为85.71%,观察组患者的治疗总有效率为97.62%,观察组的临床治疗总有效率高于常规组,差异有统计学意义(P<0.05)(表1)。
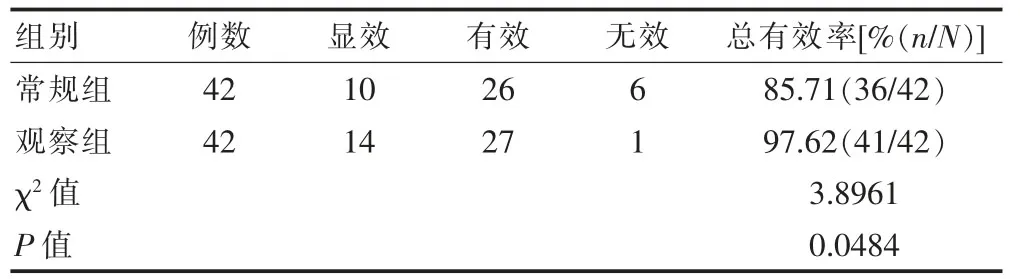
表1 两组患者治疗总有效率的比较(n)
2.2 两组患者治疗前后Hb、HCT水平的比较
治疗前,两组患者的Hb、HCT水平比较,差异无统计学意义(P>0.05);与治疗前比较,治疗2、4、6周后,两组患者的Hb、HCT水平逐渐升高,差异有统计学意义(P<0.05);观察组患者治疗2、4、6周后的Hb、HCT水平均高于常规组,差异有统计学意义(P<0.05)(表2)。
2.3 两组患者治疗前后SF、TSAT水平的比较
治疗前,两组患者的SF、TSAT水平比较,差异无统计学意义(P>0.05);与治疗前比较,治疗2、4、6周后,两组患者的SF、TSAT水平逐渐升高,差异均有统计学意义(P<0.05);且观察组患者治疗2、4、6周后的SF、TSAT水平均高于常规组,差异有统计学意义(P<0.05)(表3)。
表2 两组患者治疗前后Hb、HCT水平的比较(±s)

表2 两组患者治疗前后Hb、HCT水平的比较(±s)
与本组治疗前比较,*P<0.05
组别 Hb(g/L) HCT(%)常规组(n=42)治疗前治疗2周后治疗4周后治疗6周后观察组(n=42)治疗前治疗2周后治疗4周后治疗6周后71.35±10.38 74.15±13.22*82.35±14.65*88.25±15.55*24.11±2.45 26.15±3.44*26.88±5.12*28.65±5.35*t 治疗前组间比较值P 治疗前组间比较值t 治疗2周后组间比较值P 治疗2周后组间比较值t 治疗4周后组间比较值P 治疗4周后组间比较值t 治疗6周后组间比较值P 治疗6周后组间比较值71.54±10.55 80.35±13.65*95.66±15.85*105.65±16.54*0.0832 0.9339 2.1145 0.0375 3.8726 0.0002 4.9672 0.0000 24.15±2.61 27.98±3.65*29.52±5.22*33.35±5.58*0.0001 0.9999 2.3646 0.0204 2.3399 0.0217 3.9402 0.0002
表3 两组患者治疗前后SF、TSAT水平的比较(±s)

表3 两组患者治疗前后SF、TSAT水平的比较(±s)
与本组治疗前比较,*P<0.05
组别 SF(g/L) TSAT(%)常规组(n=42)治疗前治疗2周后治疗4周后治疗6周后观察组(n=42)治疗前治疗2周后治疗4周后治疗6周后101.34±7.51 126.24±12.22*140.34±15.21*156.53±10.21*17.62±8.96 22.24±12.97*24.24±13.72*28.11±11.21*t 治疗前组间比较值P 治疗前组间比较值t 治疗2周后组间比较值P 治疗2周后组间比较值t 治疗4周后组间比较值P 治疗4周后组间比较值t 治疗6周后组间比较值P 治疗6周后组间比较值98.65±6.82 152.62±11.24*174.58±4.67*195.39±12.76*1.6993 0.7339 10.2970 0.0000 13.9467 0.0000 15.4108 0.0000 18.32±9.55 28.61±12.12*30.58±11.28*36.44±10.33*0.3464 1.0439 2.2989 0.0199 2.3133 0.0289 3.5415 0.0012
2.4 两组患者治疗期间EPO 使用量的比较
治疗2周后,两组患者的EPO 使用量比较,差异无统计学意义(P>0.05);治疗4、6周后,两组患者的EPO 使用量均少于治疗2周后,且观察组患者治疗4、6周后的EPO 使用量均少于常规组,差异有统计学意义(P<0.05)(表4)。
2.5 两组患者不良反应总发生率的比较
观察组患者的不良反应总发生率低于常规组,差异有统计学意义(P<0.05)(表5)。
表4 两组患者治疗期间EPO 使用量的比较(U,±s)
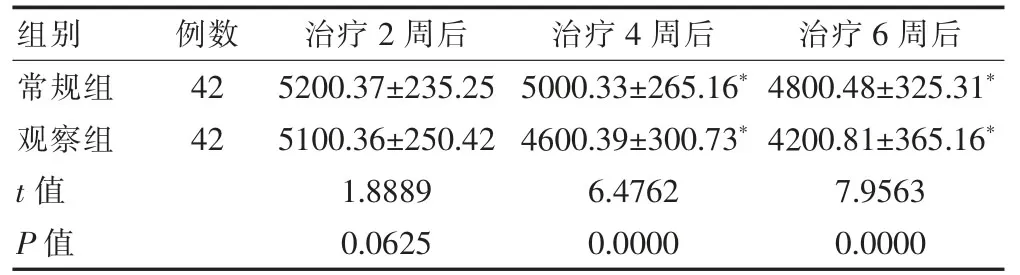
表4 两组患者治疗期间EPO 使用量的比较(U,±s)
与本组治疗2周后比较,*P<0.05
组别例数 治疗2周后 治疗4周后 治疗6周后常规组观察组t值P值42 42 5200.37±235.25 5100.36±250.42 1.8889 0.0625 5000.33±265.16*4600.39±300.73*6.4762 0.0000 4800.48±325.31*4200.81±365.16*7.9563 0.0000
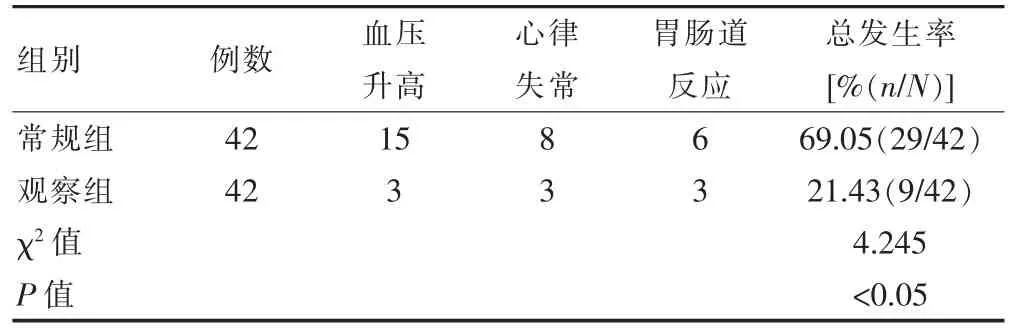
表5 两组患者不良反应总发生率的比较(n)
3 讨论
肾性贫血是指患者因多种影响因素使得肾脏EPO的合成率降低,亦或是尿毒症患者血液透析时,血液中的毒素物质对红细胞的生成与代谢产生干扰,从而导致肾功能障碍。该疾病的贫血程度通常与肾功能障碍程度有关[6]。尿毒症又称慢性肾衰竭,是由于患者肾脏功能出现功能障碍,诱发的一系列疾病表现,通常采用血液透析的方式帮助清除血液中的代谢废物[7]。尿毒症患者无论是血液透析还是腹膜透析,都会出现贫血,主要原因是肾单位损害导致肾脏生成和分泌EPO下降[8],缺乏造血原料以及营养不良导致贫血。
EPO是一种糖蛋白类激素,主要由肾脏合成。由于天然EPO 来源极为有限,目前临床使用基因工程技术生产的重组人促红细胞生成素(rhEPO)来治疗肾衰性贫血等疾病[9]。但是随着EPO 的使用越来越广泛,临床样本研究显示长期服用EPO 可能导致肾脏自身产生EPO 机能下降,且在使用某EPO 替代药物时会发生过敏反应[10]。因此,临床治疗肾性贫血等方面疾病,多采用其他补血药物或者药物联合应用的方式。蔗糖铁属于铁剂的一种,主要用来治疗贫血症状,为红细胞的合成提供铁元素与ATP,研究显示,蔗糖铁可纠正血液透析患者的功能性缺铁,增加铁储备,提高EPO 肾性贫血的治疗效果[11]。维持性血液透析患者通常伴有肉碱缺少,而患者通过饮食所获得的肉碱含量下降、其肾脏、肝脏等难以合成,进一步导致肉碱缺乏症,出现乏力、食欲不振、肌肉痉挛、低血压等现象[12]。左卡尼汀作为肉碱,是一种广泛存在于原核和真核细胞中的小分子物质,该物质在生物体内的作用主要体现为将长链脂肪酸转运至线粒体内质网部位,增加红细胞韧性,改善红细胞寿命,整体提升血细胞比容[13];另外,左卡尼汀发挥着把长链脂肪酸转移到线粒体内质网加以β-氧化同时产出能量的作用,将线粒体内含有的不易发现的加以清理,故目前临床常用来应用于维持性血液透析患者,既可以补充血液透析中丢失的肉毒碱,又可以改善心脏功能[14]。左卡尼汀与EPO、蔗糖铁相联合用药治疗肾性贫血,在临床应用较为广泛,目前已取得较为满意的治疗效果[15-16],其主要原因是左卡尼汀可以使红细胞内长链酰基肉碱积累减慢,从而使红细胞膜脂质成分进行变化,红细胞渗透脆性、溶解性不断下降,最终得以增加红细胞寿命,而EPO 功能的发挥和左卡尼汀的作用休戚相关,因为左卡尼汀可以对骨髓红细胞进行刺激[17],从而提高EPO 受体的敏感性,使EPO 的功效得到充分发挥[18-19],而在用药方面,由于左卡尼汀和EPO 补给,EPO 用量也可进行适当减少。采用三联用药的模式,可使药物之间起到互相协同,辅助的作用,临床效果才会更好[20-21]。
本次研究中,在EPO 联合蔗糖铁治疗的基础上增加左卡尼汀后,观察组患者的治疗总有效率高于常规组,差异有统计学意义(P<0.05);治疗前,两组患者的Hb、HCT 比较,差异无统计学意义(P>0.05);治疗2、4、6周后,观察组患者的Hb、HCT 均低于常规组,差异有统计学意义(P<0.05);治疗前,两组患者的SF、TSAT 比较,差异无统计学意义(P>0.05);治疗2、4、6周后,观察组患者的SF、TSAT 高于常规组,差异有统计学意义(P<0.05);在治疗4 周前,两组患者EPO的使用量虽有下降,但差异无统计学意义(P>0.05);治疗4周后,两组患者EPO 的使用量均减少,且观察组患者使用量相较于常规组患者更少,差异有统计学意义(P<0.05);观察组患者的不良反应总发生率低于常规组,差异有统计学意义(P<0.05)。提示左卡尼汀联合重组人EPO 治疗肾性贫血,临床效果显著且不良反应发生率低。
综上所述,针对于尿毒症行血液透析伴有肾性贫血患者治疗的措施上,通过EPO 联合蔗糖铁治疗基础上增加使用左卡尼汀药物,可有效改善患者Hb 含量,同时提升了HCT,治疗效果显著。

