枸杞-黄精化学成分分析及颗粒制剂工艺的研究
王结鑫 丁 艳 王 倩 褚海清赵 雨 张立明,2,3*
1.宁夏医科大学药学院,宁夏 银川 750004;2.宁夏特色中医药现代化工程技术研究中心,宁夏 银川 750004;3.宁夏医科大学回医药现代化教育部重点实验室,宁夏 银川 750004
枸杞-黄精组方在古方中又称二精方、二精丸,来源于《奇效良方卷之二十一·诸虚门》中,具有补精气作用。枸杞具有滋补肝肾、益精明目的功效,黄精具有补精益气等作用,方中枸杞多糖、总黄酮,黄精多糖、总黄酮均具有抗氧化、调节糖代谢活性,对糖尿病具有一定的预防和治疗作用。本课题组前期研究表明枸杞-黄精配伍使用具有很好的降糖作用,且以枸杞-黄精1∶1比例配伍降糖效果最佳[1],故本实验拟通过以HPLC方法分析枸杞-黄精中多糖、黄酮类成分,确定枸杞-黄精中抗糖尿病生物活性的成分。以颗粒剂性状、成型率、溶化性、吸湿率为考察指标,对枸杞-黄精颗粒的制剂工艺进行多指标综合优化,为二精方进一步开发利用提供研究基础。
1.仪器与材料
1.1 实验仪器 高效液相色谱仪 (Agilent 1260);分析天平(梅特勒-托利多);DHG-9075A型电热鼓风干燥箱(上海一恒科学仪器有限公司);循环水式多用真空泵(郑州长城科工贸有限公司);电子计重秤(厦门佰伦斯电子科技有限公司);RE-2000A旋转蒸发器(上海亚荣生化仪器厂);粉碎机(屹立工贸有限公司);玻璃干燥器;HH-4水浴锅(上海力辰邦西科技有限公司)。
1.2 实验材料 枸杞(批号:070101,产地:宁夏,购自宁夏明德饮片厂);黄精(批号:070101,产地:四川,石家庄市柏林药材加工厂);标准品:D-葡萄糖(中国食品药品检定研究院,批号:110833-201506);D-甘露糖(中国食品药品检定研究院,批号:140651-201504);芦丁(中国食品药品检定研究院,批号:100080-200707);聚乙烯比咯烷酮K30(MYM生物科技有限公司);微晶纤维素(北京凤礼精求医药股份有限股份有限公司,批号:K792);硬脂酸镁(上海麦克林生物有限公司,批号:M813581);滑石粉(北京凤礼精求医药股份有限股份有限公司,批号:20180326);甘露醇(上海广诺化学科技有限公司,批号:20180810)。
1.3 实验试剂 乙醇(分析纯,天津市科密欧化学试剂有限公司,批号:20130128);三氯甲烷(分析纯,天津市大茂化学试剂厂,批号:20160709);正丁醇(分析纯,天津市科密欧化学试剂有限公司,批号:201340506);甲醇(分析纯,天津市科密欧化学试剂有限公司,批号:20151120);乙腈(色谱纯,美国 Fisher 公司);甲醇(色谱纯,美国 Fisher 公司);三氟乙酸(分析纯,上海中秦化学试剂有限公司,批号:20170915);1-苯基-3-甲基-5-吡唑啉酮(分析纯,天津市光复精细化工研究所,批号:20100729);娃哈哈水。
2 实验方法
2.1 化学成分分析
2.1.1 HPLC色谱条件 多糖类成分的色谱条件[2-5]:安捷伦XDB-C18(4.6 mm×250 mm,5 μm)色谱柱,磷酸盐缓冲液(pH 6.8 )(A):乙腈(B)=84:16等度洗脱;流速为1 mL·min-1,检测波长:250 nm,柱温为30 ℃,进样量为 10 μL。
黄酮类成分的色谱条件[6-9]:安捷伦XDB-C18(4.6 mm×250 mm,5 μm)色谱柱,流动相为乙腈∶水∶冰乙酸=5∶94.5∶0.5(A)和乙腈∶水∶冰乙酸=70∶29.5∶0.5(B);梯度洗脱条件:0~14 min:100%~86%(A);14~22 min:86%~84%(A);22~40 min:84%~70%(A);40~60 min:70%~100%(A);流速为1 mL·min-1,检测波长:254 nm,柱温为30 ℃,进样量为10 μL。
2.1.2 供试品溶液制备 将枸杞与黄精分别按照1∶1的比例混合,加入75%的乙醇,70 ℃回流提取1.5 h,过滤,回流提取2次,合并滤液,即得醇提取液[10]。将醇提液浓缩并醇沉(使醇含量达到80%左右),静置过夜,过滤,沉淀用80%乙醇润洗多次,干燥后得到粗多糖,将粗多糖加水溶解,加入氯仿-正丁醇(4∶1)混合溶液脱蛋白,剧烈振荡后3000 r/min 离心10 min,得上清液,在上清液中加入无水乙醇(使醇含量达80%左右),静置过夜后过滤,所得沉淀依次用 95%乙醇、无水乙醇、丙酮、乙醚洗涤,烘干得精制多糖[11]。取药物多糖10 mg,精密称定置试管中,加三氟乙酸2 mL,使溶解密封,于100 ℃ 烘箱中水解8 h,吹干,残渣加甲醇1 mL,使溶解,吹干,重复3次,加水 2 mL使溶解,即得药物多糖水解液。在水解液中加 1.2 mL的1-苯基-3-甲基-5-吡唑啉酮(PMP) 甲醇溶液,1 mL 0.3 mol·L-1的氢氧化钠溶液,混匀,置70 ℃ 水浴加热 30 min,取出,冷却至室温,加0.3 mol·L-1盐酸溶液调节pH至中性,混匀,用等体积三氯甲烷萃取3次,取水层,针筒式微孔滤膜过滤,滤液作为多糖的供试品溶液[3-5]。
将枸杞与黄精提取,石油醚脱脂,残渣加入80%乙醇,60 ℃超声两次,每次30 min,滤过,合并滤液,减压浓缩,浓缩液经HPD-600型大孔树脂,蒸馏水除去水溶性杂质后,50%乙醇洗脱,收集乙醇洗脱液,针筒式微孔滤膜过滤,滤液作为黄酮的供试品溶液[12-13]。
2.1.3 标准品溶液制备 精密称取葡萄糖、甘露糖分别置于试管中,分别加入5 mL 0.3 mol·L-1的NaOH溶液,振荡溶解,取溶解后的溶液100 μL,加入0.5 mol·L-1的PMP甲醇溶液50 μL,70 ℃水浴中反应30 min后冷却至室温,加0.3 mol·L-1的盐酸100 μL中和,混匀,用等体积三氯甲烷萃取3次,取水层,针筒式微孔滤膜过滤,滤液作为多糖类成分对照品溶液。
精密称取芦丁,置于10 mL容量瓶中,加乙醇溶解并定容至10 mL。色谱分析时,对照品溶液过针筒式微孔滤膜,续滤液即为黄酮类成分对照品溶液。
2.2 干膏粉的制备[14]将枸杞-黄精(1∶1)药材进行粉碎,过20目筛。将药粉回流提取3次,每次1 h,料液比均为1∶10,过滤,合并3次滤液,滤液减压浓缩至一定浓度,加入4%微晶纤维素(MCC)混匀,置于烘箱中烘干后进行粉碎,过5号筛,得干膏粉。
2.3 制剂工艺参数考察 采用湿法制粒法。在湿法制粒中,填充剂和黏合剂对颗粒质量有较大影响,故以制粒情况(捏之成团,触之即散)、成型率、吸湿率、溶化性为参考指标,选择辅料,对制粒工艺进行考察。
2.3.1 填充剂 将微晶纤维素作为填充剂,以制粒情况、成型率、吸湿率和溶化性为指标筛选干膏粉与微晶纤维素最佳比例。
2.3.2 润湿剂的选择 本实验分别以纯化水、乙醇水溶液(70%)、3% PVP K30 醇溶液(70% ) 为润湿剂制粒,以制粒情况和颗粒成型率为指标筛选润湿剂。
2.3.3 润湿剂中乙醇浓度的考察 本实验按干膏粉和辅料的量加入40%的不同浓度乙醇(60%、70%、80%)配置的3%PVP K30 醇溶液,揉捏后快速过筛制粒,将湿颗粒于60℃干燥后整粒。以制粒情况、颗粒成型率为评价指标。
2.3.4 润湿剂用量的考察 按药粉与微晶纤维素2∶1称取3份混合药粉,按总量10%、20%、30%的量添加润湿剂,揉捏后快速过筛制粒,所得湿颗粒于60℃烘干后整粒。以制粒情况、颗粒成型率为评价指标。
2.4 颗粒处方优化 根据上述实验制粒情况,发现在制粒过程中,软材略黏筛,影响颗粒的成型率;枸杞与黄精中含有大量多糖类成分,且多糖类成分易吸湿。因此,对颗粒方进行优化,添加抗黏性与抗吸湿性辅料,从而提高颗粒成型率,改善颗粒稳定性。
2.4.1 抗黏性辅料筛选[15]颗粒的黏性较强,故需加入抗黏性辅料以改善其黏性,从而提高颗粒质量。在处方工艺初步筛选的基础上,固定微晶纤维素用量,选择滑石粉、硬脂酸镁为抗黏性辅料,设计正交实验表;以成型率、吸湿率、溶化性为指标,筛选抗黏性辅料。
取适量干膏粉,按照表1的设计方案,将原料与辅料混合均匀制备颗粒,分别测定颗粒成型率、吸湿率、溶化性,计算综合评分。
综合评分=(最小吸湿率值/吸湿率值) ×50 + (成型率值/最大成型率值) ×50。

表1 抗黏性辅料正交实验设计因素水平
2.4.2 抗吸湿性辅料的筛选[16-17]颗粒的吸湿性较强,故需加入抗吸湿性辅料以改善其吸湿性,从而提高颗粒质量。在处方工艺初步筛选的基础上,固定微晶纤维素用量,选择甘露醇、硫酸钙为抗吸湿性辅料,以成型率、吸湿率、溶化性为指标,设计正交实验,具体见表2,筛选抗吸湿性辅料。
取适量干膏粉,按照下方表2的设计方案,将原料与辅料混合均匀制备颗粒,分别测定颗粒成型率、吸湿率、溶化性,计算综合评分。
综合评分=(最小吸湿率值/吸湿率值) ×50 + (成型率值/最大成型率值) ×50。

表2 抗吸湿性辅料正交实验设计因素水平
2.5 检查 照《中国药典(2015版,第四部)》中有关颗粒剂质量评价规定,对所得枸杞-黄精颗粒进行水分、粒度、装量差异、溶化性进行检查[18]。
3 实验结果
3.1 化学成分分析
3.1.1 枸杞-黄精中多糖类化学成分分析 根据“2.1.2”项下“供试品溶液制备”制备枸杞-黄精的多糖类成分供试品溶液,进行HPLC检测,以“2.1.3”项下“标准品溶液制备”葡萄糖、甘露糖的标准品溶液,进行HPLC检测,按照“2.1.1”项下的色谱条件进行HPLC检测。认为供试品溶液中具有相同保留时间的色谱峰为共有峰。精密吸取供试品溶液10 μL,注入HPLC色谱仪,记录HPLC色谱图,生成枸杞-黄精多糖、葡萄糖、甘露糖图谱,S1-S3分别代表枸杞-黄精(1∶1)多糖、葡萄糖、甘露糖。比较供试品多糖类成分与标准品蒲萄萄、甘露糖图谱,发现多糖类成分中含有葡萄糖、甘露糖。如图1所示。
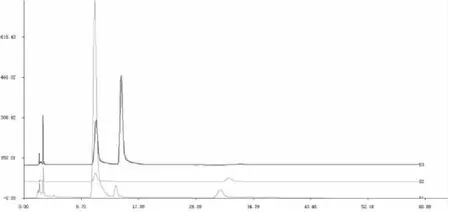
图1 枸杞-黄精多糖类成分、标准品葡萄糖、标准品甘露糖HPLC谱图
3.1.2 中黄酮类化学成分分析 根据“2.1.2”项下“供试品溶液制备”制备枸杞-黄精的黄酮类成分供试品溶液,进行HPLC检测,以“2.1.3”项下“标准品溶液制备”芦丁的标准品溶液,进行HPLC检测,按照“2.1.1”项下的色谱条件进行HPLC检测。认为供试品溶液中具有相同保留时间的色谱峰为共有峰。精密吸取供试品溶液10μL,注入HPLC色谱仪,记录HPLC色谱图,生成枸杞-黄精黄酮类成分、标准品芦丁图谱。比较供试品黄酮类成分及标准品芦丁谱图,可以确定供试品黄酮中含有芦丁。如图2所示。
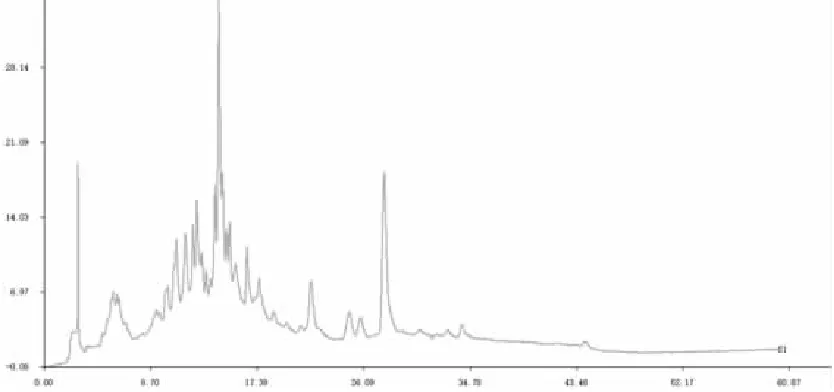
图2 枸杞-黄精黄酮类成分HPLC谱图

图3 标准品芦丁HPLC谱图
3.2 方法学考察
3.2.1 线性关系考察 以“2.1.3项下”的“标准品溶液制备”方法制备的标准品溶液,精密吸取标准品溶液,用溶解试剂稀释并在容量瓶中定容。葡萄糖标准品的浓度分别为0.17 mg/mL、0.84 mg/mL、1.67 mg/mL、2.51 mg/mL、3.34 mg/mL、4.18 mg/mL;甘露糖标准品的浓度分别为0.19 mg/mL、0.95 mg/mL、1.90 mg/mL、2.85 mg/mL、3.80 mg/mL、4.75 mg/mL;芦丁标准品的浓度为0.16 mg/mL、0.32 mg/mL、1.60 mg/mL、3.20 mg/mL、4.80 mg/mL、6.40 mg/mL、8.00 mg/mL。将各个浓度的标准品溶液分别进样。上述各溶液在选定的色谱条件下经HPLC测定后,绘制标准曲线。线性回归方程、R2及线性范围见表3,结果显示标准曲线线性相关系数在0.9996~1.0000 ,表明方法线性关系良好。

表3 各成分检测波长、线性方程、相关系数、线性范围结果
3.2.2 精密度实验 取枸杞-黄精多糖类成分、黄酮类成分供试品溶液分别连续进样6次,记录HPLC色谱图,结果见表4。葡萄糖、甘露糖、芦丁对应的色谱峰峰面积(A)的RSD在2.01%~2.72%,保留时间(T)RSD在0.48%~3.36%,符合特征图谱要求,表明仪器精密度良好。

表4 各成分精密度、稳定性、重复性实验测定结果
3.2.3 稳定性实验 取枸杞-黄精多糖类成分样品、黄酮类成分供试品溶液,于0、3、6、9、12、24 h分别进样,记录HPLC色谱图,结果见表4。葡萄糖、甘露糖、芦丁对应的色谱峰峰面积(A)的RSD在1.07%~2.95%,保留时间(T)RSD在0.04%~2.96%,符合特征图谱要求,表明供试品溶液在24 h内稳定。
3.2.4 重复性实验 取枸杞-黄精多糖类成分样品、黄酮类成分样品,分别平行制备多糖类成分供试品、黄酮类成分供试品溶液6份,分别进样,记录HPLC色谱图,结果见表4。葡萄糖、甘露糖、芦丁对应的色谱峰峰面积(A)的RSD在0.01%~3.06%,保留时间(T)RSD在0.0004%~0.98%,符合特征图谱要求,表明方法的重复性良好。
3.2.5 加样回收率实验 精密吸取已测定的供试品溶液1.0 mL,置于进样瓶中,精密吸取“2.1.1”项下标准品溶液1.0 mL,摇匀,平行制备6份,根据加入标准品的量与测得量计算加样回收率,结果见表4。加样回收率为93.07%~105.11%,RSD为0.009%~0.68%,说明该方法的准确度良好。
3.3 干膏粉与填充剂比例筛选结果 由表5可知,干膏粉与MCC比例为2∶1时成型率最高,故选取干膏粉与微晶纤维素最佳比例为2∶1。

表5 干膏粉与填充剂比例筛选结果
3.4 润湿剂筛选结果 由表6可知,干膏粉与MCC比例为2∶1时,润湿剂为3% PVP K30 醇溶液(70%) 成型率最高,故以3% PVP K30 醇溶液(70%)为润湿剂。
3.5 润湿剂中乙醇浓度筛选结果 由表7可知,干膏粉与MCC比例为2∶1时,润湿剂中乙醇浓度为70% 时成型率最高,故以3% PVP K30 醇溶液(70%)为润湿剂。

表6 润湿剂筛选结果

表7 润湿剂中乙醇浓度筛选结果
3.6 润湿剂用量筛选结果 由表8可知,当干膏粉与MCC比例为2∶1时,润湿剂为3% PVP K30 醇溶液(70%),用量为40% 时成型率最高,故以3% PVP K30 醇溶液(70%),用量为40% 为颗粒润湿剂。
3.7 抗黏性辅料正交实验结果 由表9、表10可知,各因素影响程度依次为 C > B > A,最优工艺为A1B3C2 ,即在原处方(干膏粉与微晶纤维素比例2∶1)基础上,滑石粉用量1%,硬脂酸镁用量0.75%,润湿剂乙醇浓度为70%。

表8 润湿剂用量筛选结果
3.8 抗吸湿性辅料筛选结果 由表11、表12可知,各因素影响程度依次为 C > B > A,最优工艺为A3B2C2 ,即在原处方(干膏粉与微晶纤维素比例2∶1,滑石粉用量1%,硬脂酸镁用量0.75%)基础上,甘露醇用量9%,硫酸钙用量6%,润湿剂乙醇浓度为70%。
3.9 检查项下结果 由表13可知,水分小于8%,装量差异在±5%内,粒度和溶化性均符合规定。

表9 抗黏性辅料L9(33)正交实验结果

表10 方差分析

表11 抗吸湿性辅料L9(33)正交实验结果

表12 方差分析

表13 水分、粒度、装量差异、溶化性检查结果
4 结论与讨论
枸杞是宁夏道地药材,最早将其作为药用部位记录在《名医别录》[19],其功效是滋补肝肾、益精明目。枸杞中具有多种成分如枸杞多糖、枸杞色素、黄酮类化合物、生物碱等,其中大量研究表明枸杞多糖利用价值相对较高[20]。黄精是运用历史悠久的药食同源药物[21],其具有补气养阴,健脾润肺的功效。本课题组在前期研究中发现,枸杞-黄精多糖提取物对Ⅱ型糖尿病具有降糖作用[1],因此在此次研究中测定了枸杞-黄精中多糖、黄酮类的成分,通过与标准品对比发现,活性成分有葡萄糖、甘露糖以及芦丁。但通过比较标准品与供试品溶液HPLC峰发现,仍有较多峰未确定其成分,后期还需继续对其成分进行深入分析。枸杞-黄精颗粒的制备工艺采用正交设计等方法,对湿法制粒工艺进行考察和优化,筛选出适合枸杞-黄精组方颗粒的制粒工艺,为制剂质量评价及有效期的确定提供可靠的依据。
中药颗粒制剂主要是在汤剂和糖浆剂的基础上发展的中药剂型,相对于传统汤剂来说,具有方便服用、便于携带、易于调配、剂量准确等优点;而相对于片剂来说,颗粒剂的溶解时间短、药物溶出迅速、患者吸收快、患者生物利用度高等优点。本研究采用湿法制粒,该方法在国内应用较早,是一种传统的制粒方法。笔者在大量文献的基础上对枸杞-黄精颗粒的最优成型工艺进行探索,得出其最佳制备工艺为:干膏粉与微晶纤维素比例为2∶1,滑石粉用量1%,硬脂酸镁用量0.75%,甘露醇用量9%,硫酸钙用量6%,润湿剂为3% PVP K30醇溶液(70%),用量为40%。通过对颗粒剂的有关检查,均符合规定,证明该制备工艺稳定可行。

