奥沙利铂联合氟尿嘧啶/亚叶酸钙方案经肝动脉灌注化疗治疗晚期肝细胞癌*
李 伟 张良杰 李冬冬 赵守松
蚌埠医学院第一附属医院感染科,安徽 蚌埠 233004
原发性肝细胞癌(hepatocellular carcinoma, HCC)在全世界范围内的恶性肿瘤发生率中高居第5位,严重威胁人类健康。我国的HCC亦是高发肿瘤之一,全球45%的因肝细胞癌死亡病例发生在我国[1]。以外科手术为主的综合治疗手段,很大程度上提高了HCC患者的生存率,延长了生存时间,但这依赖肝癌的早期发现和早期诊断。在我国,大部分HCC患者起病隐匿,早期诊断较为困难,确诊时多处于中晚期,晚期肝细胞癌约占全部肝癌患者的40%。晚期HCC患者常缺乏手术指征,目前临床上以奥沙利铂联合氟尿嘧啶/亚叶酸钙的FOLFOX方案为主要化疗手段。然而,FOLFOX方案经常规静脉灌注后,肿瘤部位较低的药物浓度限制了疗效,同时高不良反应发生率导致患者耐受性下降,为此对晚期HCC患者,我们利用肝动脉灌注化疗(hepatic arterial infusion chemotherapy, HAIC)实施FOLFOX方案以期提高其疗效并降低其不良反应发生率。本研究对比了蚌埠医学院第一附属医院半年来对晚期HCC患者行FOLFOX方案经肝动脉灌注化疗与经常规静脉化疗的治疗效果,现报告如下。
1 对象与方法
1.1 研究对象
40例患者均为蚌埠医学院第一附属医院感染科2018年1月至2018年6月住院患者,其中男23例,女17例,年龄在26~75岁之间(平均年龄46岁)。所有患者均经临床诊断为晚期肝细胞癌,肿瘤直径较大,患者一般情况较差,均无外科手术指征。部分患者合并动静脉瘘,不宜做栓塞治疗。
1.2 治疗方法
患者随机分为实验组及对照组两组,每组各20例,治疗前均签署知情同意书。对照组患者采用奥沙利铂、5-氟尿嘧啶/亚叶酸钙(FOLFOX)方案经静脉化疗,所有患者在完成1次常规静脉化疗后,24~72 h观察无特殊不适给予出院,出院前常规检查血常规、生化常规、B超及肿瘤相关指标。实验组于我院DSA导管室行肝动脉置管术,应用Seldinger方法行股动脉穿刺术,行腹腔干动脉或肝动脉造影后,将微导管尽可能超选择至肿瘤供血动脉,股动脉穿刺点外固定,返回病房。患者返病房后卧床,予以接动脉化疗泵,行肝动脉灌注化疗(HAIC)治疗。先动脉滴注奥沙利铂130 mg/m2,维持1.5 h(d1);后动脉滴注亚叶酸钙200 mg/m2,持续1.5 h(d1);随后接5-FU动脉滴注首次剂量400 mg/m2,团注(d1);5-FU首剂结束后接5-FU 2 400 mg/m2持续动脉滴注维持46 h。20例实验组患者每人至少完成1次的HAIC治疗,累积行36次HAIC治疗。
1.3 影像学检测肿瘤大小
所有患者治疗前后均作B超及肝动脉造影检查,测量肿瘤大小,对比治疗前后肿瘤大小变化。
1.4 评估疗效
评估患者治疗疗效(mRECIST1.1标准),统计肿瘤客观有效率(ORR)/疾病控制率(DCR)。客观有效率(ORR)=完全缓解率(CR)+部分缓解率(PR)+疾病稳定(SD);疾病控制率(DCR)=CR+PR。随访调查患者无进展生存时间(PFS)、总生存时间(OS)与累计1年生存率。
1.5 不良反应
治疗过程中观察患者的不良反应如发热、疼痛、恶心、呕吐、骨髓抑制、神经感觉等并记录。
1.6 统计学分析

2 结 果
2.1 患者基线特征
所有患者均经临床诊断为晚期肝癌,BCLC分期B期16例,C期24例,肝功能Child-A级者9例,Child-B级者31例,而行肝动脉灌注化疗治疗。所有入组患者基线指标见表1,两组患者在年龄、性别与疾病相关指数方面无统计学差异,具有临床可比性。
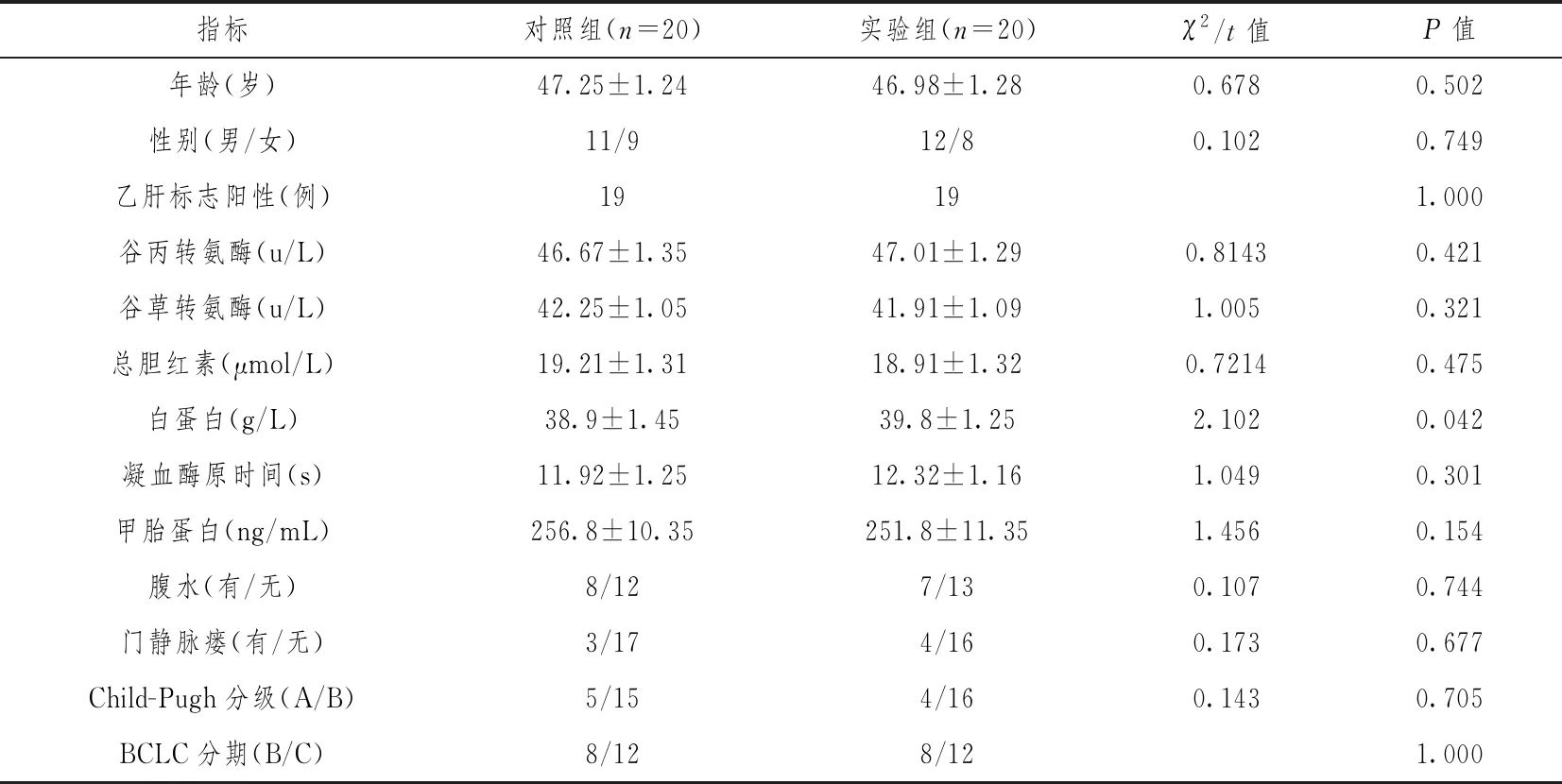
表1 患者基线特征
2.2 肿瘤缩小率
对照组患者影像学检测结果显示,20例患者中有8例肿瘤缩小率50%,有3例肿瘤缩小率25%,其余患者肝肿瘤均有不同程度缩小。实验组患者的影像学检测结果显示,20例患者中有10例肿瘤缩小率50%,有4例肿瘤缩小率25%,其余患者肝肿瘤均有不同程度缩小。1例合并门静脉癌栓患者治疗后门静脉癌栓消失。结果表明,与常规静脉灌注相比,FOLFOX方案经肝动脉灌注化疗后对肿瘤的抑制效果更明显。具体见表2。
2.3 化疗后患者临床疗效评价
对照组CR 10例,PR6例,SD 3例,PD 12例,ORR为 69%,DCR为53%;而实验组CR 12例,PR8例,SD 5例,PD 13例,ORR为 72%,DCR为60%。与对照组比较,实验组临床疗效显著提升(P<0.05)。见表3。

表2 患者肿瘤缩小率

表3 化疗后临床疗效评价
2.4 患者生存分析
对照组中位随访时间8.5个月(2.2~11.8个月),PFS为8.7个月(95%CI:6.3~10.3个月),OS为9.8个月(95%CI:8.3~10.1个月),累计1年生存率为60%;实验组中位随访时间为8.9个月(2.3~12.9个月),PFS为 9.5个月(95%CI:6.5~10.8个月), OS为10.9个月(95%CI:8.6~11.5个月),累计1年生存率为80%。实验组较对照组的生存时间显著延长(P<0.05)。见图1,2。
2.5 不良反应分析
对照组3~4度骨髓抑制发生率为15%(3/20),神经毒性发生率为25%(5/20),而实验组3~4度骨髓抑制发生率为5%(1/20),神经毒性发生率为10%(2/20),FOLFOX方案经肝动脉灌注化疗后可显著降低不良反应的发生率。
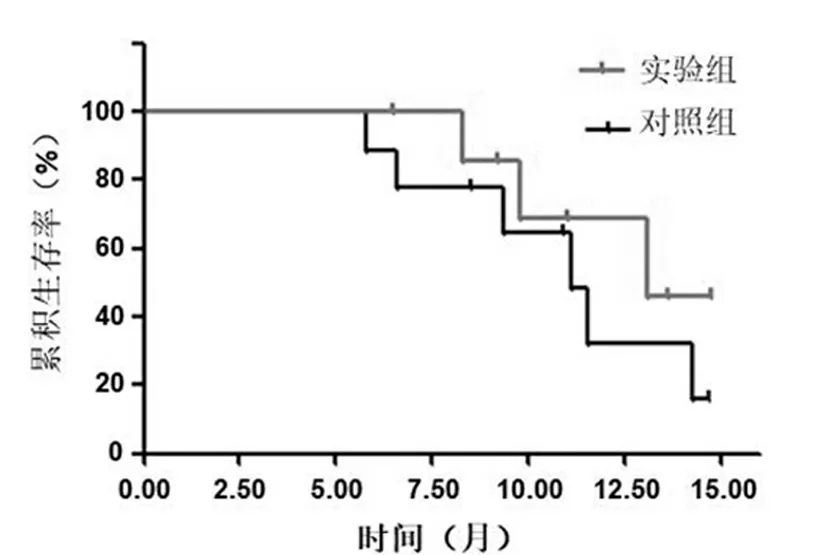
图1 患者无进展生存时间
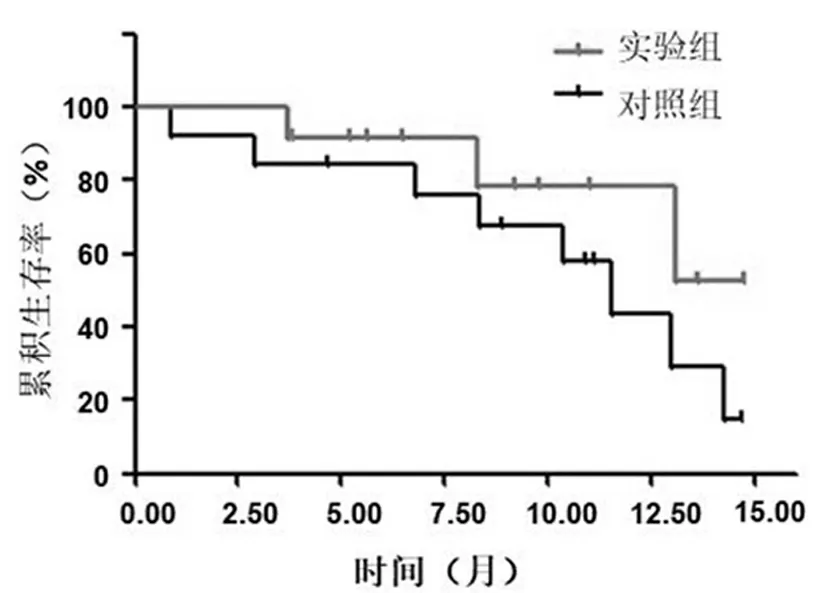
图2 患者总生存时间
3 讨 论
最新的癌症统计数据显示肝脏肿瘤已成为全球第五大常见肿瘤及第二大致死性肿瘤,每年新发病例超过78万,死亡人数超过74万例,其中半数以上的病例来自中国[2]。HCC是肝脏肿瘤的最主要类型,其起病隐匿,确诊时大多处于中晚期[3]。按照巴塞罗那分期标准,晚期肝细胞癌的定义为患者有肿瘤相关症状(体力状态评分ECOG 1~2分)、肝功能Child-Pugh分级A-B级,肿瘤侵润血管或远处转移。自然病程中,预期中位生存时间仅为6个月,1年生存率仅为25%。直至分子靶向药物索拉非尼的出现,情况出现了改变。中国指南推荐索拉非尼作为晚期肝癌的标准治疗手段[4]。
近年来,尽管新的靶向药物如舒尼替尼、布立尼布、厄洛替尼等纷纷进入临床研究,但三期临床试验结果显示没有一种新的靶向药物能够作为晚期肝癌的一线或二线治疗手段[5]。因此,有学者开始关注另一种系统治疗手段:细胞毒性药物,但患者对其不良反应耐受性差以及肝癌细胞对早期化疗药物相对不敏感导致其应用受到限制。近30年来,随着支持治疗包括中枢止呕药物及粒细胞集落刺激因子的应用,常见的化疗不良反应如呕吐、骨髓抑制等被有效控制,提高了患者肿瘤化疗的耐受性。更重要的是,新一代化疗药物如奥沙利铂的研发应用,大大提升了药物抗肿瘤效果。对于晚期肝癌患者,采用奥沙利铂联合5-氟尿嘧啶/亚叶酸钙(FOLFOX4)方案全身化疗较单药多柔比星化疗显著延长无疾病进展时间,提高了肿瘤反应率,提示FOLFOX4方案可能是一个安全有效的肝癌化疗方案[6]。然而,FOLFOX4全身化疗较单药多柔比星并未显著延长患者总生存时间(6.40个月∶4.97个月,P=0.070)。其可能的原因有以下两点:首先化疗药物经全身循环稀释,肿瘤部位药物浓度大大降低。其次高不良反应率导致耐受性下降,FOLFOX4全身化疗的3度及以上骨髓抑制发生率达55.7%,30%的患者因不良反应中断治疗。
HAIC可能是克服以上两个缺陷的最佳的解决途径,它通过血管介入方法将化疗药物经导管直接输送到肝动脉。它的优势在于直接将化疗药物注入肝癌的供血动脉,较静脉化疗肿瘤区域药物浓度和肿瘤客观反映率显著提高。一项日本的全国多中心大数据分析结果显示相比保守治疗,接受肝动脉灌注化疗的晚期肝癌患者生存时间显著延长(化疗∶保守治疗,14.0个月∶5.2个月,P<0.001)[7]。另外一项来自韩国的回顾性研究直接对比肝动脉灌注化疗和索拉非尼治疗门脉癌栓患者,结果研究显示肝动脉灌注化疗组的患者总生存时间显著优于接受索拉非尼的患者(7.1个月∶ 5.5个月,P=0.011)[8]。此外,有些研究也证实其对于老年晚期肝癌患者有生存获益[9],日本的肝癌治疗指南把肝动脉灌注化疗推荐为晚期肝癌的重要治疗手段之一,对于主干或一级分支癌栓的肝癌甚至作为首选方案[10]。当然相对于中期肝癌或单发肝癌切除术后辅助性介入治疗中,TACE较灌注化疗相比,可能有着更高的肿瘤控制率[11]。目前,肝动脉灌注化疗的化疗药物选择多以顺铂联合5-氟尿嘧啶为主。奥沙利铂作为第三代铂类,其化学机构的二氨环己烷替代顺铂的氨基,不仅破坏肿瘤细胞DNA效果更强,而且对骨髓、肝脏等不良反应较顺铂减轻。不同剂量奥沙利铂肝动脉化疗治疗HCC的I期临床试验,结果表明150 mg奥沙利铂肝动脉化疗是安全的[12]。也有研究表明TACE联合 FOLFOX4肝动脉灌注化疗治疗无远处转移的中晚期肝癌患者,其3~4度骨髓抑制不良反应仅6.6%,神经毒性发生率也仅11%(3度及以上0.86%)[13]。FOLFOX4方案对进展期肝门区胆管癌,尤其对胆管浸润型肝门区胆管癌也有着较高的肿瘤控制率、生存获益率及低毒性[14]。经皮植入药盒系统经肝动脉持续灌注化疗同样也能起到类似的临床效果[15]。
我们的研究发现实验组的晚期肝癌患者经过肝动脉灌注化疗后,肿瘤大小均有不同程度的缩小,与对照组相比其完全缓解率及部分缓解率、中位疾病无进展生存时间、中位总生存时间、累计 1年生存率等均有显著性提升,不良反应发生率显著降低。这提示FOLFOX方案经肝动脉灌注化疗具有良好的应用前景,有望对晚期肝细胞癌的治疗提供新的有效途径。当然,我们的临床病例相对较少,需要扩大样本量进行进一步的研究。

