miR-145/SMAD3轴在慢性阻塞性肺疾病中的作用和机制研究
谢圆媛,胡海峰,赵 莉,薛 鹏
0 引言
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种具有气流阻塞特征的慢性支气管炎和肺气肿,威胁着公众的健康和生活质量[1-4]。COPD通常是由于接触有害颗粒或气体引起的,吸烟是主要的危险因素之一[5-6]。慢性气道炎症和肺气肿是COPD的两种主要病理亚型,会引起免疫功能紊乱和肺组织破坏,然而,COPD的发病机制及其诊断和治疗的有效生物标记尚未阐明[7-8]。因此,探索独立的生物标志物并研究其致病机制有利于COPD的早期诊断和治疗。
研究证实,不同炎症因子指标水平能准确反映COPD患者的肺功能损伤程度、病情的发展程度,对疾病的诊断具有重要的指导意义[9]。COPD中炎症的发生会引起肺泡组织中ECM的紊乱导致肺组织重塑,从而加重COPD的发生。MicroRNAs(miRNAs)是一类20-24bp的内源性非编码RNA,通过靶向mRNA的3′非翻译区调节生理和病理功能。越来越多的研究表明,miRNA在COPD的发病机制中起着至关重要的作用。研究发现,miRNA-101-3p.1可以作为诊断COPD的独立生物标志物,通过激活EGFR/PI3K/Akt途径促进COPD的发生[10]。COPD的血浆和肺组织中miR-29b表达降低,并且与肺的功能变化显著相关[11]。miR-145-5p作为miR-145家族的一员,已被广泛证实与多种人类恶性肿瘤有关[12]。最近的一项研究表明,COPD患者肺组织中miR-145-5p的表达较低,miR-145-5p通过负调节KLF5抑制CSE诱导的HBEC凋亡和炎症[13]。与非吸烟者相比,COPD患者气道平滑肌细胞中miR-145的过表达可抑制促炎性细胞因子的释放[14]。
本实验通过研究miR-145在COPD炎症的发生、ECM的降解以及在P13K/Akt/mTOR通路中的作用,同时分析miR-145与SMAD3的靶向关系,以期为后续研究治疗COPD的方法提供研究基础。
1 材料与方法
1.1 主要试剂 RPMI 1640培养基、胎牛血清购自美国Gibco公司;通用反转录试剂盒、RIPA强蛋白裂解液、蛋白抑制剂PMSF、总RNA提取试剂盒购自北京索莱宝生物科技有限公司;实时荧光定量PCR染料Ultra SYBR Mixture购自康为世纪生物科技有限公司;Asvanced转染试剂购自ZATA LIFE公司(美国);IL-10 Rabbit mAb、EMMPRIN Rabbit mAb、SMAD3 Antibody购自Cell Signaling Technology公司;Anti-IL-6/IL-8/P13K/Akt/mTOR/MMP9/β-actin antibody购自Abcam公司;Goat anti-Mouse/Rabbit IgG(H+L)-HRP购自武汉三鹰生物技术有限公司;miR-145 inhibitor/mimics、NC mimics/inhibitor(浓度均为20 μM/μl)均送武汉金开瑞生物科技有限公司合成;pEGFP-N1-SMAD3质粒为前期构建,Cell Counting Kit-8、Human IL-6/8/10 ELISA Kit购自碧云天有限公司。
香烟烟雾提取物(CSE)的制备:按照Wu等[15]方法,将2支无滤嘴香烟的烟气溶于10 ml无血清的RPMI 1640培养基(每支香烟2 min),将pH值调节至7.4,并将获得的100%CSE溶液通过0.22 μM的过滤器进行灭菌并保存在-80 ℃,作为CSE的初始溶液。每次使用前制备工作浓度为20%的CSE溶液,现配现用。
1.2 人肺样本采集 肺切除标本取自延安大学附属医院的30例行肺切除术的患者。受试者分为3组:有COPD的吸烟者(10例)、无COPD的吸烟者(10例)、无COPD的非吸烟者(10例),获得了其肺组织样本,所有受试者临床稳定,无化疗或放疗,没有患者接受任何皮质类固醇或抗菌药物治疗,或有其他呼吸系统疾病史,哮喘,肺部感染的诊断,均签署了知情同意书,并获得本医院伦理委员会的批准和监督。用组织基因组DNA提取试剂盒提取样本DNA后,保存于-20 ℃,用于后期RT-PCR实验。
1.3 细胞培养 人支气管上皮细胞(HBEC)株购自中国科学院研究所,将购买的细胞从干冰中取出后,于42 ℃水中快速解冻,1 000 r/min离心3 min后用含有血清浓度为10%的1640培养基重悬细胞沉淀至90 mm培养皿中,在37 ℃、5%CO2的条件下于培养箱中培养24 h后,将支气管上皮细胞暴露于20%CSE条件下24 h以模拟COPD细胞。
1.4 ELISA实验 将20%CSE处理过的支气管上皮细胞按1×105个/孔接种至96孔板,待细胞密度大约70%左右时,按照Asvanced转染试剂说明书将miR-145mimics/inhibitor(10 μM)、NC mimics/inhibitor(10 μM)进行转染,48 h后,收集细胞上清进行ELISA检测。将ELISA试剂盒从4 ℃取出后室温放置20 min,配制浓度分别为0、18.75、37.5、75、150、300、600 pg/ml的标准品,分别将细胞上清和不同浓度标准品按100 μl/孔加入酶标孔中,室温孵育2 h;每孔300 μl洗涤液洗涤5次;加入生物素化抗体100 μl/孔,室温孵育1 h;每孔300 μl洗涤液洗涤5次;加入100 μl/孔辣根过氧化物酶,室温避光孵育20 min后,洗涤5次;加入100 μl/孔TMB溶液,室温避光孵育20 min;加入50 μl/孔终止液,混匀后于酶标仪中测量OD450值。通过绘制标准曲线计算细胞上清中IL-6、IL-8、IL-10的浓度。
1.5 细胞增殖实验 将20%CSE处理过的支气管上皮细胞按1×105个/孔接种至96孔板,待细胞密度大约70%时,将miR-145mimics/inhibitor(10 μM)、NC mimics/inhibitor(10 μM)进行转染,转染48 h后,每孔加入10 μl CCK-8溶液,在37 ℃、5%CO2的条件下于培养箱中孵育2 h,于酶标仪中测量OD450值,进行分析。
1.6 RT-PCR实验 将20%CSE处理过的支气管上皮细胞按1×106个/孔接种至12孔板,待细胞密度约70%左右时,将miR-145 mimics/inhibitor(100 μM)、NC mimics/inhibitor(100 μM)、pEGFP-N1-SMAD3/pEGFP-N1(5 μg)进行转染,48 h后,用总RNA提取试剂盒提取细胞的总RNA,利用核酸浓度测定仪进行浓度的测定后,各取2 μg用通用反转录试剂盒进行cDNA的反转。用反转录得到的cDNA为模板,β-actin作内参,通过RT-PCR检测不同样品中SMAD3、IL-6、IL-8、IL-10、MMP-9、EMMPRIN、P13K、Akt、mTOR的含量;同时,以实验提取的DNA为模板,U6或β-actin作内参,检测血液样品中miR-145、SMAD3的含量。反应体系包括:cDNA/DNA 1 μl,2×Ultra SYBR Mixture 10 μl,上下游引物各1 μl,dd H2O 7 μl。反应条件:预变性95 ℃ 10 min;95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,采集荧光,共40个循环;溶解曲线55~95 ℃,每次升高0.5 ℃。每个样品设置3个重复,相对定量结果用2-△△CT法分析。RT-PCR定量引物见表1。
1.7 蛋白免疫印迹实验 将20%CSE处理过的支气管上皮细胞按1×106个/孔接种至6孔板,待细胞密度约70%时,将miR-145 mimics/inhibitor(200 μM)、NC mimics/inhibitor(200 μM)、pEGFP-N1-SMAD3/pEGFP-N1(10 μg)进行转染,48 h后,用含有PMSF的RIPA裂解液提取总蛋白后,使用BCA试剂盒确定浓度。通过12%SDS-PAGE电泳后,将其转移至PVDF膜,用5%脱脂奶粉封闭后,将膜与特异性一抗(SMAD3、IL-6、IL-8、IL-10、MMP-9、EMMPRIN、P13K、Akt、mTOR)在4 ℃孵育过夜,用TBST洗涤后,将膜与二抗在室温下孵育1 h,用TBST洗涤后,加入ECL显色液,于凝胶成像仪中曝光拍照。

表1 RT-PCR的定量引物
1.8 荧光素酶活性分析实验 应用TargetScan、miRanda和PicTar数据库分析miR-145与SMAD3的结合位点。将含有miR-145结合位点的SMAD3-3′UTR-WT和定点突变的SMAD3-3′UTR-MUT(将SMAD3-3′UTR基因片段中与miR-145相互结合的位点突变为互补序列)插入到荧光素酶报告载体pGL3中。将支气管上皮细胞接种至12孔板中,分别将Asvanced转染试剂(5 μl)与miR-145 mimics(100 μM)+pGL3-SMAD3-3′UTR-WT质粒(5 μg)、NC mimics(100 μM)+pGL3-SMAD3-3′UTR-WT(5 μg)、miR-145 mimics(100 μM)+pGL3-SMAD3-3′UTR-MUT质粒(5 μg)、NC mimics(100 μM)+pGL3-SMAD3-3′UTR-MUT(5 μg)转染细胞48 h后,按照荧光素酶活性检测试剂盒说明书检测荧光素酶的活性。
2 结果
2.1 miR-145、SMAD3在COPD吸烟者、无COPD吸烟者、无COPD未吸烟者肺组织中的表达 为了验证miR-145在慢性阻塞性疾病中低表达,本研究对有COPD的吸烟者、无COPD的吸烟者、无COPD的非吸烟者肺组织中miR-145、SMAD3的含量进行了检测。
结果显示,有COPD的吸烟者与无COPD的非吸烟者比较,miR-145的含量降低,SMAD3的含量升高(图1)。综上,miR-145在COPD中低表达,SMAD3高表达,提示我们应该更进一步研究两者在COPD发生发展过程中的作用。

图1 RT-PCR检测不同样品肺组织中miR-145、SMAD3的表达注:与无COPD的非吸烟者组比较,*P<0.05,**P<0.01,***P<0.001
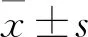
2.2 miR-145抑制COPD炎症的发生 miR-145 mimics /inhibitor转染20%CSE处理的支气管上皮细胞,检测其IL-6、IL-8、IL-10的表达情况。ELISA结果显示,miR-145 mimics组IL-6、IL-8、IL-10的含量均低于NC mimics 组(图2A~C)。RT-PCR和Western blot结果显示,miR-145 mimics组与NC mimics组比较,miR-145 mimics能够显著抑制IL-6、IL-8、IL-10 的表达(图2D~G)。miR-145 inhibitor组与NC inhibitor 组比较,与以上结果完全相反(图2A~G)。综上,miR-145能够抑制支气管上皮细胞炎症的发生,从而减缓COPD的症状。
2.3 miR-145促进COPD ECM的降解 将miR-145 mimics /inhibitor转染20%CSE处理过的支气管上皮细胞进行RT-PCR和Western blot检测,结果显示,miR-145 mimics组与NC mimics组比较,miR-145 mimics能够促进MMP-9、EMMPRIN 的表达。miR-145 inhibitor组和NC inhibitor组比较,与以上结果完全相反。综上,miR-145通过抑制支气管上皮细胞炎症的发生从而促进ECM的降解见图3。
2.4 miR-145通过P13K/Akt/mTOR调节细胞的增殖 将miR-145 mimics /inhibitor转染20%CSE处理过的支气管上皮细胞,首先通过CCK-8法检测细胞的增殖情况,结果显示,miR-145 mimics组与NC mimics组比较,miR-145 mimics能够抑制支气管上皮细胞的增殖(图4A)。RT-PCR和Western blot结果显示,miR-145 mimics组与NC mimics组比较,miR-145 mimics能够抑制P13K、Akt、mTOR的表达(图4B~E)。miR-145 inhibitor组与NC inhibitor 组比较,与以上结果完全相反(图4)。综上,miR-145通过抑制P13K/Akt/mTOR通路的发生,从而抑制细胞的生长,减缓COPD疾病的发生。
2.5 荧光素酶活性分析实验验证miR-145靶向结合SMAD3 首先,通过TargetScan、miRanda和PicTar数据库分析比对,结果显示,SMAD3-3’UTR中包含了能够与miR-145完全互补的一段序列(图5A)。荧光素酶活性分析实验结果显示,miR-145 mimics+pGL3-SMAD3-3’UTR-WT组与NC mimics+pGL3-SMAD3-3′UTR-WT组比较,荧光素酶活性显著降低,而突变型两组相比荧光素酶活性没有显著变化(图5B)。然后,将miR-145 mimics /inhibitor转染支气管上皮细胞后,RT-PCR和Western blot结果显示,miR-145 mimics组与NC mimics组比较,miR-145 mimics能够抑制SMAD3的表达(图5C~D),miR-145 inhibitor组与NC inhibitor 组比较,与以上结果完全相反(图5C~D)。
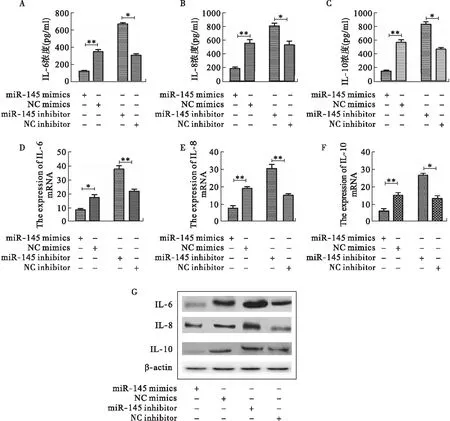
图2 miR-145对COPD炎症的影响
ics/inhibitor对IL-6、IL-8、IL-10表达的影响。与NC mimics/inhibitor组比较,*P<0.05,**P<0.01

图3 RT-PCR、Western blot方法检测miR-145 mimics/inhibitor对MMP-9、EMMPRIN表达的影响注:与NC mimics/inhibitor组比较,*P<0.05,**P<0.01
2.6 SMAD3对COPD炎症的发生、ECM的降解以及P13K/Akt/mTOR通路的影响 将pEGFP-N1-SMAD3质粒转染20%CSE处理过的支气管上皮细胞48 h后进行RT-PCR、Western blot检测,结果显示,pEGFP-N1-SMAD3组与pEGFP-N1组比较,SMAD3能够促进IL-6、IL-8、IL-10、P13K、Akt、mTOR的表达,抑制MMP-9、EMMPRIN的表达(图6A~B)。
3 讨论
COPD是一种慢性非均质性肺疾病,检查方法主要通过肺功能检查、X线拍片、CT、血气分析等等,该病的治疗方法主要包括药物治疗和康复治疗,治疗策略旨在改善症状并防止病情加重,这些方法主要基于疾病的严重程度和症状,而不是基于个体的疾病病理,都不利于患者疾病的诊断与治疗[16-17]。

图4 miR-145对COPD增殖的影响注:A.CCK-8法检测miR-145 mimics/inhibitor对细胞增殖的影响;B~E.RT-PCR、Western blot方法检测miR-145 mimics/inhibitor对 P13K/Akt/mTOR通路的影响。与NC mimics/inhibitor组比较,*P<0.05,**P<0.01,***P<0.001
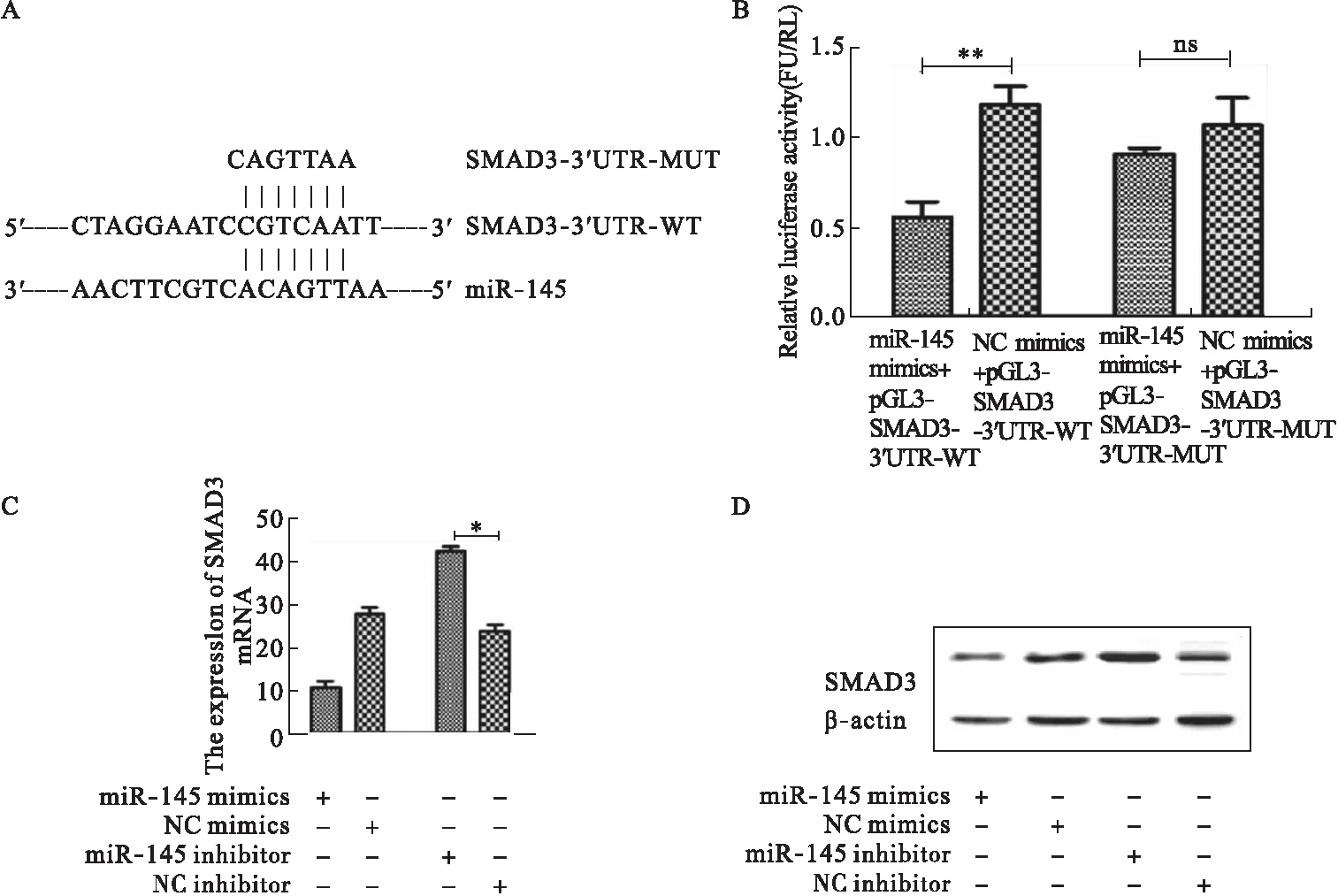
图5 荧光素酶活性分析实验验证miR-145靶向SMAD3
越来越多的研究发现,miRNAs在肺部疾病的发生发展中具有重要的作用,对癌症的诊断、预防以及新药物的研发具有重要的意义[18-19]。有研究报道,miRNA-145在COPD患者的肺组织中低表达,并且发现上调miRNA-145能够抑制肺部炎症的发生,促进细胞的凋亡[13]。因此,本研究首先通过RT-PCR检测了有COPD的吸烟者、无COPD的吸烟者、无COPD的未吸烟者的肺组织中miRNA-145的表达水平,发现COPD吸烟患者的肺组织中miRNA-145的表达量较低,验证了以上结果。COPD的发生会导致肺部组织炎症的发生,炎症因子的持续浸润会加重肺部组织的损伤,加速肺部纤维细胞的活化,从而抑制ECM的降解途径,最终导致气道重塑,对肺组织造成不可逆转的损伤,严重加剧患病程度[20-21]。
图6 RT-PCR、Western blot检测SMAD3对IL-6、IL-8、IL-10、MMP-9、EMMPRIN、P13K、Akt、mTOR的影响注:*P<0.05,**P<0.01,***P<0.001
SMAD3是SMAD家族中的一个蛋白,有研究表明,SMAD3在肿瘤以及癌症的发生发展中具有重要的作用。研究发现,SMAD3磷酸化水平的降低,能够抑制大鼠肺部炎症的发生,改善肺功能;miR-140通过下调Smad3蛋白的表达抑制非小细胞肺癌的侵袭和迁移;欧前胡素通过TGF-β1/Smad3和PI3K/Akt通路抑制小鼠的哮喘;人类脂肪间充质干细胞通过与TGF-β/Smad和PI3K / AKT信号通路交叉相互作用,促进乳腺癌MCF7细胞上皮-间质转化;TGF-β/Smad和PI3K/Akt/mTOR信号通路参与了肺癌细胞上皮-间质转化[22-25]。但是,在COPD中,SMAD3与P13K/Akt/mTOR通路的关系,少有文献报道。在前期的实验研究中,通过软件分析预测发现,miRNA-145可能靶向SMAD3基因,并且通路分析显示,可能与P13K/Akt/mTOR通路有关。
本研究将miR-145 mimics/inhibitors转染COPD细胞模型48 h后,发现miR-145通过靶向SMAD3,抑制COPD炎症的发生,促进ECM的降解,并且通过抑制P13K/Akt/mTOR通路的发生,抑制细胞的增殖,最终改善COPD的发展。

