芬戈莫德联合顺铂通过调控COL11A1表达对顺铂耐药胃癌细胞增殖和凋亡的影响
薛 珊,邢 颖*,宋华伟
0 引言
胃癌是常见的恶性肿瘤,具有较高的发病率和死亡率[1]。胃癌早期诊断率较低,多数患者在确诊时已属于晚期,错过手术治疗的最佳时期[2]。化疗是晚期胃癌治疗的主要方法,但肿瘤细胞常对化疗药物产生耐药性,导致化疗疗效降低甚至治疗失败[3]。顺铂(Cisplatin,DDP)是常用的化疗药物,寻找增强肿瘤细胞对DDP敏感性的方法对于改善晚期胃癌患者化疗疗效具有积极意义。芬戈莫德(Fingolimod,FTY720)是一种从冬虫夏草中分离得到的鞘氨醇1-磷酸盐受体抑制剂,可促进淋巴细胞归巢、诱导淋巴细胞凋亡及抑制T淋巴细胞活性[4]。近年来研究显示,FTY720还可诱导肿瘤细胞凋亡、增强化疗敏感性及抑制肿瘤转移,具有一定的抗肿瘤作用[5-6]。目前,还未见FTY720对胃癌耐药细胞影响的相关报道。本研究主要观察了FTY720联合DDP对DDP耐药胃癌细胞HGC27/DDP增殖和凋亡的影响及其可能的作用机制,以期为提高晚期胃癌化疗疗效提供新途径。
1 材料与方法
1.1 细胞和实验试剂 胃癌细胞系HGC27,上海美轩生物科技有限公司;注射用DDP,山东齐鲁制药公司;胎牛血清(FBS)、RPMI 1640培养基,美国Gibco公司;FTY720和四甲基噻唑蓝(MTT),美国Sigma公司;LipofectamineTM2000试剂盒和Trizol试剂,美国Invitrogen公司;PCR引物、COL11A1的小干扰RNA(si-COL11A1)及乱序无意义阴性序列(si-NC)、COL11A1过表达载体(pcDNA-COL11A1)及空载体(pcDNA),上海吉玛制药技术有限公司;二喹啉甲酸(BCA)蛋白检测试剂盒和Annexin V-FITC/PI细胞凋亡试剂盒,上海碧云天公司;XI型胶原α1链(COL11A1)单克隆抗体,武汉云克隆科技股份有限公司;细胞周期蛋白D1(CyclinD1)和活化的半胱天冬酶-3(Cleaved-caspase-3)单克隆抗体,武汉博士德公司;逆转录试剂盒和PCR试剂盒,大连宝生物工程有限公司。
1.2 实验方法
1.2.1 HGC27/DDP细胞建立和转染 复苏HGC27细胞,加入含10%FBS的RPMI 1640培养基(完全培养基)培养。待细胞融合至80%左右时,0.25%胰蛋白酶消化,传代培养。用含0.1 μg/ml DDP完全培养基作用于HGC27细胞,连续作用2周后,间歇增加5 μg/ml DDP至DDP浓度为10 μg/ml。诱导后,HGC27细胞能够在含10 μg/ml DDP的培养基中存活,即获得耐DDP的HGC27细胞HGC27/DDP。将对数增殖期的HGC27/DDP细胞以1×105个/孔接种于6孔板中,采用LipofectamineTM2 000脂质体法,分别转染si-COL11A1、si-NC、pcDNA-COL11A1、pcDNA。转染24 h后,更换培养基。再培养24 h,收集细胞备用。
1.2.2 细胞分组处理 HGC27/DDP细胞分为对照组(NC组)、DDP组、FTY720组、FTY720+DDP组。NC组:完全培养基干预;DDP组:含10 μg/ml[7]DDP的完全培养基干预;FTY720组:含10 μmol/L[7]FTY720的完全培养基干预;FTY720+DDP组:含10 μg/ml DDP和10 μmol/L FTY720的完全培养基共同干预。转染si-NC、si-COL11A1的细胞均用完全培养基干预,分别记为si-NC组和si-COL11A1组。转染pcDNA-NC、pcDNA-COL11A1的细胞均用含10 μg/ml DDP和10 μmol/L FTY720的完全培养基共同干预,记为pcDNA-NC+FTY720+DDP组和pcDNA-COL11A1+ FTY720+DDP组。
1.2.3 MTT检测HGC27/DDP细胞增殖 细胞以5×103个/孔接种于96孔板中,按“1.2.2”分组处理,每组设3个复孔。培养24 h后,加20 μl的MTT(5 mg/ml)。孵育4 h后,吸弃培养基,加150 μl二甲基亚砜,振荡混匀,酶标仪490 nm测吸光度值(A)。细胞存活率(%)=A实验组/A对照组×100%。实验重复3次。
1.2.4 流式细胞仪检测 HGC27/DDP细胞以2.5×104个/孔接种于24孔板中,按“1.2.2”分组处理,每组设3个复孔。培养24 h后,胰蛋白酶消化,收集细胞。取1.0×106个细胞,并用适量磷酸盐缓冲液(PBS)清洗2次。1 500 r/min离心5 min,弃上清。加400 μl结合缓冲液,混悬细胞。加10 μl Annexin V-FITC和5 μl PI,室温避光孵育15 min。再加100 μl结合缓冲液,混匀后上流式细胞仪检测细胞凋亡。
1.2.5 Western blot法检测细胞中CyclinD1、Cleaved-caspase-3和COL11A1蛋白表达 细胞接种和分组处理时间同“1.2.4”。RIPA裂解液提取各组细胞中总蛋白,BCA法测蛋白浓度后定量,行SDS-PAGE电泳,并湿转至聚PVDF膜,且于5%脱脂奶粉中封闭1 h。然后分别加CyclinD1(1∶800)、Cleaved-caspase-3(1∶1 000)和COL11A1(1∶500)一体,4 ℃孵育过夜。再加山羊抗兔二抗(1∶1 000),室温孵育1 h。最后加化学发光试剂,避光显影,曝光拍照。以β-actin为内参,Image J软件分析目的蛋白条带灰度值。
1.2.6 实时荧光定量PCR(RT-qPCR)检测COL11A1 mRNA表达 细胞接种和分组处理时间同“1.2.4”。Trizol试剂提取各组细胞中总RNA,逆转录为cDNA后进行扩增。扩增程序:95 ℃ 10 min,95 ℃ 10 s,60 ℃ 60 s,72 ℃ 30 s,共35个循环。COL11A1上游5′-GTCGGCAAGTCGA-TGCTCG-3′,下游5′-GCTCGAAAGCTCGCAACGTGCT-3′;β-actin上游5′-GTGCAAGCTGTGCCGCACG-3′,下游5′-CGCAACGTGCGTACAACAGT-3′。2-△△Ct法计算COL11A1 mRNA相对于β-actin的相对表达水平。

2 结果
2.1 FTY720联合顺铂对HGC27/DDP细胞增殖的影响 与NC组比较,FTY720组和FTY720+DDP组HGC27/DDP细胞存活率和CyclinD1蛋白表达降低(P<0.05),DDP组HGC27/DDP细胞存活率和CyclinD1蛋白表达差异无统计学意义(P>0.05)。与DDP组或FTY720组比较,FTY720+DDP组HGC27/DDP细胞存活率和CyclinD1蛋白表达降低(P<0.05)。见图1、表1和表2。
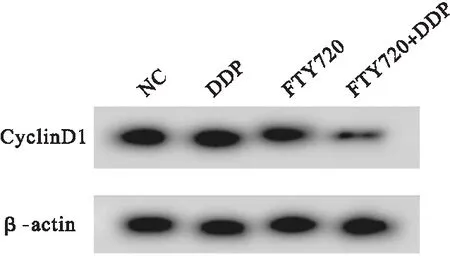
图1 Western blot检测CyclinD1蛋白表达
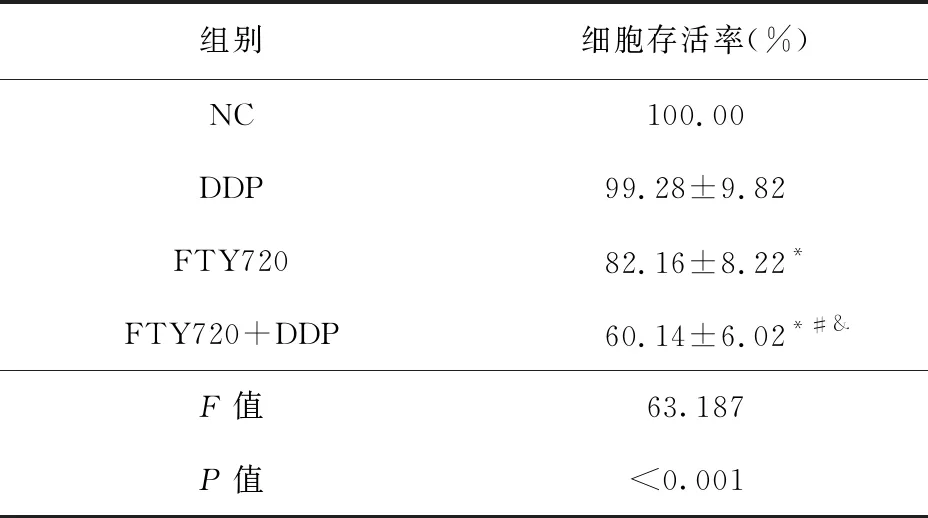
表1 FTY720联合顺铂对HGC27/DDP细胞 增殖的影响(n=9)
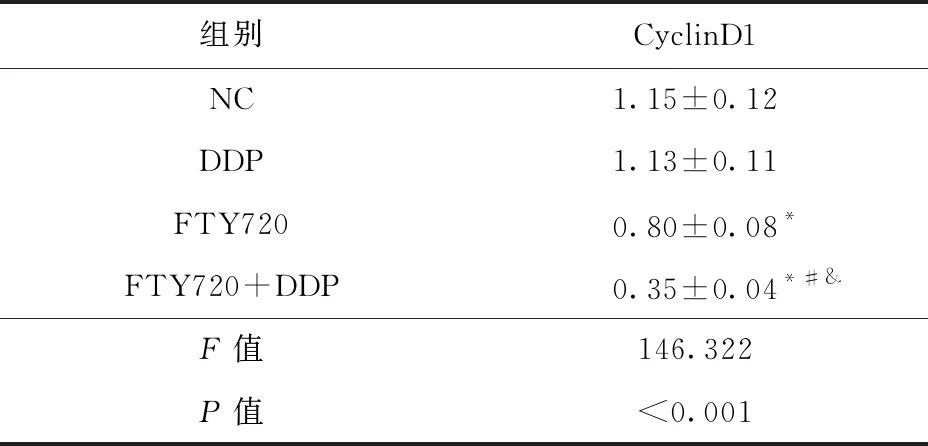
表2 FTY720联合顺铂对HGC27/DDP细胞CyclinD1 蛋白表达的影响(n=9)
2.2 FTY720联合顺铂对HGC27/DDP细胞凋亡的影响 与NC组比较,FTY720组和FTY720+DDP组HGC27/DDP细胞凋亡率和Cleaved-caspase-3蛋白表达升高(P<0.05),DDP组HGC27/DDP细胞凋亡率和Cleaved-caspase-3蛋白表达差异无统计学意义(P>0.05)。与DDP组或FTY720组比较,FTY720+DDP组HGC27/DDP细胞凋亡率和Cleaved-caspase-3蛋白表达升高(P<0.05)。见图2、表3。
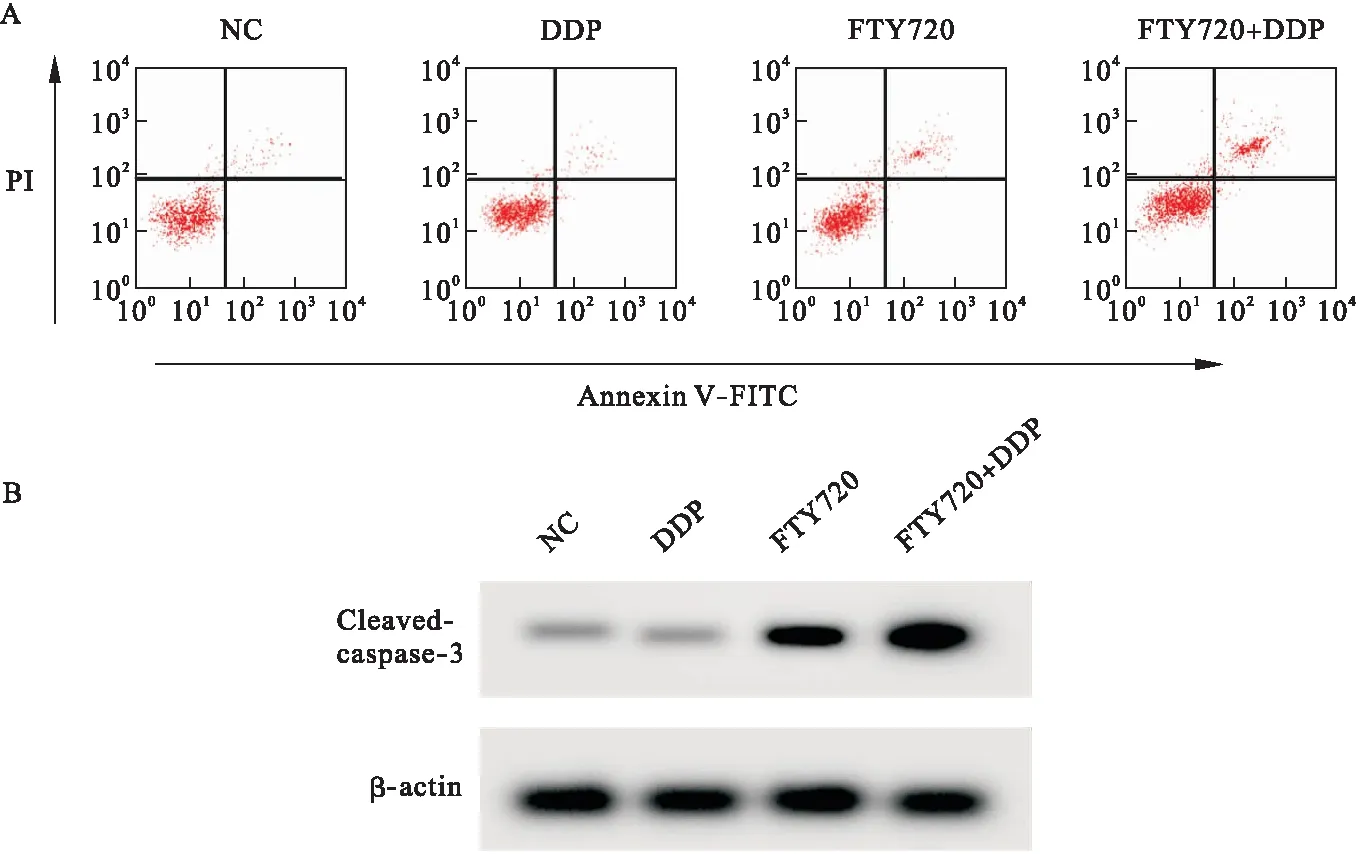
图2 FTY720联合顺铂对HGC27/DDP细胞凋亡的影响注:A.流式细胞仪检测细胞凋亡,B.Western blot检测Cleaved-caspase-3蛋白表达
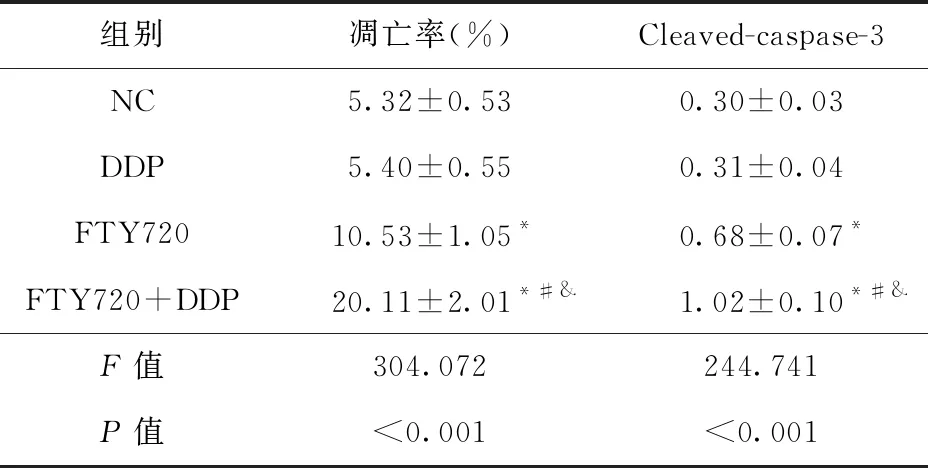
表3 FTY720联合顺铂对HGC27/DDP细胞 凋亡的影响(n=9)
2.3 FTY720联合顺铂对HGC27/DDP细胞COL11A1基因表达的影响 与NC组比较,FTY720组和FTY720+DDP组HGC27/DDP细胞中COL11A1 的mRNA和蛋白表达降低(P<0.05),DDP组HGC27/DDP细胞中COL11A1 的mRNA和蛋白表达差异无统计学意义(P>0.05)。与DDP组或FTY720组比较,FTY720+DDP组HGC27/DDP细胞中COL11A1 的mRNA和蛋白表达降低(P<0.05)。见图3、表4。
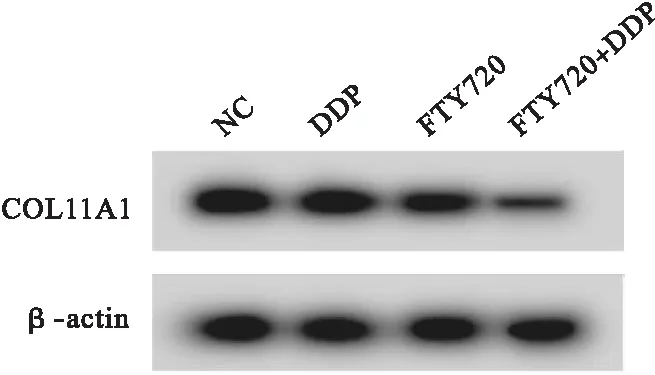
图3 Western blot检测COL11A1蛋白表达
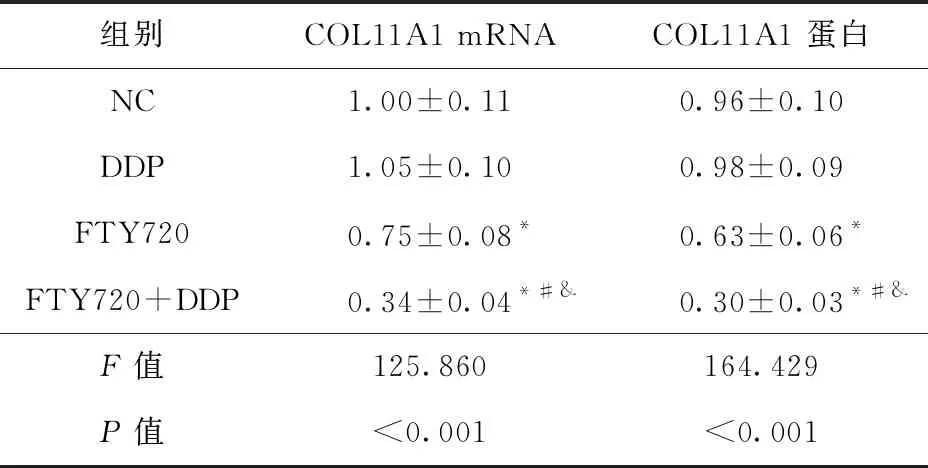
表4 FTY720联合顺铂对HGC27/DDP细胞 COL11A1基因表达的影响(n=9)
2.4 COL11A1低表达对HGC27/DDP细胞增殖和凋亡的影响 与si-NC组比较,si-COL11A1组HGC27/DDP细胞存活率、COL11A1和CyclinD1蛋白表达降低(P<0.05),凋亡率和Cleaved-caspase-3蛋白表达升高(P<0.05)。见图4、表5。
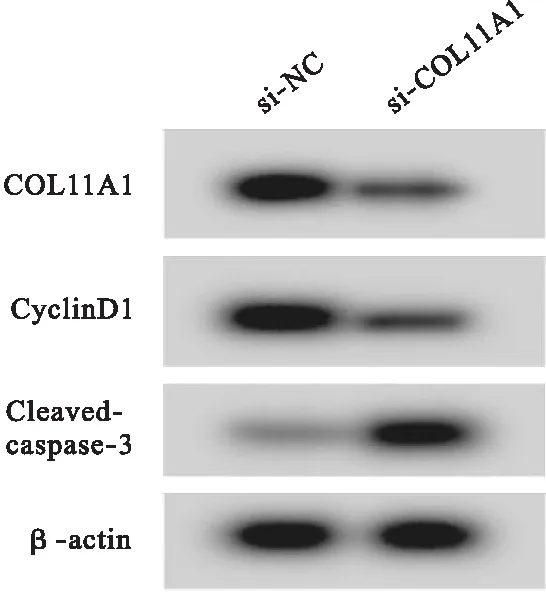
图4 Western blot检测COL11A1、CyclinD1、Cleaved-caspase-3蛋白表达
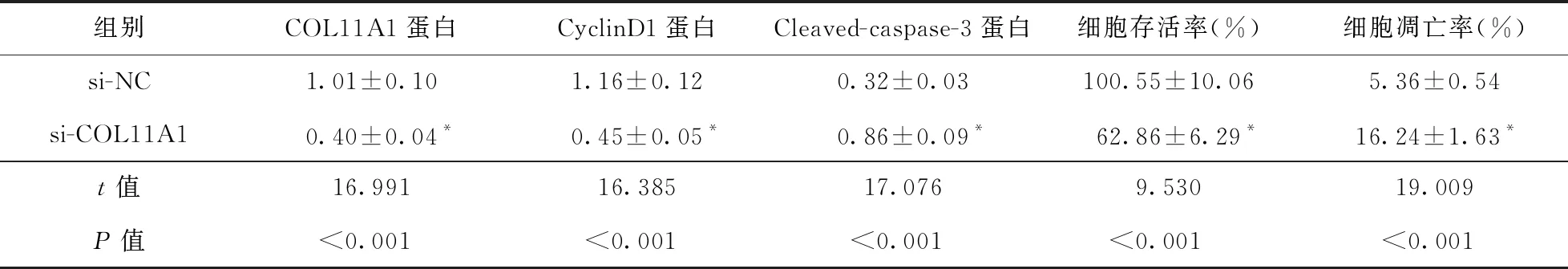
表5 COL11A1低表达对HGC27/DDP细胞增殖和凋亡的影响(n=9)
2.5 COL11A1高表达逆转FTY720联合顺铂对HGC27/DDP细胞的抗肿瘤作用 与pcDNA-NC+FTY720+DDP组比较,pcDNA-COL11A1+FTY720+DDP组HGC27/DDP细胞存活率、COL11A1和CyclinD1蛋白表达升高(P<0.05),凋亡率和Cleaved-caspase-3蛋白表达降低(P<0.05)。见图5、表6。
3 讨论
肿瘤细胞对化疗药物的耐药性是肿瘤化疗失败的主要原因[8],降低肿瘤细胞对化疗药物的耐药性对于提高肿瘤化疗疗效和改善患者预后具有重要意义。FTY720是一种新型免疫抑制药物,可与西罗莫司、环孢素等联合应用增强免疫抑制作用,且能够抑制多种肿瘤细胞的生长[9-10]。有报道,FTY720可有效增强吉西他滨对人肺癌细胞株增殖的抑制作用及凋亡促进作用,为非小细胞肺癌的治疗提供了新方法[11-12]。FTY720通过下调趋化因子受体CCR4表达降低调节性T细胞的迁移能力来抑制小鼠结肠癌的发展[13]。FTY720可诱导乳腺癌细胞凋亡,为乳腺癌的治疗提供了新思路[14]。目前,FTY720对胃癌耐药细胞增殖、凋亡等恶性生物学行为的影响还未知。
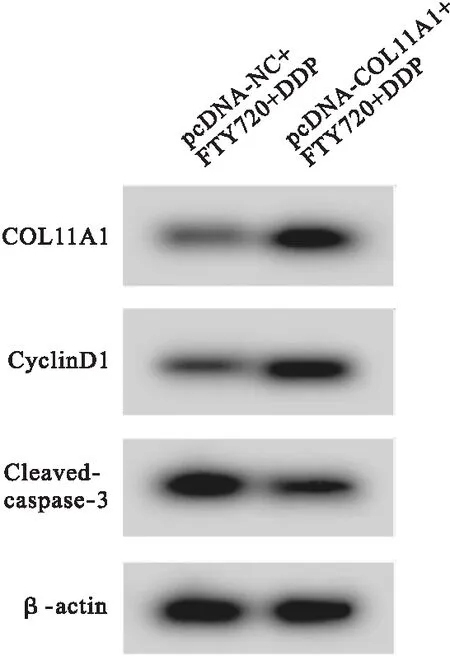
图5 Western blot检测COL11A1、CyclinD1和Cleaved-caspase-3蛋白表达
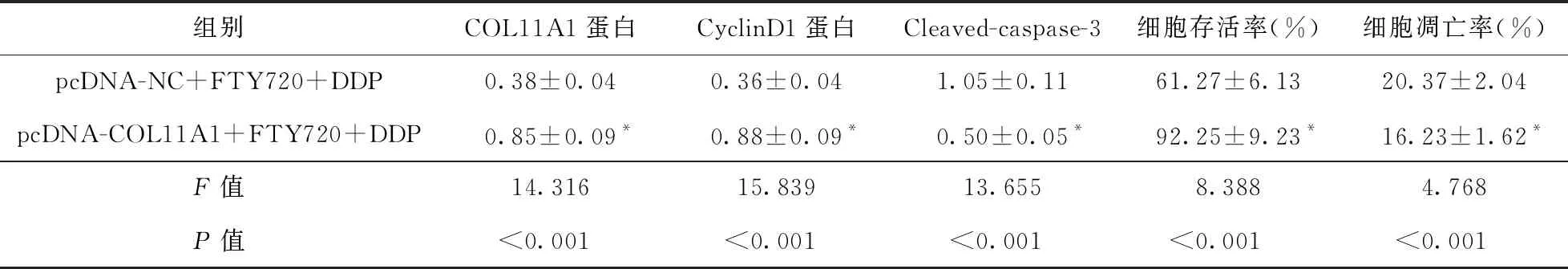
表6 COL11A1高表达逆转FTY720联合顺铂对HGC27/DDP细胞的抗肿瘤作用(n=9)
细胞的异常增殖可诱发肿瘤。CyclinD1是细胞周期调节蛋白,可促进细胞周期由G1期向S期转变,加速细胞增殖[15]。诱导肿瘤细胞凋亡是肿瘤治疗的一种途径。caspase-3是caspase级联反应关键调控蛋白,活化后可放大caspase级联反应,促进细胞凋亡[16]。本研究显示,FTY720作用耐顺铂胃癌细胞HGC27/DDP后,细胞存活率和CyclinD1蛋白表达降低,凋亡率和Cleaved-caspase-3蛋白表达升高,提示FTY720可能通过抑制CyclinD1表达降低HGC27/DDP细胞增殖,促进Cleaved-caspase-3蛋白表达诱导细胞凋亡,提示FTY720可改善胃癌细胞对顺铂的耐药性。FTY720与顺铂共同作用HGC27/DDP细胞后,细胞存活率、凋亡率及CyclinD1和Cleaved-caspase-3蛋白表达的变化更加明显,提示FTY720可增强顺铂对胃癌耐药细胞增殖抑制剂的凋亡促进作用。
COL11A1是纤维胶原蛋白家族的重要成员之一,在前列腺癌[17]、喉鳞状细胞癌[18]等多种肿瘤中表达异常,参与肿瘤发生发展。研究显示,干扰COL11A1表达可降低卵巢癌顺铂耐药细胞的迁移、侵袭和克隆形成能力,降低卵巢癌顺铂耐药细胞的耐药性[19]。Li等[20]研究显示,COL11A1在胃癌中发挥致癌基因作用,其表达升高促进胃癌细胞生长和侵袭,是胃癌治疗的潜在靶标。然而,目前尚不清楚COL11A1对胃癌细胞耐药性的影响还未知。本研究显示,抑制COL11A1表达可降低耐顺铂胃癌细胞HGC27/DDP的增殖能力并促进细胞凋亡,提示COL11A1可能是改善胃癌细胞对顺铂耐药性的作用靶点。FTY720可抑制耐顺铂胃癌细胞HGC27/DDP中COL11A1的mRNA和蛋白表达,而FTY720联合DDP对HGC27/DDP细胞中COL11A1的mRNA和蛋白表达的抑制作用更加明显,提示FTY720联合DDP可能通过抑制细胞中COL11A1表达增强胃癌耐药细胞对顺铂的敏感性。本研究还显示,COL11A1过表达降低了FTY720联合DDP对HGC27/DDP细胞增殖的抑制作用以及凋亡的促进作用,进一步说明了FTY720联合DDP通过下调COL11A1表达降低胃癌耐药细胞对顺铂的耐药性。
综上所述,FTY720联合DDP可抑制胃癌耐顺铂细胞的增殖,并促进细胞凋亡,其可能通过下调COL11A1表达降低胃癌耐顺铂细胞对顺铂的耐药性,为通过逆转胃癌顺铂耐药细胞的耐药性来改善胃癌化疗疗效提供了新思路。

